新生儿缺氧缺血性脑病血清细胞因子变化及临床意义
2013-09-11王团美刘晓亮
王团美,刘晓亮
(长沙市中心医院,湖南 长沙 410000)
新生儿缺氧缺血性脑病(Hypoxic Ischemic Encephalopathy HIE)是指新生儿围产期窒息引起的部分或完全缺氧、脑血流量减少或暂停而导致的脑部损伤[1],是导致新生儿死亡和致残的重要因素[2]。HIE的发病机制十分复杂,近年来,免疫系统在HIE 发病中的作用日益受到重视[3]。国内外研究表明[4-5],脑缺血再灌注后,脑组织局部过度炎症反应是造成脑再灌注损伤的重要原因,而细胞因子在这个病理过程中起着非常重要的作用,因此,本文对白细胞介素1β(IL-1β)、白细胞介素6(IL-6)、白细胞介素8(IL-8)、白细胞介素10(IL-10)和肿瘤坏死因子α(TNF-α)这5 种致炎性细胞因子在HIE 患儿和正常儿童血清中含量的变化及其临床意义进行了研究,对加强HIE 病程监测,改善HIE的预后具有指导意义。
1 对象与方法
1.1 研究对象
HIE组:2007年1月~2011年12月我院新生儿病房收治的HIE 患儿112例,均符合新生儿缺氧缺血性脑病诊断标准[6]。其中,放弃治疗5例,转院治疗9例,共调查患儿98例。
正常对照组:随机抽取同期正常分娩的新生儿100例,无宫内发育迟缓,宫内及生后无窒息,并排除宫内感染,生后7d 内无合并症,母亲孕期体健,分娩前无明显感染史,无血制品及免疫抑制或增强剂使用史。2组新生儿在性别、胎龄、出生体质量方面均无显著性差异。
1.2 方法
1.2.1 标本采集
HIE组和正常对照组新生儿均于出生后24h内(急性期)和出生后第7天(恢复期)以无菌操作采集外周静脉血2mL,用低温离心机(4 ℃、3000r/min)离心10min,收集上层血清,并置于-40℃冰箱内保存待检。
1.2.2 检测方法
用酶联免疫吸附试验(ELISA) 双抗体夹心法检测2组新生儿出生后24h 内和出生后第7天的血清IL-1β、IL-6、IL-8、IL-10和TNF-α 水平,酶标检测试剂盒由Rapul Bio Lab Calabasas,California,USA 公司提供,ELISA 检测分析仪为华东电子管厂产品。
1.2.3 HIE 临床分度
根据第7 版儿科学标准[1],将HIE 分为轻度、中度和重度三种,轻度患儿兴奋、抑制交替,肌张力正常或稍高,拥抱反射活跃,吸吮反射正常,瞳孔正常或扩大,EKG 正常,可有肌阵挛,无中枢性呼吸衰竭;中度患儿嗜睡,肌张力减低,拥抱反射减弱,吸吮反射减弱,瞳孔常缩小,EKG 呈低电压,常伴有惊厥或中枢性呼吸衰竭;重度患儿出现昏迷,肌松软,拥抱反射消失,吸吮反射消失,瞳孔不对称或扩大,EKG表现为爆发抑制和等电线,惊厥可呈持续状态,中枢性呼吸衰竭明显。
1.2.4 资料处理
实验数据以mean±SD表示,所有数据均采用Epidata 双核双录法,并导入SPSS17.0 进行统计分析。统计方法包括:统计描述、t 检验和方差分析。如无特殊说明,显著性水准=0.05,所有的P值均表示双侧概率。
2 结果
2.1 急性期HIE和对照组血清细胞因子水平比较
将HIE 分为轻、中和重三度,其中,HIE 轻度患儿42例,中度患儿31例,重度患儿25例,比较急性期不同临床分度的HIE 患儿和正常新生儿血清中IL-1β、IL-6、IL-8、IL-10、TNF-α 水 平的 差异,具体见表1 所示。经方差分析,不同临床分度的HIE 患儿和正常新生儿血清中IL-1β、IL-6、IL-8、IL-10、TNF-α 水平不完全相同(P<0.05)。
对不同临床分度的HIE 患儿和正常新生儿5种血清细胞因子水平进行LSD 两两比较,可知,轻、中、重三度HIE 患儿和正常新生儿血清IL-1β、IL-6、IL-8、IL-10、TNF-α 水平两两之间均具有统计学差异(P<0.05),HIE组患儿血清IL-1β、IL-6、IL-8、IL-10和TNF-α 水平均高于正常新生儿,且随着HIE 病情的加重,IL-1β、IL-6、IL-8、IL-10、TNF-α5 种细胞因子水平均有显著性上升 (P<0.05)。
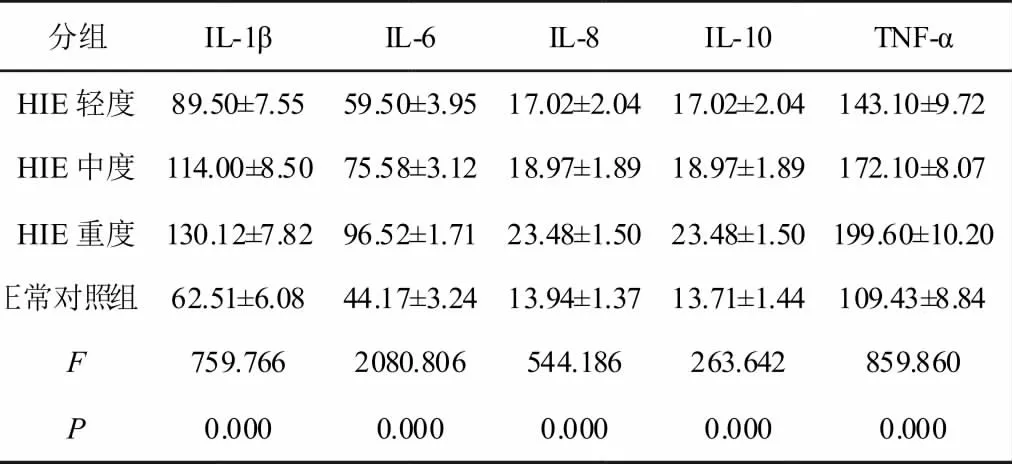
表1 HIE和对照组急性期血清细胞因子水平比较
2.2 恢复期HIE和对照组血清细胞因子水平比较
比较恢复期HIE组和正常新生儿血清IL-1β、IL-6、IL-8、IL-10和TNF-α 水平,具体见2 所示,经方差分析,在恢复期,HIE组患儿血清IL-1β、IL-6、IL-8、IL-10、TNF-α 水平与正常新生儿也不完全相同(P<0.05)。经LSD 两两比较法可知,恢复期,HIE 轻度患儿和正常新生儿的IL-6、IL-8、IL-10、TNF-α 水平无显著性差异,HIE中度患儿和正常新生儿的IL-8、IL-10 无显著性差异(P>0.05),HIE 轻度患儿和中度患儿IL-1β、IL-8、IL-10 无显著性差异,HIE中度患儿和重度患儿TNF-α 无显著性差异。
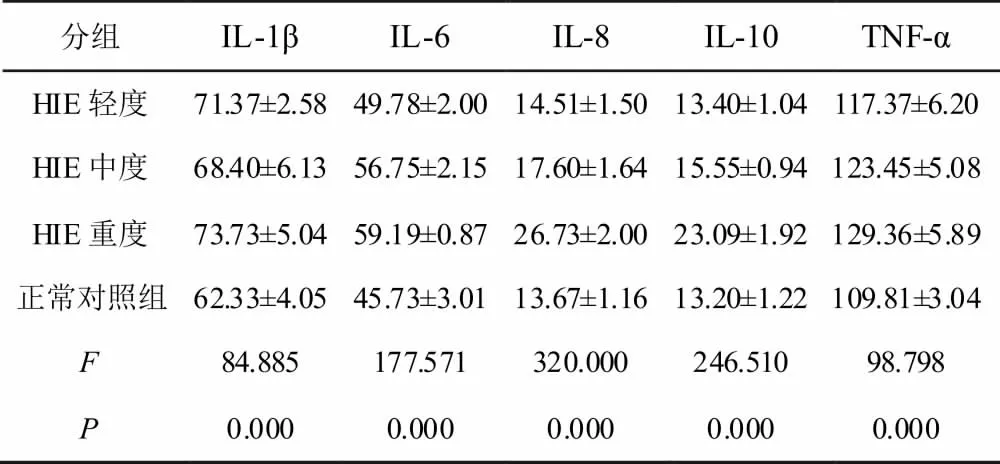
表2 HIE和对照组恢复期血清细胞因子水平比较
2.3 急性期和恢复期HIE 患儿的血清细胞因子水平比较
采用配对t 检验的方法,比较急性期和恢复期HIE 患儿的血清细胞因子水平,具体见表3 所示,可知,急性期IL-1β、IL-6、IL-8、IL-10和TNF-α5种血清细胞因子水平都显著高于恢复期(P<0.05)。
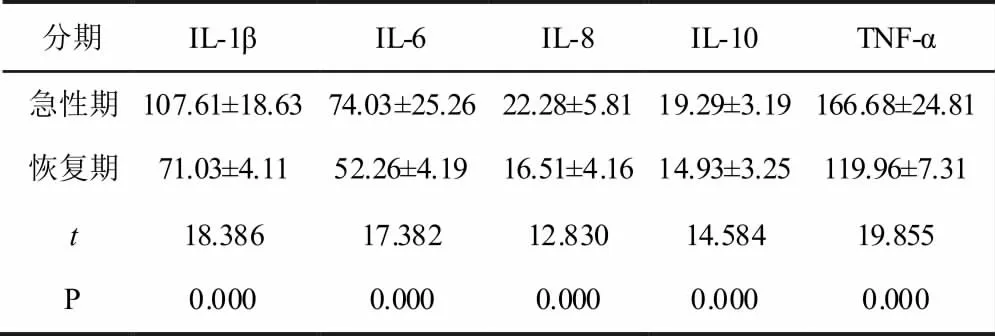
表3 急性期与恢复期HIE 血清细胞因子水平比较
3 讨论
脑缺血再灌注后,脑组织局部过度炎性反应是导致新生儿HIE 脑损伤的主要机制之一[7~8]。IL-1β、IL-6、IL-8、IL-10和TNF-α 是炎性反应中较为主要的细胞因子,临床研究发现[9~17],这几种细胞因子相互作用,在新生儿脑缺血-再灌注损伤过程中具有重要的意义。
本研究显示,急性期HIE组患儿血清IL-1β水平高于正常新生儿,且随着HIE 病情的加重,IL-1β 水平有显著性上升,与王建、Aly 等[9~10]报道一致,经治疗后,恢复期HIE 患儿IL-1β 水平显著降低,中度患儿IL-1β 水平和轻度患儿已无显著性差异,IL-1β 水平的降低,在新生儿HIE 恢复过程中发挥了重要的作用;急性期HIE组患儿血清IL-6水平高于正常新生儿,且随着HIE 病情的加重,IL-6 水平有显著性上升,恢复期HIE 患儿IL-6 水平显著降低,轻度患儿IL-6 水平已达到正常新生儿水平,与刘文东、Hasan T 等[11~12]报道一致;急性期HIE组患儿血清IL-8 水平高于正常新生儿,且随着HIE 病情的加重,IL-8 水平有显著性上升,与Berger RP、贾菲菲等[13~14]研究结果一致,经治疗后,恢复期HIE 患儿IL-8 水平显著降低,HIE 轻度患儿和中度患儿IL-8 已达正常新生儿水平,因此,IL-8的动态变化可作为HIE 治疗效果的监测及预后的评估;本研究显示,急性期HIE组患儿血清IL-10 水平高于正常新生儿,且随着HIE 病情的加重,IL-10 水平有显著性上升,恢复期HIE 患儿IL-10 水平显著降低,HIE 轻度患儿和中度患儿IL-10已达正常新生儿水平;急性期HIE组患儿血清TNF-α 水平高于正常新生儿,且随着HIE 病情的加重,TNF-α 水平有显著性上升,恢复期,TNF-α水平显著下降,HIE 轻度患儿TNF-α 已达正常新生儿水平,HIE中度患儿和重度患儿TNF-α 无显著性差异,随着脑缺血缺氧损伤的逐渐好转,血清TNF-α 也逐渐恢复正常。
本研究说明,血清细胞因子IL-1β、IL-6、IL-8、IL-10、TNF-α 均参与了新生儿HIE 脑损伤的过程,随着HIE 病情的加重,细胞因子水平显著上升,在HIE 脑损伤好转时,细胞因子水平逐渐下降。其中,IL-1β 可诱导多种损伤性细胞因子的合成,促进过度炎性反应,并促进自由基的释放及增强兴奋性氨基酸的毒性作用,加重脑缺血-再灌注损伤的发生[16];IL-6 可抑制TNF-α和IL-1β的合成,对抗兴奋性氨基酸的神经毒性,促进促肾上腺皮质激素释放激素的释放以及抑制免疫反应,对中枢神经细胞起到保护作用;IL-8 具有强烈的趋化作用,通过吸引中性粒细胞至病变部位促进血管内血栓的形成,增强IL-1β、TNF-α的神经毒性作用,从而介导脑缺血-再灌注损伤的发生;IL-10 可抑制主要炎性因子TNF-α、IL-1β的产生,发挥广泛的抗炎作用,使机体内源性抗炎机制加强,有利于炎症的消除,对脑缺血-再灌注损伤具有保护作用[15];TNFα 在新生儿HIE中具有双重作用[16~17],首先它可通过抗氧化途径抵抗氧自由基的损伤,刺激星形细胞、成纤维细胞、胶质细胞表达合成神经生长因子,从而促进神经细胞的修复,其次,它还可以损伤血管内皮细胞,开放和破坏血脑屏障,促进和诱发IL-1β、IL-8 等细胞因子的合成和释放,促进过度炎性反应,诱导脑细胞调亡,加重脑缺血-再灌注损伤。
综上所述,IL-1β、IL-6、IL-8、IL-10、TNF-α五种血清细胞因子在新生儿HIE 脑损伤中发挥了重要的作用,其动态变化可作为HIE 病程监测的重要指标,加强对血清细胞因子的监测对减少脑缺血-再灌注损伤、改善HIE的预后具有重要的意义。
[1]沈晓明,王卫平,主编.儿科学[M].第7 版.北京:人民卫生出版社,2008,102.
[2]薛碧萍.新生儿缺氧缺血性脑病治疗进展[J].中国妇幼保健,2011,06:2571-2572.
[3]Distefano G,PraticòAD.Actualities on molecular pathogenesis and repairing processes of cerebral damage in perinatal hypoxic-ischemic encephalopathy [J].Ital J Pediatr,2010,16 (36):63.
[4]麦水强,陈铭珍,苏赞彩.新生儿缺氧缺血性脑病血清细胞因子测定及其临床意义.中国妇幼保健.2007,22(21):3001~3002.
[5]Nacinovic-Duletic A,Stifter S,Dvornik S,et al.Correlation of ser-um IL-6,IL-8 and IL-10 levelswith clinicopathological featuresand prognosis in patientswith diffuse large B-cell lymphoma[J].IntJ Lab Hematol,2008,30(3):230~239 .
[6]韩玉昆,杨于嘉,邵肖梅主编.新生儿缺氧缺血性脑病[M].第2 版.北京:人民卫生出版社,2010,6.
[7]董爱萍,姚锐,冯美果.新生儿缺氧缺血性脑病血清细胞因子的动态变化和预后分析.咸宁学院学报 (医学版).2011,25(2):144~145.
[8]毛琼,高改兰,何利珍,等.新生儿缺氧缺血性脑病血清细胞因子水平变化的临床意义[J].现代中西医结合杂志,2011,20(26):3256~3257.
[9]王健,陆勤.缺氧缺血性脑病新生儿血细胞因子表达的意义[J].实用儿科临床杂志,2006,21(6):341~342.
[10]Aly H,Khashaba MT,El Ayouty M,et al .IL-1β,IL-6 and TNF-αand out comes of neonatal hypoxic ischemic encephalopathy[J].Brain Dev,2006,28(3):178~182.
[11]刘文东,王彩霞,金心,等.新生儿缺氧缺血性脑病血清细胞因子测定及意义.中国优生与遗传杂志.2012,20(1):64~65.
[12]Hasan T,Mehmet Y,Necil K,et al.Value of biochemical markers for outcome in term infants with asphyxia [J].Obstet Gynecol Surv,2005,60(5):293~295.
[13]Berger RP,Bazaco MC,Wagner AK,et al.Trajectory analysis of serum biomarker concentrations facilitates outcome prediction after pediatric traumatic and hypoxemic brain injury[J].Dev Neurosci,2010,32 (5-6):396~405 .
[14]贾菲菲,徐德恩.新生儿缺氧缺血性脑病血清IL-8 水平与脑血流变化的临床研究[J].中国实用医药,2008,3(11):4~5.
[15]张晓燕,林丽星.部分细胞因子在新生儿缺氧缺血性脑病中的保护作用[J].兰州大学学报(医学版),2005,31(4):74~76.
[16]阎雯,黄妮娜,贾晓芳,等.IL-1β和TNF-α表达量与新生儿缺血缺氧性脑病脑损伤程度的相关性.细胞与分子免疫学杂志,2010,26(7):693~694.
[17]刘海英.缺氧缺血性脑病新生儿血清巨噬细胞移动抑制因子、肿瘤坏死因子-α和白细胞介素-1β 变化的意义.实用儿科临床杂志.2011,26(14):1110~1111.
