醋酸钾对尖晶石锰酸锂电化学性能的影响
2013-09-11王力臻孙新科彭天剑
王力臻,孙新科,彭天剑,张 勇
(1.郑州轻工业学院材料与化学工程学院,河南 郑州 450001;2.河南省表界面科学重点实验室,河南 郑州 450001;3.湖南汇通科技有限公司,湖南 长沙 410016)
锰的溶解及材料结构变化、Jahn-Teller 效应、电解液的分解和钝化膜的形成等[1],是尖晶石锰酸锂(LiMn2O4)循环稳定性差的主要原因。电解液优化可改善LiMn2O4的循环性能[2]。电解液中的微量H2O、HF 会与锂反应,增大电池不可逆容量,生成的Li2O 和LiF 对电池的循环不利,生成的气体还使电池内压增大,带来安全隐患;有机电解液中的溶剂和溶质会与H2O 反应,生成含质子氢的酸和醇,导致固体电解质相界面(SEI)膜不稳定[3];HF 还会加剧锰的溶解[4]。除去电解液中的水分及HF,可减轻尖晶石LiMn2O4的容量衰减,但由于锂盐制备时的固有弱点[5],很难将这些有害杂质含量降至理想的水平。可考虑优化电解液的组成,选择酸性低、热稳定性高的锂盐,选择抗氧化性强的溶剂和使用对HF具有捕获作用的添加剂。向1 mol/L LiBF4(或LiPF6)/EC+DME(体积比1∶1)电解液中加入碳酸丙烯酯(PC),当添加量相对于EC 超过35%时,以LiMn2O4为正极材料的电池低温性能较好,当PC 含量低于65%时,电池的高温贮存性能较好[6]。刘云建等[7]将添加剂MgO、LiF 和Li2CO3与LiMn2O4混合,降低了电解液中HF 的含量,增强了电极表面SEI 膜的致密性,减少了正极材料与电解液的接触面积。
醋酸钾(KAc)是强碱弱酸盐,可与电解液中的微量H2O、HF 发生反应,除去这两种杂质;K+和Li+处于同族,价态相同,可避免不等价离子造成电荷补偿的干扰[8]。本文作者将KAc 与LiMn2O4机械混合,研究KAc 对LiMn2O4性能的影响,以期提高LiMn2O4的电化学性能。
1 实验
1.1 样品的制备及电池的组装
将醋酸钾(Aladdin 公司,99%)溶于无水乙醇(天津产,AR)中,配成浓度为0.01 mol/L 的溶液。按n(KAc)∶n(LiMn2O4)=0∶1、1∶1 000、3∶1 000、5∶1 000,将上述溶液加入LiMn2O4(湖南产,电池级)中,搅拌10 min,超声波振荡20 min,再在80℃下真空(真空度-0.08 MPa,下同)干燥2~3 h,冷却后取出,制得正极活性物质。
将粘接剂聚偏氟乙烯(PVDF,环宇公司提供,电池级)溶于N-甲基吡咯烷酮(NMP,环宇公司提供,电池级)中,配成浓度为10%的溶液,并与制得的正极活性物质、超导炭黑SP(上海产,电池级)按m(PVDF)∶m(活性物质)∶m(炭黑)=1∶8∶1的比例充分研磨,再加入适量NMP 调整黏度,然后涂覆在0.02 mm 厚的铝箔(天津产,电池级)上,在100℃下真空干燥10 h,冲成直径14 mm 的圆片,以10 MPa 的压力压制成形(约含3 mg 活性物质)。以金属锂片(洛阳产,99%)为负极,Celgard 2400 膜(美国产)为隔膜,1 mol/L LiPF6/EC +EMC+DMC(体积比1∶1∶1,北京产,99%)为电解液,在充满氩气的手套箱中组装CR2016 型扣式电池。
1.2 电化学性能测试
用CT-3008B 电池测试系统(深圳产)进行充放电和过充电测试。充放电测试的电压为3.0~4.3 V;过充电测试电流为1.0 C,在3.0~4.3V 循环6 次,然后在3.0~4.5 V 循环10 次,再调回3.0~4.3 V 循环5 次。
用CHI660C 电化学工作站(上海产)进行交流阻抗和循环伏安实验。交流阻抗测试的频率为0.1 MHz~10 mHz,交流幅值为5 mV;循环伏安测试以正极为研究电极,锂片为辅助电极和参比电极,电位为3.0~4.3 V,扫速为0.1 mV/s。
1.3 分析测试
在充满氩气的手套箱中拆解循环后的电池,取出极片,用碳酸二甲酯(DMC,Aladdin 公司,99%)冲洗掉极片表面残留的电解液,再在80℃下真空烘干。用D8Advance X 射线衍射仪(德国产)对极片进行物相分析,CuKα,管压40 kV、管流100 mA,扫描速度为4(°)/min;用JSM-6490LV 型扫描电子显微镜(日本)对极片进行能量色散谱(EDS)分析。
2 结果与讨论
2.1 KAc 对LiMn2O4电化学性能的影响
2.1.1 对倍率性能的影响
不同KAc 用量制备的电池以0.2 C、0.5 C、1.0 C、2.0 C和0.2 C 循环的放电比容量见图1。

图1 不同KAc 用量制备的电池以不同倍率循环的放电比容量Fig.1 Specific discharge capacity of cells prepared with different KAc dosages at different rates
从图1 可知,随着KAc 用量的增加,放电比容量均呈先增加、后减少的趋势。当n(KAc)∶n(LiMn2O4)=1 ∶1 000时,放电比容量最高,0.2 C 时达117.0 mAh/g;2.0 C 放电比容量比n(KAc)∶n(LiMn2O4)=0∶1时提高了6.7%;在2.0 C循环后恢复至0.2 C 循环,放电比容量可达最初0.2 C 放电比容量的98.3%。
2.1.2 对循环伏安和充放电过程的影响不同KAc 量制备的电池的循环伏安曲线见图2。
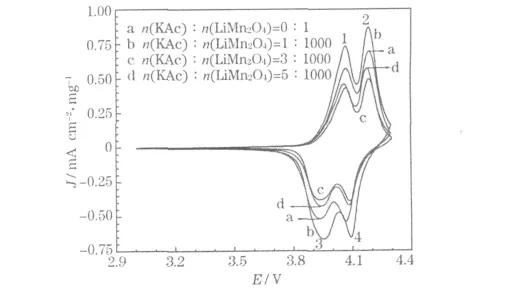
图2 不同KAc 用量制备的电池的循环伏安曲线Fig.2 CV curves of cells prepared with different KAc dosages
从图2 可知,在正、负向扫描时,都出现两个峰,分别对应于LiMn2O4的两个充放电过程[9]:

循环伏安曲线上,1、3 峰对应于反应(1)的正、逆向过程,2、4 峰对应于反应(2)的正、逆向过程。加入KAc 后,氧化峰电位有负移的趋势,还原峰电位有正移的趋势。

表1 循环伏安过程中各峰的电位和氧化还原峰电位差Table 1 Potential difference between anodic and cathodic peaks and potential of peaks in cyclic voltammetry process
从表1 可知,随着KAc 用量的增加,氧化还原峰电位差先减小、后增大,当n(KAc)∶n(LiMn2O4)=1∶1 000时,电位差最小。随着KAc 用量的增加,峰面积先增大、后减小,与放电比容量的变化情况一致。综上所述:n(KAc)∶n(LiMn2O4)=1∶1 000 时,电池的性能较好。
n(KAc)∶n(LiMn2O4)=0∶1、1∶1 000 时制备的电池的2.0 C 充放电曲线见图3。
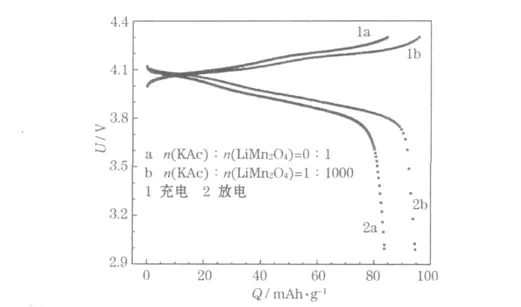
图3 n(KAc)∶n(LiMn2O4)=0∶1、1∶1 000 时制备的电池的2.0 C 充放电曲线Fig.3 2.0 C charge/discharge curves of cell prepared with n(KAc)∶n(LiMn2O4)=0∶1,1∶1 000
从图3 可知,当n(KAc)∶n(LiMn2O4)=1 ∶1 000 时,LiMn2O4的充电平台降低,特别是高电位处;放电平台升高,放电比容量增大。
2.1.3 对循环稳定性的影响
n(KAc)∶n(LiMn2O4)=0∶1、1∶1 000 时制备的电池以2.0 C 循环400 次,循环性能见图4。
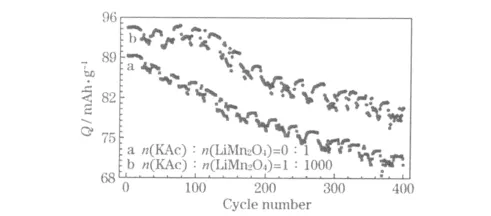
图4 n(KAc)∶n(LiMn2O4)=0∶1、1∶1 000 时制备的电池的2.0 C 循环性能Fig.4 2.0 C cycle performance of cells prepared with n(KAc)∶n(LiMn2O4)=0∶1,1∶1 000
从图4 可知,当n(KAc)∶n(LiMn2O4)=1∶1 000 时,放电比容量更高,第400 次循环的容量保持率为83.64%,说明添加KAc 提高了LiMn2O4的循环稳定性。微小的容量数据波动,是环境温度变化引起的。
HF 的存在会加剧锰的溶解,导致电池性能恶化[4],而KAc 在电解液中会发生式(3)所示的反应,吸收H+、降低电解液游离HF 的含量,提高LiMn2O4的循环稳定性。

n(KAc)∶n(LiMn2O4)=0∶1、1∶1 000 时制备的电池以2.0 C 循环400 次后,在零荷电态的状态下进行交流阻抗测试,所得EIS 见图5。

图5 n(KAc)∶n(LiMn2O4)=0∶1、1∶1 000 时制备的电池以2.0 C 循环400 次后零荷电态的EISFig.5 Electrochemical impedance spectroscopy(EIS)of cells prepared with n(KAc)∶n(LiMn2O4)=0∶1,1∶1 000 at state-of-charge of zero after cycled 400 times at 2.0 C
A.Blyr 等[10]研究发现,LiMn2O4材料颗粒表面形成了离子和电子导电性较低的钝化膜。A.D.Pasquier 等[11]的研究表明,LiMn2O4表面形成的钝化膜是含有Li 和Mn 的水溶性有机物。阻抗谱中,前端直线及之后的两个半圆分别对应于溶液阻抗(Rs)、电解液和材料之间的界面膜阻抗(RSEI)及电化学阻抗(Re),W1为扩散阻抗。采用Zview 软件,利用图6 所示的等效电路对阻抗进行拟合,得到的部分参数列于表2。

图6 电化学阻抗谱拟合用等效电路Fig.6 Equivalent circuit for EIS fitting
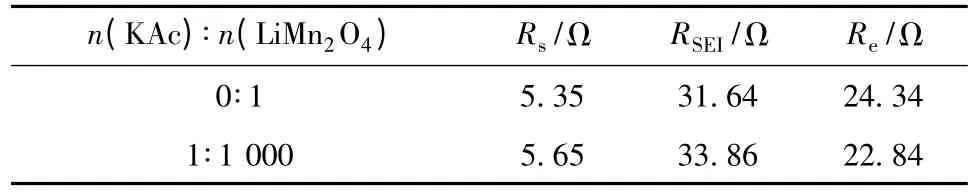
表2 Zview 软件拟合的参数Rs、RSEI和ReTable 2 Parameters Rs,RSEIand Refitted with software Zview
从表2 可知,添加KAc 后,RSEI增大,Re有所降低,说明KAc 参与了成膜过程,进而改变了电极的界面行为。
2.1.4 对过充电性能的影响
n(KAc)∶n(LiMn2O4)=0∶1、1∶1 000 时制备的电池的过充电性能见图7。

图7 n(KAc)∶n(LiMn2O4)=0∶1、1∶1 000 时制备的电池的1.0 C 过充电性能Fig.7 1.0 C overcharge performance of cells prepared with n(KAc)∶n(LiMn2O4)=0∶1,1∶1 000
从图7 可知,添加KAc 后,1.0 C 放电比容量较高,4.5 V过充时,放电比容量高4 mAh/g,当充电终止电压恢复至4.3 V时,放电比容量与过充电前相当,过充电未造成衰减;未添加KAc 的电池,比容量衰减为过充电前的95.38%,说明KAc抑制了过充电对电极的破坏。
2.2 KAc 对LiMn2O4晶型结构和表面元素的影响
n(KAc)∶n(LiMn2O4)=0∶1、1∶1 000 时制备的电池以2.0 C 循环400 次后,LiMn2O4电极的XRD 图见图8。
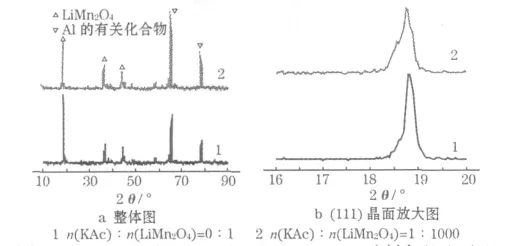
图8 n(KAc)∶n(LiMn2O4)=0∶1、1∶1 000 时制备的电池以2.0 C 循环400 次后LiMn2O4电极的XRD 图Fig.8 XRD pattern of LiMn2O4electrode when cells prepared with n(KAc)∶n(LiMn2O4)=0∶1,1∶1 000 cycled 400 times with 2.0 C
从图8 可知,添加KAc 后,没有新峰出现,LiMn2O4的特征峰变弱,位置有向低角度偏移的趋势,由布拉格方程[8]可知,晶面间距d 增大了,原因是K 已进入尖晶石LiMn2O4中Li 的位置,K+的半径(0.151 nm)大于Li+(0.078 nm)。
n(KAc)∶n(LiMn2O4)=1∶1 000 时制备的电池以2.0 C循环400 次后,LiMn2O4电极的EDS 图见图9。

图9 n(KAc)∶n(LiMn2O4)=0∶1、1∶1 000 时制备的电池以2.0 C 循环400 次后LiMn2O4电极的EDS 图Fig.9 Energy diffraction spectrum(EDS)of LiMn2O4electrode when cell prepared with n(KAc)∶n(LiMn2O4)=1 ∶1 000 cycled 400 times with 2.0 C
从图9 可知,极片表面除了C、O、Mn、F 及P 元素外,还发现了K 元素。由于极片测试前用DMC 进行了多次冲洗,说明K 元素以非KAc 的形式存在于材料表面,参与了正极表面膜的形成。
3 结论
随着KAc 添加量的增加,LiMn2O4各个倍率的放电比容量先增加后减少;当n(KAc)∶n(LiMn2O4)=1∶1 000 时,放电比容量最高,高倍率性能最佳,室温2.0 C 放电比容量提高了6.7%,抑制了过充电对电极性能的影响,2.0 C 循环400 次,容量保持率为83.64%高于未添加的78.85%。KAc主要通过CH3COO-对H+的吸收和K+参与正极表面膜形成并进入晶格的协同效应而起作用。
[1]WU Chuan(吴川),WU Feng(吴锋),CHEN Shi(陈实),et al.锂离子电池正极材料研究进展[J].Battery Bimonthly(电池),2001,31(1):36-38.
[2]Manev V G,Faulkner T,Barnette W,et al.High temperature performance of manganese spinel compound[A].The 9th International Meeting on Lithium batteries[C].Edinburgh:1998.307-309.
[3]ZHAO Zhen(赵震),MENG Qing-yi(孟庆义).锂离子电池电解液中杂质的影响及其脱出[J].Shandong Chemical Industry(山东化工),2003,32(3):41-43.
[4]CHEN Zhao-yong(陈召勇),LIU Xing-cai(刘兴采),GAO Lizhen(高利珍),et al.尖晶石LiMn2O4高温电化学容量衰减及改进[J].Chinese Journal of Inorganic Chemistry(无机化学学报),2001,17(3):325-330.
[5]ZHUANG Quan-chao(庄全超),WU Shan(武山),LIU Wen-yuan(刘文元).锂离子电池电解液杂质的影响及去除技术[J].Dianchi Gongye(电池工业),2006,11(1):48-52.
[6]村井祐之,长谷川正树,伊藤修二.非水电解液二次电池[P].日本:特开平6-176793,1994-06-24.
[7]LIU Yun-jian(刘云建),LI Xin-hai(李新海),GUO Hua-jun(郭华军),et al.添加剂对LiMn2O4锂离子电池性能的影响[J].Dianchi Gongye(电池工业),2010,15(4):197-201.
[8]LI Xing(李星),QU Mei-zhen(瞿美臻),YU Zuo-long(于作龙).锂离子电池负极材料Li4-xKxTi5O12结构和电化学性能[J].Chinese Journal of Inorganic Chemistry(无机化学学报),2010,26(2):233-239.
[9]HUANG Song-tao(黄松涛),KAN Su-rong(阚素荣),CHU Maoyou(储茂友),et al.锂改性尖晶石锰酸锂的循环伏安特性及其电化学性能研究[J].Chinese Journal of Rare Metals(稀有金属),2006,30(4):448-452.
[10]Blyr A,Sigala C,Amatucci G,et al.Self-discharge of LiMn2O4/C Li-ion cells in their discharged state[J].J Electrochem Soc,1998,145(1):194-209.
[11]Pasquier A D,Blyr A,Courjal P,et al.Mechanism for limited 55℃storage performance of Li1.05Mn1.95O4electrodes[J].J Electrochem Soc,1999,146(2):428-436.
