长枝木霉对南方根结线虫致死和寄生作用的显微观察及测定
2013-09-11张树武徐秉良薛应钰古丽君
张树武, 徐秉良, 薛应钰, 古丽君
(甘肃农业大学草业学院,草业生态系统教育部重点实验室,甘肃省草业工程实验室,中-美草地畜牧业可持续发展研究中心,兰州 730070)
根结线虫(Meloidogyne spp.)属于植物根系定居性的寄生线虫,是当前农作物的病原线虫之一。近年来,随着保护地蔬菜栽培的迅速发展,根结线虫对蔬菜的危害愈来愈严重,尤其是南方根结线虫[Meloidogyne incognita (Kofoid et White) ]由于其寄主范围广、致病性强、繁殖速度快和易传播扩散等特性,目前已成为世界各地蔬菜种植区最重要的病原物类群之一[1]。据联合国粮农组织(FAO)估计,美国每年因线虫危害造成的经济损失为4%,而且主要是南方根结线虫引起的病害,且在采用防治措施并取得良好防治效果的情况下,每年仍有500万美元的损失[2]。在我国由于温室连作现象甚为严重,致使许多老龄温室南方根结线虫病害的发生尤为严重,一般每年造成10%~15%的经济损失,严重者损失可达30%~40%,甚至绝产[3]。同时南方根结线虫的侵入可造成一定的伤口,有利于土壤中其他病原物的侵入,进而根结线虫与其他病原微生物联合侵染形成复合性病害,进一步加重了其危害程度,如加重了枯萎病、根腐病等土传性病害的发生[4]。
目前对南方根结线虫病害采取的防治措施仍以化学防治为主,种植抗病品种为辅,但大多数化学杀线剂由于毒性高、品种少、污染环境和使用过程中对人、畜不安全等缺陷已被禁用[5]。同时抗性品种的应用目前也受到了一定程度的限制,尤其是在一个地区连续种植单一抗病品种之后,品种的抗性会逐渐丧失[6]。因此,鉴于化学防治和种植抗病品种的局限性,以及无公害蔬菜生产的要求,对根结线虫的微生物防治是目前国内外线虫生物防治的重点和热点之一。
木霉(Trichoderma)是一类分布广泛的土壤习居菌[7]。据有关文献报道,木霉对一些土传病原菌具有很好的拮抗作用,如丝核菌属(Rhizoctonia)、腐霉属(Pythium)、小核菌属(Sclerotium)、镰刀菌属(Fusarium)等[8]。近年来,对哈茨木霉(Trichoderma harzianumRifai)和绿色木霉(T.viride Pers.exFr.)在植物病原菌的拮抗方面有较多的研究和报道,但有关长枝木霉(T.longibrachiatumRifai)的研究和报道较少,尤其是对南方根结线虫的致死和寄生作用目前还未见报道。因此,本试验通过长枝木霉分生孢子悬浮液对南方根结线虫2龄幼虫致死和寄生作用过程的显微观察,以及致死和寄生作用的测定及作用机理的初步研究,分析和讨论长枝木霉杀线虫作用的有效物质,以便为新型、高效的微生物型杀线剂的研制、开发和合理应用提供一定的理论基础。
1 材料与方法
1.1 试验材料
长枝木霉菌株由甘肃农业大学植物病理学实验室提供。2011年6月从甘肃省庆阳、榆中、武威等地蔬菜大棚的黄瓜病根和根际病土中分离得到。供试黄瓜品种为‘津研四号’,从甘肃省农科院种子有限责任公司购买。
1.2 试验方法
1.2.1 长枝木霉分生孢子悬浮液的制备
在PDA平板上培养6d的长枝木霉中加入1滴吐温-80(Tween-80)和5mL无菌水充分振荡使长枝木霉分生孢子脱落在无菌水中,即得到长枝木霉分生孢子悬浮液的原液,用血球计数板计数原液的浓度(1.5×107个/mL),同时依次稀释成1.5×106、7.5×105、3.0×105和1.5×105个/mL备用。
1.2.2 根结线虫的繁殖与接种
采用活体繁殖方法扩繁。将采集的病根(切碎)和根际病土按体积比1∶3的比例混合,然后将其与无病土按体积比1∶5均匀混合,在直径为10cm的塑料钵内装入500g混合土样,每钵种植2株黄瓜,共种植18盆用于扩繁。试验在温度为(25±0.5)℃,每天16h光照条件下的温室中进行。
1.2.3 南方根结线虫2龄幼虫的分离
从扩繁的黄瓜根部根结上挑取南方根结线虫的新鲜卵囊,并将经NaClO消毒后的卵囊放入垫有2层擦镜纸的线虫分离器中,在25℃下孵化13~20d,即得到大量的南方根结线虫2龄幼虫备用。
1.2.4 2龄幼虫的计数
采用计数皿计数[9]。在体视显微镜下计数每个小格子的2龄幼虫数量,然后乘以总格数,这样就可以得出每单位计数皿里2龄幼虫数量,然后通过加无菌水到量筒进行定位,即可计算出每毫升无菌水中2龄幼虫的数量,最终使其数量为100条/mL备用。
1.2.5 长枝木霉分生孢子悬浮液对南方根结线虫2龄幼虫致死和寄生作用过程的显微观察
在高温灭菌的6孔细胞培养板中加入新孵化的南方根结线虫2龄幼虫100条/孔,然后加入3mL浓度为1.5×107个/mL长枝木霉分生孢子悬浮液,以加入3mL无菌水作为对照,试验共设置1个处理和1个对照,并且每个处理和对照3个重复。试验在(25±0.5)℃下进行,并每隔2d在显微镜下观察处理中2龄幼虫被寄生和死亡的过程。
1.2.6 长枝木霉分生孢子悬浮液对南方根结线虫2龄幼虫致死和寄生作用的测定
在高温灭菌的6孔细胞培养板中加入新孵化的南方根结线虫2龄幼虫100条/孔,然后分别向各处理中加入不同浓度长枝木霉分生孢子悬浮液(1.5×105~1.5×107个/mL)各3mL,以加入3mL无菌水作为对照,试验共设置5个处理和1个对照,每个处理和对照重复3次,分别在(25±0.5)℃恒温培养箱中培养,并在24、48和72h记录死亡的线虫数,计算其死亡率、校正死亡率、致死中量、回归方程、相关系数(采用最小二乘法计算其致死中量)[10]。同时在6d后,每隔2d记录被寄生的线虫数量,并计算其寄生率。
1.2.7 线虫的死活鉴别
采用“体态法”和“NaOH”刺激法[9]。在体视显微镜下,观察经过不同浓度长枝木霉分生孢子悬浮液处理的2龄幼虫活动状态和体态。死亡的2龄幼虫虫体一般是僵直的,而存活的2龄幼虫虫体一般是弯曲的,且可以不断地移动。然后将虫体僵直的2龄幼虫再次分离后置于盛有2%盐水的培养皿中,在体视显微镜下用竹针轻轻拨动2龄幼虫,静止不动的即为死亡个体。
1.2.8 数据统计与分析
采用Excel 2003进行数据处理和表格绘制,并采用SPSS 16.0软件进行统计分析。
2 结果与分析
2.1 长枝木霉分生孢子悬浮液对南方根结线虫2龄幼虫致死和寄生作用过程的显微观察
试验结果表明,长枝木霉分生孢子悬浮液对南方根结线虫2龄幼虫具有较强的寄生和致死作用。镜检观察到,当将新孵化的2龄幼虫浸入长枝木霉分生孢子悬浮液时,初期2龄幼虫活动正常。2d后大部分2龄幼虫僵硬不动,只有少部分缓慢活动,并且有的出现波纹状扭曲,然后很快僵硬不动,呈麻痹状态。4d后镜检观察,处理的2龄幼虫基本僵硬不动,并且有些僵直不动的2龄幼虫可以观察到其口针(图1-a),而对照活动正常。6d后镜检观察,有的死亡虫体颜色发生变化且有少量的分生孢子吸附或寄生于其体壁上(图1-b)。8d后大量的分生孢子寄生并包围在虫体的周围(图1-c);10d后镜检观察,大量的分生孢子寄生于虫体上,并萌发出大量的菌丝穿透虫体体壁(图1-d和图1-e)。12d后死亡的虫体出现畸形,尤其是分生孢子寄生的部位出现明显的缢缩(图1-f);第14天镜检观察,有的虫体开始溶解,且虫体完全变形,模糊不清(图1-g),而对照组虫体颜色和形态依然保持完整,无任何杂菌寄生(图1-h)。

图1 南方根结线虫2龄幼虫被长枝木霉分生孢子悬浮液处理后的形态特征Fig.1 Morphological characteristics of the second stage juveniles of M.incognitainfected by the conidial suspension of T.longibrachiatum
2.2 长枝木霉分生孢子悬浮液对2龄幼虫的致死作用
不同浓度长枝木霉分生孢子悬浮液对2龄幼虫具有较强的致死作用与对照相比,并且随着长枝木霉分生孢子悬浮液浓度的增大而增大,随着处理时间的增加而增加。尤其是在72h时浓度为1.5×107个/mL的长枝木霉分生孢子悬浮液对2龄幼虫的死亡率和校正死亡率较高,分别为90.00%、88.81%,而对照死亡率仅为10.67%。同时由LC50值可知,24h时的LC50值大于48h,大于72h,即在72h时对2龄幼虫的致死作用最强,48h次之,24h最差(表1)。

表1 不同浓度长枝木霉分生孢子悬浮液对南方根结线虫2龄幼虫的致死作用1)Table 1 Effects of different concentrations of T.longibrachiatumon the activities of the second-stage juveniles of M.incognita
2.3 长枝木霉分生孢子悬浮液对南方根结线虫2龄幼虫的寄生作用
与对照相比,不同浓度长枝木霉分生孢子悬浮液对2龄幼虫的寄生率均存在显著的差异,并且其寄生率随着处理时间的延长而增大,随着处理浓度的增大而增大,同时在处理后第14天浓度为1.5×107个/mL的长枝木霉分生孢子悬浮液对2龄幼虫的寄生率高达87.33%,而对照始终没有任何杂菌寄生(表2)。
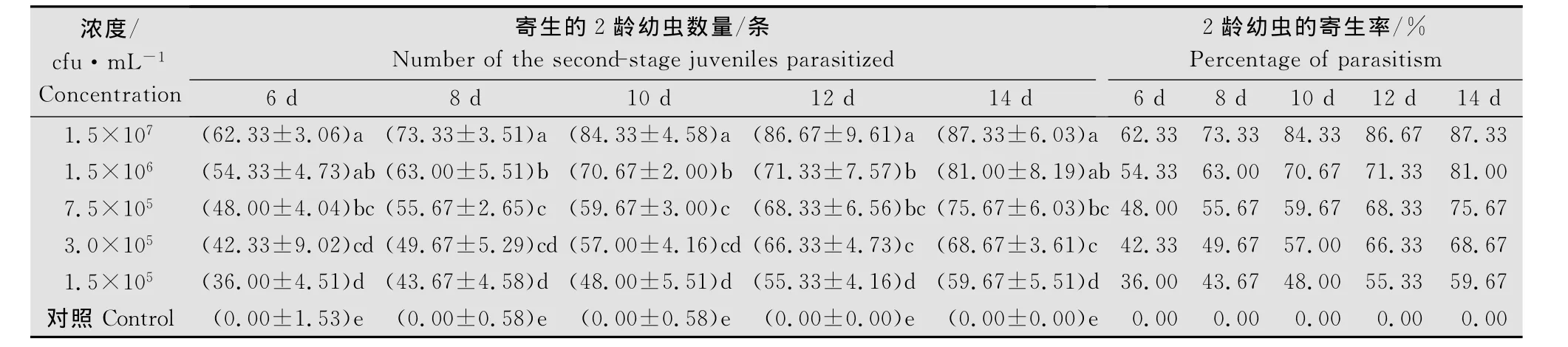
表2 不同浓度长枝木霉分生孢子悬浮液对南方根结线虫2龄幼虫的寄生作用1)Table 2 Effects of different concentrations of T.longibrachiatumon parasitism of the second-stage juveniles of M.incognita
2.4 长枝木霉分生孢子悬浮液对2龄幼虫的致死作用与2龄幼虫的恢复
结果表明,2龄幼虫在不同浓度长枝木霉分生孢子悬浮液中处理24和48h后基本麻痹,将其置于2%盐水中部分可以恢复活性,并且随着处理浓度越大和处理时间越长,恢复率越低。在不同浓度长枝木霉分生孢子悬浮液中处理72h后,基本上死亡,仅有个别的2龄幼虫恢复活动,进而证明不同浓度长枝木霉分生孢子悬浮液具有较强的杀线虫活性(表3)。

表3 不同浓度长枝木霉分生孢子悬浮液对2龄幼虫的致死作用与2龄幼虫的恢复Table 3 Effects of different concentrations of T.longibrachiatumon the activities and recovery rates of the second-stage juveniles
3 讨论
根结线虫是农作物的重要病原物之一,随着全球气候变暖和作物复种指数的不断提高,根结线虫对作物的危害愈来愈严重[11]。因此,根结线虫的生物防治受到了国内外的广泛重视,尤其利用自然界线虫的天敌微生物防治该病害已经成为当今线虫学界研究的新动向和新趋势[12]。
试验结果表明,长枝木霉分生孢子悬浮液可作为一种新型、高效的微生物型杀线剂,对防治根结线虫病害的发生具有广泛的应用潜力。不同浓度长枝木霉分生孢子悬浮液对南方根结线虫2龄幼虫的致死和寄生作用随着处理时间的增加而增加,随着处理浓度的增大而增大。通过不同浓度长枝木霉分生孢子悬浮液对南方根结线虫2龄幼虫致死和寄生作用效果的比较,尤其是浓度为1.5×107个/mL的长枝木霉分生孢子悬浮液表现出较强的致死和寄生作用,可作为最佳的使用浓度应用于生产实践中。目前,关于植物线虫病害的生物防治国内外已有一些相关的报道。国内外研究和应用最多的线虫生防菌主要有淡紫拟青霉 [Paecilomyces lilacinus(Thom)Samson]和厚垣轮枝孢菌(Verticillium chlamydosporiumGoddard),其对控制胞囊线虫和根结线虫等主要植物线虫起着十分重要的作用[13],但已有许多临床医学报告表明淡紫拟青霉是一种机会性真菌,在人畜免疫力下降或免疫缺失情况下,能侵染人体或动物皮肤和组织器官[14]。同时,淡紫拟青霉通常只寄生植物线虫的卵,侵染率与卵和真菌接触的时间长短有关[15]。厚垣轮枝孢一般侵染线虫的卵和雌虫,并且在不同植物根围的定殖能力差别较大[16]。这可能与生防菌的种类、生防菌的作用机制以及生防菌的寄主范围等有关[17-18]。国内刘霆等[19]报道的结果与本试验研究结果基本一致,绿色木霉发酵液原液处理后北方根结线虫2龄幼虫的校正死亡率为96.39%。付鹏等[20]报道生防菌剂GJ235倍、10倍稀释液对根结线虫2龄幼虫的活性具有强烈的抑制作用。同时本试验还发现,在较高浓度下线虫死亡率随作用时间的延长而增加较显著,而在较低浓度条件下,延长作用时间杀线作用增加不明显,可能是线虫对长枝木霉代谢物产生了一定的耐受力,同时也可能是高浓度的长枝木霉分生孢子悬浮液具有一定的后效作用[21]。
另外,本试验还首次对其作用机理进行了初步的研究,通过显微镜观察其侵染的过程表明:长枝木霉在2龄幼虫的诱导下,侵染初期分生孢子吸附或寄生于2龄幼虫的体表,分生孢子萌发产生大量的菌丝穿透虫体体壁,并且在虫体内繁殖菌体。侵染后期长枝木霉通过产生某种微生物酶(几丁质酶)或杀线活性的代谢产物使虫体溶解[22]。关于木霉对致病性真菌的生防机制已有大量的报道,包括拮抗、竞争、溶菌、寄生和诱导寄主产生系统性抗性等[23],但本试验也证实了其对致病性线虫也具有溶解和寄生作用。相似的报道也表明一些食线虫真菌和细菌体外可以产生具有杀线活性的代谢产物,如淡紫拟青霉发酵液中含有一定浓度的乙酸,能够在很大程度上抑制线虫卵和幼虫的生长发育[24]。而厚垣轮枝孢菌本身也可以产生毒素,当线虫卵与其接触时,便停止孵化和发育[25]。
因此,长枝木霉分生孢子悬浮液在防治植物线虫上具有广阔的应用前景,但目前对于长枝木霉的研究还只是处于初级阶段,还有很多问题诸如其对线虫的卵囊或胞囊、卵的寄生和致死作用及机理、对人畜及植物的安全性、持久性和针对性等有待进一步深入的研究。
[1] Yeates G W.Effect of plants on nematode community structure[J].Annual Review of Phytopathology,1999,37:127-149.
[2] De Goede R G M,Bongers T.Nematode community structure in relation to soil and vegetation characteristics[J].Applied Soil Ecology,1994(1):29-44.
[3] 杨宝君.15种根结线虫病害的病原鉴定[J].植物病理学报,1984,14(2):107-112.
[4] Kim J I,Choi D R.Influence of plant parasite nematode in occurrence of Phytophthorablight on hot pepper and sesame[J].Research Reports of the Rural Development Administration,1989,31(1):27-30.
[5] El-Alfy A T,Schlenk D.Effect of 17{beta}-estradiol and testosterone on the expression of flavin-containing monooxygenase and the toxicity of aldicarb to Japanese Medaka,Oryzias latipes[J].Toxicological Sciences,2002,68(2):381-388.
[6] 马爱瑛,张靠稳,马岩.根结线虫的生物防治[J].河北农业科学,2008,12(2):60-62.
[7] 徐同,钟静萍,李德葆.木霉对土传病原真菌的拮抗作用[J].植物病理学报,1993,23(1):63-67.
[8] 柳良好,徐同.哈茨木霉几丁质酶诱导及其对水稻纹枯病菌的拮抗作用[J].植物病理学报,2003,33(4):359-363.
[9] 方中达.植病研究方法[M].第3版.北京:中国农业出版社,1998:307-320.
[10]刘丹,吴淑贤,韩福生,等.白僵菌对沙棘木蠹蛾幼虫的致病力及其生物学特性研究[J].河北农业大学学报,2009,32(2):93-96.
[11]高学彪,邓穗儿,周慧娟,等.淡紫拟青霉MCWA18菌株对南方根结线虫的寄生和防治作用[J].中国生物防治,1998,14(4):163-166.
[12]刘维志.植物病原线虫学[M].北京:中国农业出版社,2000:281-293.
[13]Davide R G.Proceedings of the global status of and prospects for integrated pest management of root and tuber crops in the tropics[C].Nigeria,Ibadan,1990:156-163.
[14]Orth B,Frei R,ltin PH,et al.Outbreak of invasive mucoses caused by Paecilomyces lilacinus from a contaminated skin lotion [j].Annals of Internal Medicine,1996,125(10):799-806.
[15]田利,曹海威.一种新型生物防线虫剂——淡紫拟青霉[J].民营科技,2007(7):71.
[16]Bourne J M,Kerry B R,Leij de F A A M.The importance of the host plant on the interaction of root knot nematodes and the nematophous fungus,Verticillium chlamydosporiumGoddard[J].Biocontrol Science Biology,1996,6:539-548.
[17]Jeffries P,Gianinazzi S,Perotto S,et al.The contribution of arbuscular mycorrhizal fungi in sustainable maintenance of plant health and soil fertility[J].Biology and Fertility of Soils,2003,37(1):1-16.
[18]Tchabi A,Coyne D,Hountondji F,et al.Efficacy of indigenous arbuscular mycorrhizal fungi for promoting white yam(Dioscorea rotundata)growth in West Africa[J].Applied Soil Ecology,2010,45(2):92-100.
[19]刘霆,王莉,段玉玺,等.绿色木霉对北方根结线虫的作用[J].江西农业大学学报,2007,29(4):566-569.
[20]付鹏,李红梅,丁国春,等.GJ23生防菌剂防治南方根结线虫研究[J].江苏农业科学,2004(5):43-45.
[21]Meyer S L F,Huettel R N,Liu X Z,et al.Activity of fungal culture filtrates against soybean cyst nematode and root-knot nematode egg hatch and juvenile motility[J].Nematology,2004,6(1):23-32.
[22]孙漫红,刘杏忠,缪作清.大豆胞囊线虫病生物防治研究进展[J].中国生物防治,2000,16(3):136-141.
[23]Harman G E,Howell C R,Viterbo A,et al.Trichoderma spp.—opportunistic avirulent plant symbionts[J].Nature Microbiology Reviews,2004,2:43-56.
[24]Cayrol J C,Dijan C,Pijarowski L.Study of the nematophagous fungus Paecilomyces lilacinus [J].Revue de Nematologie,1989,12(4):331-336.
[25]Morgan J G,White J F,Rodriguez K R.Phytonematode pathology ultrastructural studies,parasitism of Meloidogyne arenaria eggs by Verticillium chlamydosporium[J].Nematropica,1983,13(2):245-260.
