马铃薯炭疽病菌的生物学特性及培养性状研究
2013-09-11杨成德陈秀蓉姜红霞蒲崇建张正伟
杨成德, 陈秀蓉*, 姜红霞, 薛 莉, 蒲崇建, 张正伟
(1.甘肃农业大学草业学院,草业生态系统教育部重点实验室,甘肃省草业工程实验室中-美草地畜牧业可持续发展研究中心,兰州 730070;2.甘肃省植保植检站,兰州 730020)
马铃薯(Solanum tuberosumLinn.)的种植几乎遍及全球,一方面解决了粮食短缺问题,另一方面也带来了巨大的经济效益。据联合国粮农组织(FAO)统计,马铃薯总产量在全世界所有粮食作物中位于第四,国内内蒙古、东北三省及甘肃等地区均有大面积种植。新鲜马铃薯中含有淀粉、蛋白质、脂肪和粗纤维,且含有禾谷类粮食所没有的胡萝卜素和抗坏血酸等,可作主食,也可作为蔬菜、酿造酒或作为饲料。甘肃省87个县(市、区)中有60个县种植马铃薯,甘肃定西有着“马铃薯之乡”之称,马铃薯是当地农民的主要经济来源,也是该地区发展经济的支柱产业之一。但是,近年来马铃薯在生产及储藏过程中炭疽病发生日趋严重,已成为甘肃省马铃薯生产及储藏中的主要病害之一,严重影响其储藏时间和品质[1]。马铃薯炭疽病的研究可以追溯到20世纪初,目前该病广泛分布于美国、日本和加拿大等50多个国家和地区[2]。该菌可以侵染马铃薯的各个生长部位[3],侵染根部引起根腐烂,侵染维管束造成萎蔫,严重时引起植株枯萎[1]。据Tsror等[4]报道,该病害可使产量减少22%~30%,且块茎品质也大受影响。据调查,马铃薯炭疽病在甘肃省武都、天祝和定西等地发生较重,杨成德等[1]对该病害的症状、病原及室内毒力测定结果进行了报道,但有关病原菌生物学特性及营养利用能力等方面的研究未见报道。因此,作者对该病原菌的生物学特性和营养利用(碳源、氮源)能力等进行了研究,以期为掌握该病害的发生规律和制定综合防治措施提供科学依据。
1 材料和方法
1.1 材料
供试菌种:甘肃农业大学病理实验室保存的马铃薯炭 疽 病 菌 [Colletotrichum coccodes (Wallr.)Hughes]。
培养基:选用马铃薯葡萄糖培养基(PDA培养基)、马铃薯蔗糖培养基(PSA培养基)、虎红琼脂培养基、燕麦片培养基、玉米粉培养基、査理固体培养基、查彼固体培养基、麦芽糖培养基、麦芽琼脂培养基和水琼脂培养基,参考文献[5]进行配制。
1.2 方法
1.2.1 生物学特性研究
1.2.1.1 温度对菌丝生长的影响
采用生长速率法。将病原菌接种于PDA平板中央,分别置于温度为5、10、15、20、25、30、35和40℃的培养箱中培养,3次重复,3d后每隔1d用十字交叉法测定菌落直径并描述菌落形态特征,直至生长最快温度下满皿。
1.2.1.2 温度、湿度和pH对分生孢子萌发的影响
具体方法参考文献[6]进行,即在干燥器内用硫酸法控制湿度,将孢子粉撒于载玻片上,设置相对湿度99%、95%、90%、85%和液态水5个处理,室温下培养24h后挑取各处理的孢子,无菌水制片,立即检查孢子萌发率,3次重复,镜检不少于10个视野,100个孢子,并计算孢子萌发率。
1.2.1.3 浸提液对孢子萌发的影响
配制各种浸提液(土壤浸提液,马铃薯幼苗期根、茎、叶浸提液,薯块浸提液,其中水∶浸提液=1∶10)悬滴法测定孢子萌发率,其他同1.2.1.2。
1.2.1.4 光照对孢子萌发的影响
用无菌水配制孢子悬浮液,悬滴法制片,置于全光照和全黑暗条件下处理,其他同1.2.1.2。
1.2.2 培养性状研究
1.2.2.1 碳源和氮源对菌丝生长的影响
采用生长速率法,即将PDA平板上活化后的病原菌用直径0.4cm的打孔器取菌饼,取1块置于加1.5%不同碳源或加0.25%不同氮源的马铃薯琼脂培养基中央,最适温度下培养,3d后每隔1d用十字交叉法测定菌落直径并描述菌落特征,直至生长最快碳源或氮源满皿。具体碳源和氮源种类分别见图7和图9,以不加任何碳源或氮源的培养基为对照,具体方法参考文献[7]进行。
1.2.2.2 培养基对菌丝生长的影响
采用生长速率法。将经PDA平板活化的病原菌用0.4cm直径的打孔器切取菌饼,取1块置于10种培养基(具体培养基种类见图9)中央,其他同1.2.2.1。
2 结果与分析
2.1 生物学特性研究
2.1.1 温度对菌丝生长的影响
马铃薯炭疽病菌在5~40℃范围内均可生长,小于15℃和高于35℃时菌丝生长缓慢,25~35℃为较适宜温度范围,其菌落直径显著高于其他生长温度(P<0.05),30℃为最适生长温度(图1),此时在PDA培养基上培养7d菌落直径为7.58cm,且有大量分生孢子盘形成,菌落质地均匀,表面有不明显轮纹,无色素产生,无特殊气味,菌落边缘整齐且着生絮状菌丝,偶有扇形突变。
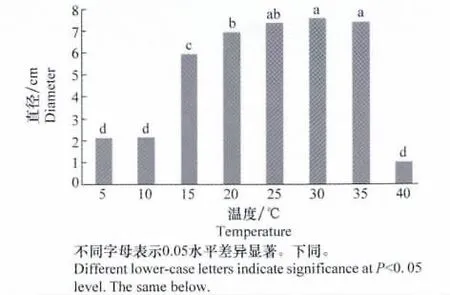
图1 温度对马铃薯炭疽病菌菌丝生长的影响Fig.1 Effects of temperature on colony growth of C.coccodes
2.1.2 温度对分生孢子萌发的影响
分生孢子在5~40℃内均可萌发,20~30℃萌发率较高,25℃为最适萌发温度,萌发率显著高于其他温度(P<0.05),在温度低于5℃和高于40℃时分生孢子不萌发,在5~25℃条件下,随温度升高,孢子萌发率随之增大,当温度高于25℃时,孢子萌发率随温度升高而呈现显著下降趋势(图2)。

图2 温度对马铃薯炭疽病菌孢子萌发的影响Fig.2 Effects of temperature on conidial germination of C.coccodes
2.1.3 湿度对分生孢子萌发的影响
分生孢子在液态水中萌发率最高,达93.33%,显著高于其他湿度条件(P<0.05),在相对湿度99%时萌发率为18.95%,相对湿度为85%时萌发率仅为8.00%,即随着相对湿度的下降孢子萌发率也显著下降,该结果说明高湿度是该分生孢子萌发的必要条件,且液态水为该分生孢子萌发的最适湿度条件(图3)。
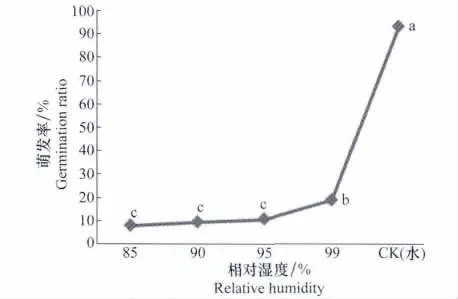
图3 湿度对马铃薯炭疽病菌孢子萌发的影响Fig.3 Effects of relative humidity on conidial germination of C.coccodes
2.1.4 pH对分生孢子萌发的影响
分生孢子在供试的pH范围内均可萌发,但在pH6.47~7.38范围内较高,且在pH6.7时其萌发率显著高于其他pH条件(P<0.05),说明pH对该分生孢子萌发影响明显,但中性较适合该孢子萌发(图4)。
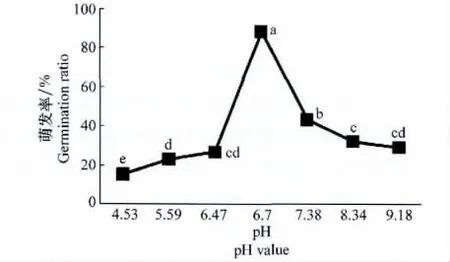
图4 pH对马铃薯炭疽病菌孢子萌发的影响Fig.4 Effects of pH value on conidial germination of C.coccodes
2.1.5 浸提液对分生孢子萌发的影响
分生孢子在薯块浸提液中萌发率显著高于叶、茎、根或土壤浸提液(P<0.05),根浸提液萌发率显著低于其他浸提液(P<0.05)(图5)。该结果说明薯块中的化学物质对孢子萌发有促进作用,分生孢子在薯块上容易萌发,而根较其他器官则不利于分生孢子的萌发。

图5 营养液对马铃薯炭疽病菌孢子萌发的影响Fig.5 Effects of the extracts on conidial germination of C.coccodes
2.1.6 光照对孢子萌发的影响
在全光照条件下分生孢子萌发率略高于全黑暗条件,但差异不显著(图6),表明该分生孢子萌发对光不敏感,在有无光照条件下均能萌发。

图6 光照对马铃薯炭疽病菌孢子萌发的影响Fig.6 Effects of light on conidial germination of C.coccodes
2.2 培养性状研究
2.2.1 碳源对菌丝生长的影响
马铃薯炭疽菌对各种碳源均有较好的利用能力,菌丝生长良好,除D-阿拉伯糖和氯醛糖外菌落直径均显著高于对照(P<0.05),对菌丝生长有明显促进作用,但以氯醛糖为碳源时菌落直径显著小于对照(P<0.05),对菌丝生长有抑制作用。该结果说明此菌对碳源要求不严格,能利用多种碳源,但利用能力有差异,利用能力高低依次为蔗糖>葡萄糖>甘露糖>D-木糖>麦芽糖>D-半乳糖>乳糖>D-果糖>可溶性淀粉>D-阿拉伯糖>氯醛糖。
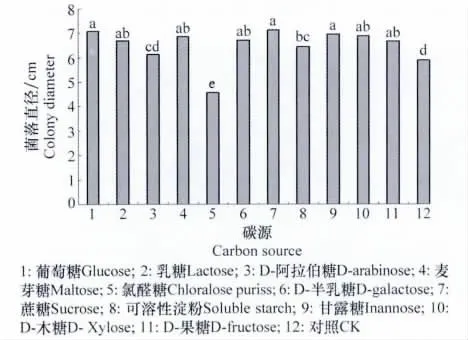
图7 碳源对马铃薯炭疽病菌菌丝生长的影响Fig.7 Effects of carbon sources on colony growth of C.coccodes
2.2.2 不同碳源培养基上菌落特征
马铃薯炭疽病菌在葡萄糖培养基上菌落黑褐色,轮纹明显,表面平铺,质密,边缘整齐,菌丝絮状,无特殊气味和色素产生(图8a);在D-阿拉伯糖和D-半乳糖培养基上菌丝茂密,产生淡褐色非水溶性色素,边缘不整齐,呈折扇状(图8b)。在乳糖培养基上菌体质密,菌丝发达,分生孢子盘及产孢量大,菌落表面光滑;在D-果糖培养基上菌落轮纹明显,颜色较深,分生孢子盘呈放射状排列,无色素,无特殊气味产生(图8c);在其余碳源培养基上菌落形态与葡萄糖培养基上基本相似。在对照培养基上分生孢子盘小且密生,菌落颜色浅,菌丝絮状发达,表面光滑。
2.2.3 氮源对菌丝生长的影响
硝酸铵对炭疽菌生长有显著促进作用(P<0.05),在以氯化铵为氮源的培养基上炭疽菌生长较对照快,但差异不显著(P>0.05),其他供试氮源均不利于该菌生长,且在碳酸铵、L-谷氨酸、尿素、大豆蛋白胨、L-组氨酸、L-精氨酸、亮氨酸、蛋白胨和甘氨酸为氮源的培养基上差异显著(P<0.05)(图9)。该结果说明马铃薯炭疽病菌可以利用多种氮源,但对不同氮源的利用能力有差异。
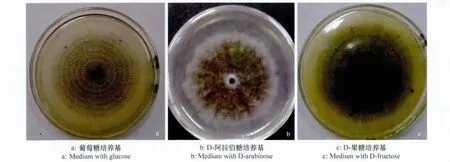
图8 碳源培养基上马铃薯炭疽病菌菌落特征Fig.8 The colony characteristics of C.coccodes on C-source media
2.2.4 氮源培养基上的菌落特征
在对照培养基上菌落轮纹明显,菌丝生长旺盛,菌落颜色深,表面光滑,边缘整齐,无色素产生,分生孢子盘小且密,产孢量大;在硝酸钠、L-组氨酸、L-精氨酸、亮氨酸和L-谷氨酸培养基上轮纹不明显,菌丝生长旺盛,菌落表面光滑,产孢量较大(图10a);在氯化铵、硝酸铵、碳酸铵和尿素培养基上菌丝发达呈絮状,分生孢子盘小而密,无色素产生,有特殊气味,分生孢子盘大,产孢量大,但在尿素培养基上菌落轮纹明显,而其他氮源培养基上轮纹不明显;在大豆蛋白胨培养基上菌落颜色深,菌丝发达呈絮状,分生孢子盘小而密,无色素产生,有特殊气味,产孢量大(图10b);在蛋白胨培养基上菌落轮纹明显呈深浅相间的同心圆,菌丝发达呈絮状,分生孢子盘小而密,无色素产生,有特殊气味,产孢量大;在甘氨酸培养基上菌落轮纹明显呈两个同心圆状,边缘菌丝颜色淡,中央颜色深,分生孢子盘小而密,无色素产生,有特殊气味,产孢量大(图10c)。

图9 氮源对马铃薯炭疽病菌菌丝生长的影响Fig.9 Effects of N-source on colony growth of C.coccodes
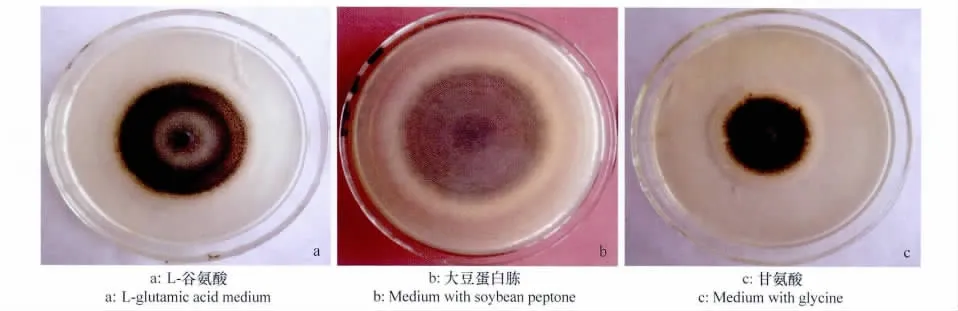
图10 氮源培养基上马铃薯炭疽病菌菌落特征Fig.10 The colony characteristics of C.coccodes on N-source media
2.2.5 不同培养基对菌丝生长的影响
马铃薯炭疽菌在PDA和麦芽汁培养基上菌落直径显著高于其他培养基(P<0.05),而在玉米粉及水琼脂上显著小于其他培养基(P<0.05)。该菌在马丁氏培养基上菌落边缘整齐,表面光滑,菌丝发达,菌落中央颜色略深,边缘较淡,分生孢子盘少;玉米粉培养基上菌落轮纹明显,表面粗糙,有淡褐色水溶性色素产生;麦芽糖和麦芽汁培养基上菌落轮纹明显,无特殊气味,有淡褐色水溶性色素产生,菌丝发达,有较多分生孢子盘形成(图12a);燕麦片和查彼培养基上菌落轮纹不明显,表面光滑,无色素产生,有无色气生菌丝产生,菌落近透明,有较多分生孢子盘形成(图12b);查理培养基上菌落轮纹不明显,表面粗糙,有橘红色非水溶性色素产生,无分生孢子盘产生(图12c);PDA和PSA培养基上菌丝颜色淡,无同心轮纹,无色素产生,有无色气生菌丝产生,菌落近透明,有较多分生孢子盘形成;水琼脂培养基上菌落轮纹不明显,表面光滑,边缘整齐,无色素产生,气生菌丝少,菌落近透明,分生孢子盘少。
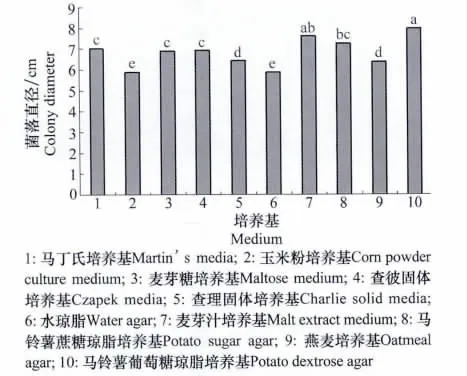
图11 培养基对马铃薯炭疽病菌菌丝生长的影响Fig.11 Effects of medium on colony growth of C.coccodes
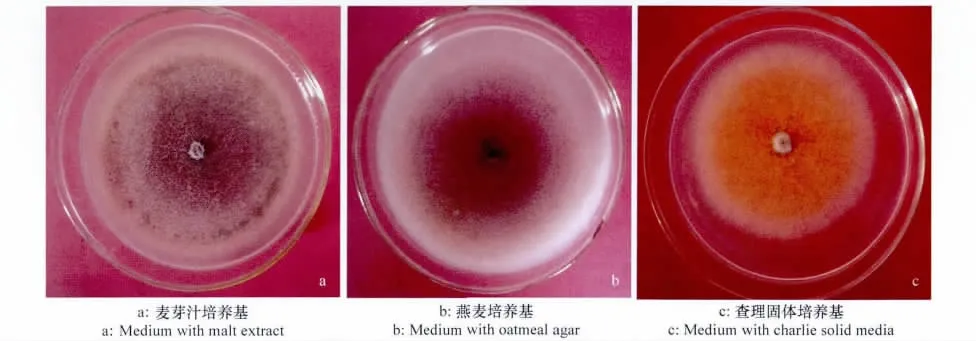
图12 不同培养基上的马铃薯炭疽病菌菌落特征Fig.12 The colony characteristics of C.coccodes on different media
3 讨论与结论
已研究报道的马铃薯病害有几十种[8],但报道较多的是马铃薯晚疫病、病毒病(PVX和PVY)、软腐病、环腐病和黑胫病等在生产中较常见的病害,对这些病害的病原学、发生规律及防治技术等均有较系统的 研 究[9-11]。 许 多 研 究 者[12-13]认 为,生 长 期 病原菌危害薯块,造成薯块带菌或潜伏侵染后,在贮藏期条件适宜时引起薯块腐烂,如马铃薯块茎干腐病、马铃薯晚疫病和马铃薯环腐病等薯块带菌均可引起贮藏期薯块腐烂。马铃薯炭疽病也为生长期和贮藏期均发生的重要病害之一,但国内文献较少。因此,本试验研究了该病原菌的生物学特性,结果表明,该病原菌菌丝在20~30℃生长较快,30℃为最适生长温度,与文献[14]报道一致;该菌分生孢子最适萌发温度为25℃,5℃时分生孢子不萌发,与文献报道[14]一致;分生孢子在液态水中萌发率最高,达93.33%,随着相对湿度下降萌发率也下降,说明高湿有利于分生孢子萌发;分生孢子在pH6.7时萌发率最高,与文献报道一致[14];分生孢子萌发对光不敏感,在有、无光照条件下都能萌发。在薯块浸提液中萌发率最高,而在根、茎、叶浸提液中萌发率很低,此可能由于本试验所选用的是马铃薯幼苗期根、茎和叶,是否幼苗期根、茎和叶比成熟期抗病还需进一步研究。该病原菌可以广泛利用碳、氮源,并且在不同培养基上菌落形态、产孢能力及生长速率不同,说明该菌对不同营养的利用能力有差异,这些差异能否用来对该菌进行分类或在病害综合防治中应用还须进一步研究。本试验较详细地报道了马铃薯炭疽病菌的生物学特性及对不同碳、氮源的利用能力等,可为了解该病害的发生规律及制定综合控制措施提供依据。
[1] 杨成德,姜红霞,陈秀蓉,等.甘肃省马铃薯炭疽病的鉴定及室内药剂筛选[J].植物保护,2012,38(6):127-133.
[2] Johnson D A,Miliczky E R.Distribution and development of blackdot,Verticilliumwilt,and powdery scab on Russet Burbank potatoes in Washington State[J].Plant Disease,1993,77:74-79.
[3] Pavlista A,Kerr E D.Black dot of potato caused by Colletotrichum coccodesin Nebraska[J].Plant Disease,1992,76:1077.
[4] Leah Tsror(Lahkim),Orly Erlich,Marina Hazanovsky.Effect of Colletotrichum coccodes on potato yield tuber quality,and stem colonization during spring and autumn[J].Plant Disease,1999,83:561-565.
[5] 方中达.植病研究方法[M].第3版.北京:中国农业出版社,1998:122-154.
[6] 杨成德,陈秀蓉,薛莉,等.牧草根际狗牙根平脐蠕孢菌的研究[J].草业学报,2008,17(3):86-92.
[7] 陈秀蓉,南志标,杨成德,等.牧草根际3种平脐蠕孢菌培养性状及对营养的利用能力[J].草业学报,2005,14(5):99-104.
[8] 王桂霞.马铃薯病毒病的防治[J].现代农业科技,2008(6):25-30.
[9] 王合松,王培红.马铃薯主要病害的发生与防治对策[J].农资科技,2004(1):40-46.
[10]马宏.我国马铃薯软腐病防治的研究进展[J].生物技术通报,2007(1):76-80.
[11]魏周全,宗世忠,张廷义.定西市马铃薯病害调查[J].中国马铃薯,2005,19(2):124-126.
[12]Henson J M,French R C.The polymerase chain reaction and plant disease diagnosis[J].Annual Review Phytopathology,1993,31:81-109.
[13]刘会梅,王向军,封立平.马铃薯炭疽病研究进展[J].植物检疫,2007,21(1):38-41.
[14]Dillard H R.Influence of temperature,pH,osmotic potential,and fungicide sensitivity on germination of conidia and growth form sclerotia of Colletotrichum coccodes in vitro[J].Phytopathology,1988,78:1357-1361.
