利用慢性肾脏病流行病学合作研究公式(CKD-EPI)对住院心力衰竭合并肾功能不全患者的应用分析*
2013-09-11沈洁张琪孔祥萦张海锋周艳丽樊宽鲁梅宏斌徐东杰周芳李新立
沈洁,张琪,孔祥萦,张海锋,周艳丽,樊宽鲁,梅宏斌,徐东杰,周芳,李新立
利用慢性肾脏病流行病学合作研究公式(CKD-EPI)对住院心力衰竭合并肾功能不全患者的应用分析*
沈洁,张琪,孔祥萦,张海锋,周艳丽,樊宽鲁,梅宏斌,徐东杰,周芳,李新立
目的:利用2009年新发布的慢性肾脏病流行病学合作研究公式(chronic kidney disease epidemiology collaboration,CKD-EPI)对住院心力衰竭(心衰)合并肾功能不全患者进行分析。
方法:收集2008-01至2011-12在我院心内科住院左心室射血分数≤45%的心衰患者共395例,根据CKD-EPI公式计算肾小球滤过率(GFR),按照肾脏病预后质量指南对慢性肾脏病的分期标准,将患者共分为四组:A组:GFR≥90 ml/(min·1.73 m2),101 例,B 组:GFR 60~89 ml/(min·1.73 m2),177 例,C 组:GFR 30~59 ml/( min·1.73 m2),95 例,D 组:GFR<30ml/(min·1.73 m2),22例。记录患者的基本临床特征、血生化及超声心动图参数。
结果:①29.6%的住院心衰患者合并有肾功能不全。年龄、收缩压、血肌酐、胱抑素、尿素氮、尿酸随着肾功能的减退逐渐增高,合并冠心病、高血压史比例随着肾功能的减退亦逐渐增高,差异均有统计学意义(P均<0.05);而血钠、甘油三酯随着肾功能的减退逐渐降低,差异均有统计学意义(P均<0.05);NYHA分级在四组患者中差异有统计学意义(P<0.001);②多因素logistic回归显示:年龄(+10岁)、收缩压(10 mmHg ,1 mmHg=0.133 kPa)、胱抑素(+0.1 mg/L)、尿素氮(1 mmol/L)等为心衰合并肾功能不全的危险因素。
结论:在心衰住院患者当中,高龄、收缩压升高、高胱抑素及高尿素氮是发生肾功能不全的生物标志物。
CKD-EPI方程;心力衰竭;肾功能不全;危险因素
心力衰竭(心衰)为多种心脏病的终末阶段,发病率及死亡率高,而肾功能不全是心衰患者中最常见的合并症之一,导致其预后不佳。欧洲心脏病协会统计在欧洲51个国家9亿多人口中,至少有1 500万心衰患者[1]。在基础诊断为心衰患者中,91.1%合并有肾功能异常[肾小球滤过率(GFR<90ml/min],而33.3%有中重度的肾功能不全(GFR < 60 ml/min)[2]。研究发现肾功能不全是患者心血管事件发生率、死亡率及因心衰而住院率升高的独立危险因素[3,4]。因此,对于心衰患者评价其肾功能并早期发现预示肾损害的指标,有重要的临床意义。
根据全国肾脏基金会医疗准则,GFR是评价肾功能的最佳指标[5]。以往大量研究常使用肾脏病膳食改良方程(MDRD方程)来计算GFR,此研究方程最主要的局限性在于不够精确且人为的低估了GFR在高水平的测量值[6]。2009年新发布的慢性肾脏病流行病学合作研究公式(CKD-EPI)比MDRD方程更加精确,尤其在高水平GFR时只有很小的偏移[6]。目前,较少研究利用这一公式评价肾功能,因此,本研究欲使用CKD-EPI公式对心衰合并肾功能不全患者进行分析,找出其危险因素,指导临床治疗。
1 对象与方法
对象:选取2008-01至2011-12在我院心内科出院诊断为心衰且纽约心脏协会(NYHA)II~IV心功能分级住院患者485例(左心室射血分数≤45%)。心衰诊断参照修订的Framingham标准[7],重复入院的患者均采用第一次入院的资料。排除标准:年龄<18岁(2例)、急性心肌梗死(4例)、严重的心脏瓣膜病(23例)、由于明显的肝脏原发疾病及恶性肿瘤所致的心力衰竭(11例)、资料不全者(50例),共有395例患者纳入本研究,其中男性289例,女性106例。
方法:使用CKD-EPI公式计算395例患者的GFR,根据肾脏病预后质量指南对慢性肾脏病的分期标准[5],将患者共分为四组。A组:GFR≥90 ml/(min·1.73 m2), 101 例,正常肾功能;B 组:GFR 60~89 ml/( min·1.73 m2), 177例,轻度肾功能异常;C组:GFR 30~59 ml/( min·1.73 m2), 95例,中度肾功能异常;D 组:GFR<30 ml/( min·1.73 m2), 22例,重度肾功能异常及肾衰竭,由于GFR<15 ml/( min·1.73 m2)的患者较少,因此合并至D组。对比四组患者之间的临床特征、超声心动图及血生化指标(均为入院后第一次检查结果),生化指标采晨时空腹8小时以上肘静脉血,采用全自动生化分析仪(AU2700)完成检查,将GFR<60 ml/( min·1.73 m2)定义为肾功能不全。
(Chinese Circulation Journal, 2013,28:293.)
CKD-EPI公式[6]:计算公式:(1)女性:①血肌酐≤0.7 mg/dl, GFR=144×(血肌酐(mg/dl)/0.7)-0.329×(0.993)年龄; ② 血 肌 酐 >0.7 mg/dl,GFR=144×(血 肌 酐 (mg/dl)/0.7)-1.209×(0.993)年龄。(2)男性:①血肌酐≤0.9 mg/dl, GFR=141×(血肌酐 (mg/dl)/0.9)-0.411×(0.993)年龄;②血肌酐 >0.9mg/dl,GFR=141×(血肌酐 (mg/dl)/0.9)-1.209×(0.993)年龄。血肌酐单位换算:1 mg/dl=88.4μmol/L
统计学方法:应用 SPSS16.0统计学软件。计量资料正态分布以±s表示,多组间比较采用单因素方差分析;计数资料用百分率表示,采用χ2检验;使用多因素Logistic回归(逐步法,入选P值为0.05,剔除P值标准为0.1)分析肾功能不全的危险因素。以P<0.05为差异有统计学意义。
2 结果
395例心衰患者,平均年龄(59.8±14.8)岁。29.6%的住院心衰患者合并有肾功能不全。四组之间各项比较见表1,年龄、收缩压、血肌酐、胱抑素、尿素氮、尿酸随着肾功能的减退逐渐增高,合并冠心病史、高血压史比例随着肾功能的减退亦逐渐增高,差异均有统计学意义(P均<0.05);而血钠、甘油三酯随着肾功能的减退逐渐降低,差异均有统计学意义(P均<0.05);心功能分级NYHA II、III级患者比例随着肾功能的减退而逐渐减少,随肾功能的减退NYHA IV级患者比例增加;差异均有统计学意义(P均<0.001)。另外,左心室舒张末内径、低密度脂蛋白胆固醇、总胆固醇、血钾在四组之间差异也有统计学意义(P<0.05)。
心衰合并肾功能不全的危险因素:以存在肾功能不全为因变量(无=0,有=1),年龄、收缩压、NYHA分级、冠心病、高血压、糖尿病、左心室舒张末内径、高密度脂蛋白胆固醇、总胆固醇、甘油三酯、白蛋白、血钾、血钠、胱抑素、尿素氮、尿酸、血糖、吸烟为协变量进行多因素logistic逐步回归分析,其中协变量的选择参照以往文献显示为心衰合并肾功能不全的危险因素及本研究中单因素分析中有统计学意义的指标,因GFR计算公式由肌酐参与,不纳入方程,而年龄对其公式所得结果影响不大,可作为协变量。结果显示:年龄(+10岁)、收缩压(+10 mmHg,1 mmHg=0.133 kPa)、胱抑素(+0.1 mg/L)、尿素氮(+1 mmol/L)为住院心衰患者合并肾功能不全的危险因素。表2
表1 四组之间临床特征及实验室指标比较(±s)
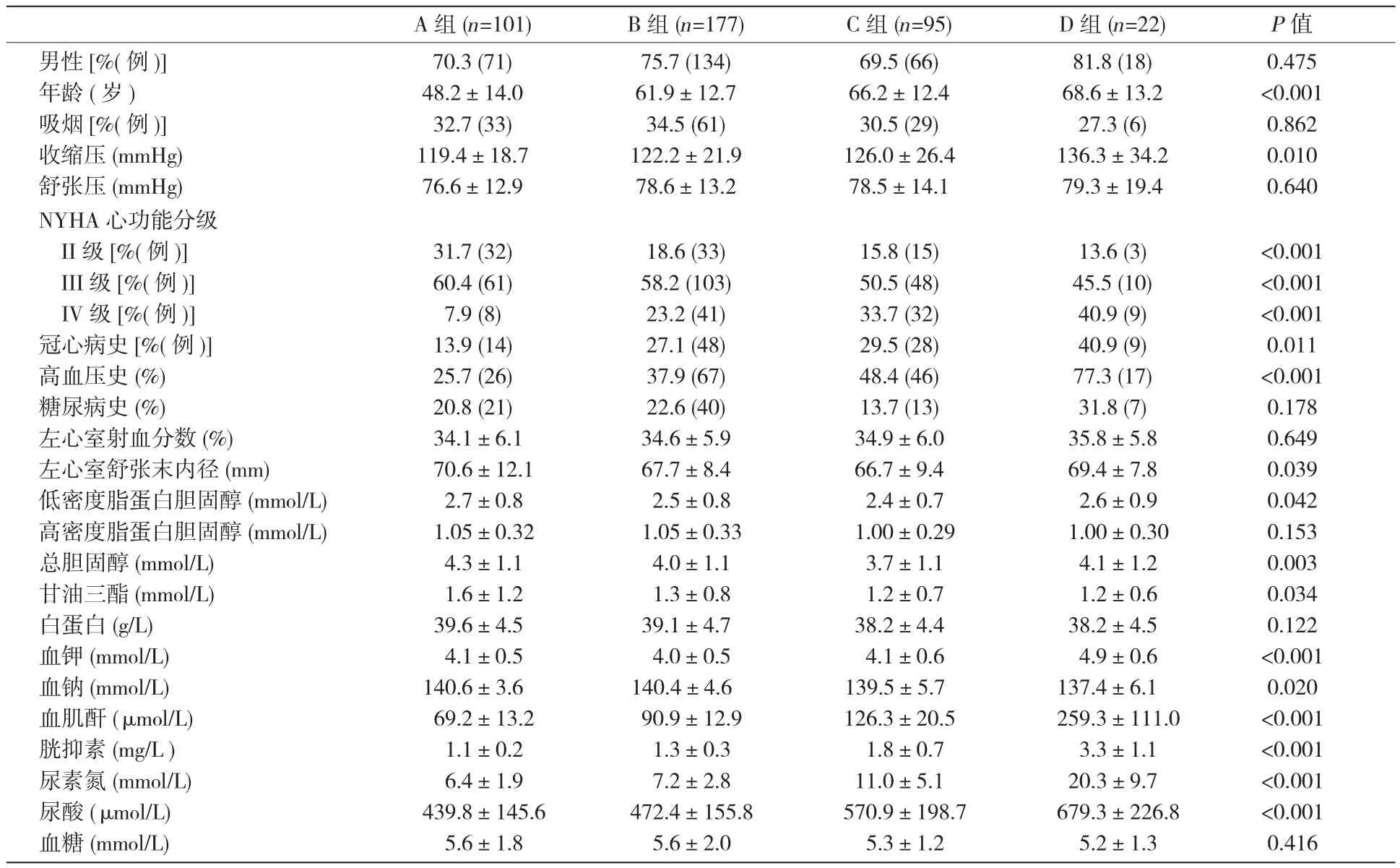
表1 四组之间临床特征及实验室指标比较(±s)
注:1 mmHg=0.133 kPa 。A 组: GFR ≥ 90 ml/( min·1.73 m2) ,正常肾功能 B 组: GFR 60~89 ml/( min·1.73 m2), 轻度肾功能异常 C 组:GFR 30~59 ml/( min·1.73 m2) ,中度肾功能异常 D组: GFR<30 ml/( min·1.73 m2) , 重度肾功能异常及肾衰竭
A组(n=101) B组(n=177) C组(n=95) D组(n=22) P值男性[%(例)]70.3 (71) 75.7 (134) 69.5 (66) 81.8 (18) 0.475年龄 (岁 ) 48.2±14.0 61.9±12.7 66.2±12.4 68.6±13.2 <0.001吸烟[%(例)]32.7 (33) 34.5 (61) 30.5 (29) 27.3 (6) 0.862收缩压(mmHg) 119.4±18.7 122.2±21.9 126.0±26.4 136.3±34.2 0.010舒张压(mmHg) 76.6±12.9 78.6±13.2 78.5±14.1 79.3±19.4 0.640 NYHA心功能分级II级 [%(例 )]31.7 (32) 18.6 (33) 15.8 (15) 13.6 (3) <0.001 III级 [%(例 )]60.4 (61) 58.2 (103) 50.5 (48) 45.5 (10) <0.001 IV级[%(例)]7.9 (8) 23.2 (41) 33.7 (32) 40.9 (9) <0.001冠心病史[%(例)]13.9 (14) 27.1 (48) 29.5 (28) 40.9 (9) 0.011高血压史(%) 25.7 (26) 37.9 (67) 48.4 (46) 77.3 (17) <0.001糖尿病史(%) 20.8 (21) 22.6 (40) 13.7 (13) 31.8 (7) 0.178左心室射血分数(%) 34.1±6.1 34.6±5.9 34.9±6.0 35.8±5.8 0.649左心室舒张末内径(mm) 70.6±12.1 67.7±8.4 66.7±9.4 69.4±7.8 0.039低密度脂蛋白胆固醇(mmol/L) 2.7±0.8 2.5±0.8 2.4±0.7 2.6±0.9 0.042高密度脂蛋白胆固醇(mmol/L) 1.05±0.32 1.05±0.33 1.00±0.29 1.00±0.30 0.153总胆固醇(mmol/L) 4.3±1.1 4.0±1.1 3.7±1.1 4.1±1.2 0.003甘油三酯(mmol/L) 1.6±1.2 1.3±0.8 1.2±0.7 1.2±0.6 0.034白蛋白(g/L) 39.6±4.5 39.1±4.7 38.2±4.4 38.2±4.5 0.122血钾 (mmol/L) 4.1±0.5 4.0±0.5 4.1±0.6 4.9±0.6 <0.001血钠 (mmol/L) 140.6±3.6 140.4±4.6 139.5±5.7 137.4±6.1 0.020血肌酐 (μ mol/L) 69.2±13.2 90.9±12.9 126.3±20.5 259.3±111.0 <0.001胱抑素 (mg/L ) 1.1±0.2 1.3±0.3 1.8±0.7 3.3±1.1 <0.001尿素氮 (mmol/L) 6.4±1.9 7.2±2.8 11.0±5.1 20.3±9.7 <0.001尿酸 (μ mol/L) 439.8±145.6 472.4±155.8 570.9±198.7 679.3±226.8 <0.001血糖 (mmol/L) 5.6±1.8 5.6±2.0 5.3±1.2 5.2±1.3 0.416
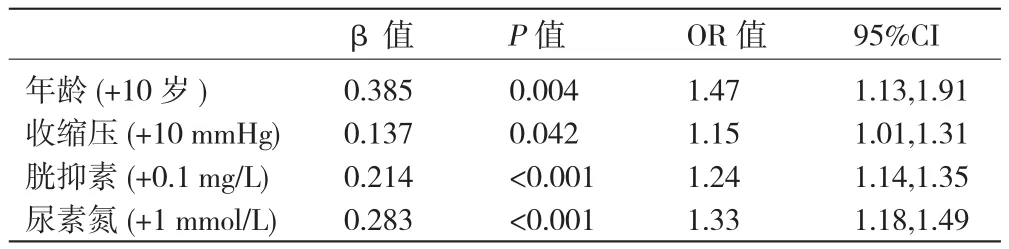
表2 心力衰竭合并肾功能不全的logistic回归分析
3 讨论
心肾之间通过多种机制彼此影响,包括血流动力学异常(容量负荷、静脉压增高及低血压)、神经激素及炎性活动的激活、氧化应激、贫血、肾交感神经活性及电解质、维生素D代谢活动等。目前临床上常用“心肾综合征”来描述这一复杂的疾病,是指心脏或肾脏任一种器官的急慢性的损害及功能不全可牵涉至另一器官[8]。Ronco等[9]将心肾综合征分为5个亚型:l型:急性心功能不全导致的急肾损伤;2型:慢性心衰导致的慢性肾脏病进行性恶化;3型:是由急性肾功能减退致急性心脏事件;4型:慢性肾功能不全导致心脏疾病;5型:系统疾病导致心肾功能同时减退。本研究人群应属于2型,在心衰患者中伴随着长期的低心排血量、低氧血症,引起交感神经及肾素—血管紧张素—醛固酮系统激活,肾脏氧化应激增加及血管内皮一氧化氮活性损伤等引起血管收缩、水钠潴留、肾脏纤维化及炎症反应;此外,心衰患者常伴有贫血,导致心脏扩大、左心室容量减低,使得左心室射血分数下降而肺毛细血管压增高,进一步导致心排血量降低,继而导致肾脏慢性缺氧,肾间质纤维化;另外,一些炎症因子如肿瘤坏死因子-α、白细胞介素-1和白细胞介素-6释放,导致肾脏细胞慢性损伤及凋亡,最终引起肾功能受损[9]。对于心衰合并肾功能不全的预后,Heywood等[10]研究发现心衰合并肾功能异常,患者死亡率随着基础肾功能的严重程度逐渐升高,且住院时间也随之延长。
本研究发现肾功能不全占住院心衰患者的29.6%,与以往研究结果相似[2,11]。年龄、收缩压、血肌酐、胱抑素、尿素氮、尿酸及合并冠心病、高血压史比例随着肾功能恶化程度的加重逐渐升高,而血钠、甘油三酯逐渐降低,在以往研究中已有所阐述[10,12]。Muntner等[13]研究发现,高密度脂蛋白胆固醇降低和高甘油三酯是肾功能不全的危险因素,与本研究结果不符,可能由于本研究中,肾功能重度异常者多合并有中重度的心功能不全,患者身体消耗大,营养不良,血脂代谢异常。从表1中可以看出,NYHA分级在不同肾功能分级患者中有明显的差异,尤其是在各肾功能不全分组中,NYHA IV级患者比例随着肾功能减退程度逐渐增高,说明心衰程度越重,合并严重肾损伤的可能性越大,可能由于随着心功能的减退,心排血量逐渐减低,引起肾前性肾功能不全。
本研究最主要的发现:年龄、收缩压、胱抑素及尿素氮为住院心衰患者合并肾功能不全的独立危险因素。随着年龄的增长肾单位数目逐渐减少,继而影响肾功能。Fehrman-Ekholm等[14]研究指出,在老年人中(年龄70~110岁),GFR每年下降约1.05 ml/min。有研究发现,收缩压与尿素氮、血肌酐呈显著的正相关,即使血压在正常高值时[120 mmHg≤收缩压< 140和(或)80 mmHg≤舒张压< 90 mmHg],患者血肌酐较正常血压组仍有明显的升高(P<0.01)[15]。而高血压对肾脏的损害主要有以下机制,长期持续高血压使肾小球内囊压升高,肾小球纤维化、萎缩及肾动脉硬化进一步导致肾实质缺血和肾单位不断减少;另外,合并高血压时,一些细胞因子及自身免疫机制也参与肾脏损害[16]。本研究中高血压占心衰病因中比例较高,尤其在D组患者中占77.3%。临床上尿素氮与血肌酐一样常用来评估肾功能,但有一定的局限性,在应用此指标时应当考虑患者的膳食蛋白摄入量、代谢及肾小管重吸收作用。而其与心衰患者的预后有密切的相关性,较GFR预测患者住院死亡率的作用更强[10,17]。胱抑素评价肾功能的作用已有大量研究,本研究发现胱抑素每增加0.1 mg/L,心衰患者合并肾功能不全的危险性增加23.9%。胱抑素是一种有核细胞产生的蛋白酶抑制剂,可自由的由肾小球滤过并通过其分解代谢的部位—管状上皮细胞所重吸收而并非由肾小管分泌,其血液浓度的值较血肌酐等指标更能早期发现肾损害[18]。另外,胱抑素能简单准确反应心衰患者的肾功能情况,对于肾功能的评估及心衰患者的预后有重要的价值[12,19]。
本研究为回顾性研究,且样本量不多,许多评价肾功能的指标尚未在临床开展,因此评价肾功能的数据并不能适用于所有的患者,需要大规模的前瞻性临床试验加以证实。
[1]Dickstein K, Cohen-Solal A, Filippatos G, et al. ESC guidelines for the diagnosis and treatment of acute and chronic heart failure 2008:the Task Force for the diagnosis and treatment of acute and chronic heart failure 2008 of the European Society of Cardiology. Developed in collaboration with the Heart Failure Association of the ESC (HFA) and endorsed by the European Society of Intensive Care Medicine (ESICM).Eur J Heart Fail,2008,10:933-989.
[2]Stanojevic D, Apostolovic S, Jankovic-Tomasevic R, et al. Prevalence of renal dysfunction and its influence on functional capacity in elderly patients with stable chronic heart failure.Vojnosanit Pregl,2012,69:840-845.
[3]Hillege HL, Nitsch D, Pfeffer MA, et al. Renal function as a predictor of outcome in a broad spectrum of patients with heart failure.Circulation,2006,113:671-678.
[4]赵振燕. 慢性肾功能不全与心血管疾病关系研究. 中国循环杂志,2009,24:477-479.
[5]K/DOQI clinical practice guidelines for chronic kidney disease:evaluation, classification, and stratification.Am J Kidney Dis,2002,39:S1-S266.
[6]Levey AS, Stevens LA, Schmid CH, et al. A new equation to estimate glomerular filtration rate. Ann Intern Med, 2009, 150:604-612.
[7]任永强,冯薇,刘丽,等. 左室射血分数正常的心力衰竭患者的临床特点及左室收缩功能. 中华心血管病杂志,2009,37:809-812.
[8]Ronco C, Mccullough PA, Anker SD, et al. Cardiorenal syndromes: an executive summary from the consensus conference of the Acute Dialysis Quality Initiative (ADQI).Contrib Nephrol,2010,165:54-67.
[9]Ronco C, House AA, Haapio M. Cardiorenal syndrome: refining the definition of a complex symbiosis gone wrong.Intensive Care Med,2008,34:957-962.
[10]Heywood JT, Fonarow GC, Costanzo MR, et al. High prevalence of renal dysfunction and its impact on outcome in 118,465 patients hospitalized with acute decompensated heart failure: a report from the ADHERE database.J Card Fail,2007,13:422-430.
[11]Smith GL, Lichtman JH, Bracken MB, et al. Renal impairment and outcomes in heart failure: systematic review and meta-analysis. J Am Coll Cardiol,2006,47:1987-1996.
[12]Damman K, van der Harst P, Smilde TD, et al. Use of cystatin C levels in estimating renal function and prognosis in patients with chronic systolic heart failure.Heart,2012,98:319-324.
[13]Muntner P, Coresh J, Smith JC, et al. Plasma lipids and risk of developing renal dysfunction: the atherosclerosis risk in communities study.Kidney Int,2000,58:293-301.
[14]Fehrman-Ekholm I, Skeppholm L. Renal function in the elderly(>70 years old) measured by means of iohexol clearance, serum creatinine, serum urea and estimated clearance.Scand J Urol Nephrol,2004,38:73-77.
[15]孟秋云,张福业,孙红,等. 正常血压高值与肾功能的相关性研究.临床心血管病杂志,2009,25:730-733.
[16]尤丹瑜,万建新,吴可贵. 高血压肾损害. 中华高血压杂志,2007,15:275-277.
[17]Fonarow GC, Adams KJ, Abraham WT, et al. Risk stratification for inhospital mortality in acutely decompensated heart failure: classification and regression tree analysis.JAMA,2005,293:572-580.
[18]Dharnidharka VR, Kwon C, Stevens G. Serum cystatin C is superior to serum creatinine as a marker of kidney function: a meta-analysis.Am J Kidney Dis,2002,40:221-226.
[19]王超权,徐耕,程刚. 血清胱抑素C水平对缺血性心力衰竭患者近期预后的影响. 中国循环杂志,2009,24:28-31.
Application of CKD-EPI Equation for Estimating the In-Hospital Patients of Chronic Heart Failure With Concomitant Renal Insufficiency
SHEN Jie, ZHANG Qi, KONG Xiang-ying, ZHANG Hai-feng, ZHOU Yan-li,
FAN Kuan-lu, MEI Hong-bin, XU Dong-jie, ZHOU Fang, LI Xin-li.Department of Cardiology, First Affiliated Hospital of Nanjing Medical University, Nanjing (210029), Jiangsu, China
LI Xin-li, Email: xinli3267@yeah.net
Objective: To estimate the in-hospital patients of chronic heart failure with concomitant renal insufficiency by 2009 newly issued chronic kidney disease epidemiology collaboration equation (CKD-EPI) .
Methods: Our study enrolled 395 eligible patients who suffered from chronic heart failure with left ventricular ejection fraction≤ 45% and treated in our hospital from 2008 to 2011. According to CKD-EPI equation calculated glomerular filtration rate (GFR), the patients were divided into 4 groups. Group A, GFR ≥90ml/(min·1.73m2), n=101, Group B, GFR 60~89ml/(min·1.73m2), n=177, Group C, GFR 30~59 ml/(min·1.73m2), n=95 and Group D, GFR<30 ml/(min·1.73m2), n=22. The basic clinical condition, blood biochemical features and echocardiographic indexes were examined in all patients.
Results: ①There were 29.6% in-hospital patients had concomitant renal insufficiency. As renal function decreasing, the age, systolic blood pressure, serum creatinine, cystatin, urea nitrogen and uric acid increased accordingly; at the same time, the ratios for the patients combining with coronary heart disease and hypertension were also increased, P<0.05 respectiveey. While the levels of blood sodium and triglyceride were decreased accordingly with the decreased renal function, P<0.05 respectively. NYHA classification was different among 4 groups, P<0.001. ② Multivariate regression logistic analysis indicated that age, systolic blood pressure, cystatin and creatinine were the risk factors for heart failure patients combining with renal insufficiency.
Conclusion: For in-hospital patients of chronic heart failure, the elder age, higher systolic blood pressure with increased cystatin and urea nitrogen were more risky for combining renal insufficiency.
book=294,ebook=200
CKD-EPI equation; Heart failure; Renal insufficiency; Risk factors
1.江苏省亚健康高危人群综合干预示范研究,江苏省科技支撑计划(社会发展)( 项目号:BE2009613);2.青蓝工程
210029 江苏省南京市,南京医科大学第一附属医院 心内科
沈洁 硕士研究生 主要从事心内科方面学习研究 Email:njshen_jie@126.com 通讯作者:李新立 Email:xinli3267@yeah.net
R54
A
1000-3614(2013)04-0293-04
10.3969/j.issn.1000-3614.2013.04.016
2013-02-20)
(编辑:常文静)
