蝉花菌株的筛选及菌丝体成分分析
2013-09-07刘素纯黄晓晗
文 欣 刘素纯 黄晓晗
(1.湖南农业大学食品科学技术学院,湖南 长沙 410128;2.食品科学与生物技术湖南省重点实验室,湖南 长沙 410128;3.湖南省发酵食品工程技术研究中心,湖南 长沙 410128)
蝉花(cordyceps sobolifera)亦称蝉蛹草,是蝉花真菌寄生于蝉类若虫而形成的结合体,因其需要特定的环境和宿主,故资源稀少。主要分布于中国浙江、江苏、四川等多省份,在世界各地也有所分布[1]。其入药形态为寄生于蝉蛹形成的结合体,无毒,性寒,味甘,能散风热、解痉,主治儿童惊风夜啼、咳嗽、咬牙、咽喉痈肿等病症[2]。在《证类本草》中记载蝉花主要用于“小儿惊痫瘈疭、夜啼、心悸”;《本草纲目》中记载其药效“功同蝉蜕,又止疟疾”。
蝉花中含有真菌多糖、虫草酸、虫草素及麦角甾醇等多种活性物质[3],活性物质的多少与寄生类型关系较大。杨介钻等[4]、金丽琴等[5]证明蝉花及其菌丝体具有较好的镇痛、镇静及解热等功效,同时蝉花对机体的毒性甚微,其主要化学成分与冬虫夏草(cordyceps sinensis)相似。由于近年来蝉花生存环境遭到破坏,再之过度采挖,蝉花已经成为一种珍贵的药材,故利用人工培养蝉花具有广阔的前景。葛飞等[6]对天然蝉花中的粗成分进行了分析,其中粗蛋白含量为19.65%、粗脂肪含量为8.41%、粗纤维含量为3.12%、灰分为7.84%、水分含量为9.81%,虫草酸含量为53.6mg/g,真菌多糖含量为33.2mg/g。
本试验对蝉花中的真菌进行分离,通过液态培养获得该菌种的菌丝体,并对蝉花菌丝体中的化学成分以及活性物质进行测定分析,为将来用蝉花真菌菌丝体替代天然蝉花作为保健品和药品原料等提供理论依据。
1 材料与方法
1.1 材料
1.1.1 试验原料
蝉花:采自九江市庐山区莲花镇莲花林场。
1.1.2 培养基
分离培养基:孟加拉红培养基;
菌种保存培养基:PDA斜面培养基;
固态种子培养基:麸皮培养基。将麸皮和水以1∶1(m∶m)的比例混合,然后装入500mL的三角瓶内,厚度大约0.5cm,在121℃条件下灭菌30min,备用;
液态发酵培养基:PDA液态培养基;
改良PDA液态培养基:200g新鲜马铃薯、10g干蝉蜕放入沸水中煮20min,用纱布过滤去残渣,加入20g葡萄糖,补水到1 000mL;
Richard培养基:KH2PO45g,MgSO4·7H2O 2.5g,KNO310g,蔗糖50g,FeCl30.02g,H2O 1 000mL;
蛋白胨-葡萄糖-酵母膏培养基:葡萄糖10g,酵母膏10g,蛋白胨5g,水1 000mL;
麸皮-玉米:取麸皮10g,玉米粒10g,置于沸水中煮20min,用纱布过滤去掉固形物,再加入10g蔗糖,补水至1 000mL。
1.2 方法
1.2.1 蝉花真菌的分离培养 称取10g天然蝉花样品加入到90mL无菌生理盐水中,振荡30min。将其稀释成10-3,10-4,10-5稀释液,从各稀释液中吸取0.1mL到孟加拉红平板并涂布,置于28℃恒温培养箱中培养3~5d。挑选单个典型的菌落,接种到PDA斜面培养基中,保存备用。
1.2.2 蝉花真菌鉴定 用点接法将蝉花真菌接种到PDA平板上进行菌落形态观察;用插片法对蝉花真菌进行培养,通过显微镜作个体形态观察。
1.2.3 液态培养生物量的获得
(1)孢子悬液的制备:在无菌条件下挑取斜面蝉花真菌,接种到麸皮培养基中,于28℃恒温培养箱中培养72h。取5g培养好的麸皮菌种加入到45mL无菌水中,震荡30min,即为孢子悬液。用血球计数板测量菌悬液中孢子的数量,加入无菌生理盐水将孢子的浓度调到106个/mL。
(2)蝉花真菌液态发酵培养基的选择:取5mL孢子悬液,分别加入到100mL的蛋白胨-葡萄糖-酵母膏培养基、PDA液态培养基、改良PDA液态培养基、Richard培养基、玉米-麸皮培养基中,置于温度为28℃的摇床中以150r/min的速率进行培养,培养时间为7d。从第3天开始,每隔24h对发酵液中的生物量进行测定,从而选择最优培养基。
(3)蝉花真菌液态发酵的最佳温度的选择:用无菌移液管取孢子悬液5mL,加入到装有100mL改良PDA液态培养基的三角瓶中。将恒温摇床的温度分别设置为22,24,26,28,30℃,摇床速率为150r/min,培养5d。测定其生物量。
(4)蝉花真菌液态发酵的最佳接种量的选择:以接种量为1%,2%,3%,4%,5%分别将孢子悬液接种到改良PDA培养基中,于28℃的恒温摇床中以150r/min的速率培养5d。测定其生物量。
(5)蝉花真菌液态发酵过程中摇床转速的选择:从孢子悬液中吸取5mL菌液,加入到装有100mL的改良PDA培养基的三角瓶中,将其放置在转速为110,130,150,170,190r/min的恒温摇床上,在28℃条件下恒温培养5d。测定其生物量。
(6)正交法确定蝉花真菌最优培养条件:选择温度、接种量和摇床转速为试验因素,设计L9(33)正交试验以获得最佳发酵条件。
1.2.4 测定方法
(1)生物量的测定方法:发酵液培养完成后进行冷冻离心,离心温度为10℃、速率为4 000r/min、时间为15min。弃掉上清液,将菌丝体收集于玻璃纸上放在60℃烘箱中干燥,再进行称量,此重量即为发酵液中的生物量。
(2)菌丝体粗成分的分析:水分含量的测定采用直接干燥法[7];总氮含量的测定采用凯氏定氮法[8];粗脂肪含量的测定采用索氏提取法[9];粗纤维含量的测定采用酸碱消煮法[10];灰分含量的测定法采用灼烧法[11]。
(3)虫草酸的测定:根据文献[12]所述方法,用微波提取法进行提取菌丝体中的虫草酸。虫草酸测定方法采用高碘酸钠比色法[13]。将测量获得的OD值代入回归方程中,然后通过式(1)计算菌丝体中虫草酸的含量。

式中:
R——菌丝体中虫草酸含量,mg/g;
C—— 提取液中虫草酸含量,μg/g;
10—— 试样浸提后定容体积,mL;
V——提取液体积,mL;
m——试样的准确重量,g。
(4)真菌多糖含量的测定:将干燥后的菌丝体进行前处理,包括:提取、醇沉、脱色、去蛋白、干燥[14]。真菌多糖的测定采用硫酸-苯酚法[15]。将测量获得的OD值通过回归曲线进行计算,然后代入式(2)计算出多糖含量。

式中:
R——菌丝体中真菌多糖含量,mg/g;
C—— 提取液中真菌多糖含量,μg/mL;
V——定容后体积,mL;
w——干菌丝体质量,g。
2 结果与分析
2.1 菌种的筛选
观察孟加拉红平板,发现一真菌在数量上占有优势。经分离纯化后,点接在PDA平板中观察该菌落形态。如图1,刚开始菌落圆形呈白色,菌丝平伏、毡状,与培养基结合紧密,不易挑取,质地致密,菌落呈放射状沟纹,椭圆形;形成孢子后,菌落呈灰绿色。在显微镜下观察该菌个体形态(图2),发现菌丝有隔,基部无足细胞,分生孢子以簇生形式分布于营养菌丝或孢子梗上,圆形或近似球形,其分生孢子梗经过多次分枝,产生对生的瓶状小梗,呈扫帚状;可初步判定其为蝉拟青霉,命名为V17。
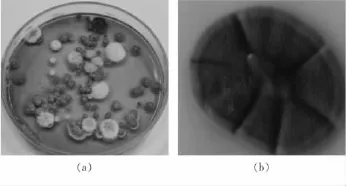
图1 蝉花真菌的菌落形态观察Figure 1 Fungal colony form of Cordyceps cicadae

图2 蝉花真菌的个体形态观察Figure 2 Individual form of Cordyceps cicadae
2.2 发酵液中生物量的获得
2.2.1 蝉花真菌液态发酵培养基的选择 在液态摇床培养2d时,改良PDA培养基中最先形成菌丝体,个体较小,而其他培养基在第3天开始才有较小的菌丝体形成(图3);随着发酵时间的增加,发酵液中的菌丝体中逐渐长至黄豆般大小,发酵液的颜色也从暗黄色慢慢转变到黑灰色。
从第3天开始,每隔24h对发酵液中菌丝体的生物量进行测定,结果见图3。在液态培养过程中,随着时间的变化,改良PDA和PDA在第5天前发酵液中的生物量逐步增加,而其他3种培养基是在第6天前生物量逐步增加。其中,在改良PDA中进行发酵的菌丝体在各个时间段的生物量均高于其他的培养基,在5d达到最大值,为5.26g/L。蝉花真菌本来是寄生于蝉蛹上生长而得,在培养基中加入的蝉蜕熬液为该微生物的生长提供了一些无机盐或生长因子,使得它的生长速率得到提高。在5d之后,随着发酵液中营养物质的减少、细胞的活性降低,同时次级代谢产物的生成使得菌丝自溶,从而导致了发酵液中生物量的减少。
2.2.2 蝉花真菌液态发酵的最佳温度 在不同温度下对蝉花真菌进行液态培养,结果见图4。该菌株在改良PDA液态培养基24~32℃的条件下均能生长,而在28℃时获得的生物量最大,为5.26g/L。
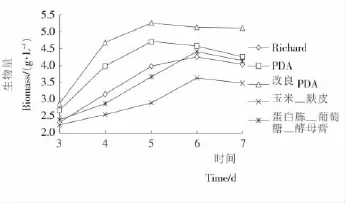
图3 蝉花真菌在不同培养基上发酵的生物量变化Figure 3 The biomass changed in five kinds of medium on liquid fermentation of Cordyceps cicadae
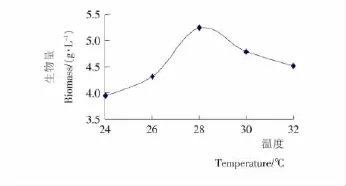
图4 发酵温度对蝉花液态发酵的影响Figure 4 Effects of culture temperature on liquid fermentation of Cordyceps cicadae
2.2.3 蝉花真菌液态发酵的最优接种量 以不同的接种量进行接种,在改良PDA液态培养基28℃恒温摇床上培养5d,获得的生物量见图5。接种量的多少与发酵液中的生物量有着较密切的关系,随着接种量的增加,发酵液中的生物量也增加,直到4%时获得最大值,为4.91g/L;而当增加到5%的时候,发酵液中的生物量有所减少。较少的接种量会使得发酵液中的菌浓度较少,使得生长迟滞期较长,不利于发酵;而过高的接种量会使得发酵液中菌过多而营养物质不足,因而获得的菌丝体较少。

图5 接种量对蝉花液态发酵的影响Figure 5 Effects of inoculum size on liquid fermentation of Cordyceps cicadae
2.2.4 蝉花真菌液态发酵过程中的最佳摇床速率 将蝉花真菌以4%的接种量接种,置于不同转速的恒温摇床上进行培养,获得生物量见图6。由图6可知:蝉花真菌在150r/min的转速下培养获得的生物量最大,低于或高于该转速时生物量较少。蝉花真菌是好氧微生物,较高摇床速率使得通气量增加,对它的生长有促进作用;但当摇床的转速过快,菌丝体的数量变少,这可能是培养过程中菌丝体碰撞过多而导致菌丝体难以成型。
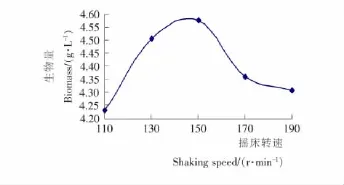
图6 摇床转速对蝉花液态发酵的影响Figure 6 Effects of shaking speed on liquid fermentation of Cordyceps cicadae
2.2.5 蝉花真菌液态培养最佳条件 选择温度、接种量和摇床转速为试验因素,因素水平表见表1。

表1 正交试验因子水平表L9(33)Table 1 The table of factor and level in L9(33)orthogonal experiment
正交试验优化结果见表2。由表2可知,影响蝉花真菌液态发酵生物量的各因素主次为C>B>A,即摇床速率对蝉花真菌液态发酵过程中生物量的影响最大,温度次之,接种量的大小影响最小。最佳的发酵条件为A2B2C3,发酵液中的生物量为5.94g/L。
试验结果方差分析见表3。由表3可知,温度和摇床速率对蝉花真菌液态发酵培养过程中的生物量影响较大,在a=0.05水平下显著,说明它们对蝉花真菌的生物量影响较大;而接种量在a=0.05水平下不显著,说明接种量对蝉花真菌液态发酵的生物量影响不大。
2.3 蝉花菌丝体粗成分分析
对干燥的蝉花菌丝体中的粗成分进行测定(粗蛋白含量、粗脂肪含量、粗纤维含量、水分含量和灰分含量)进行测定,结果见表4。菌丝体中,粗蛋白含量较高,为27.19%;粗脂肪、粗纤维的含量分别为7.79%,6.20%;而灰分含量较低。因蝉花液态发酵是纯种培养,培养基中的N源和C源较为丰富,故菌丝体中粗蛋白的含量较高;而发酵液中无机元素不如蝉若虫的含量丰富,故灰分含量较低。
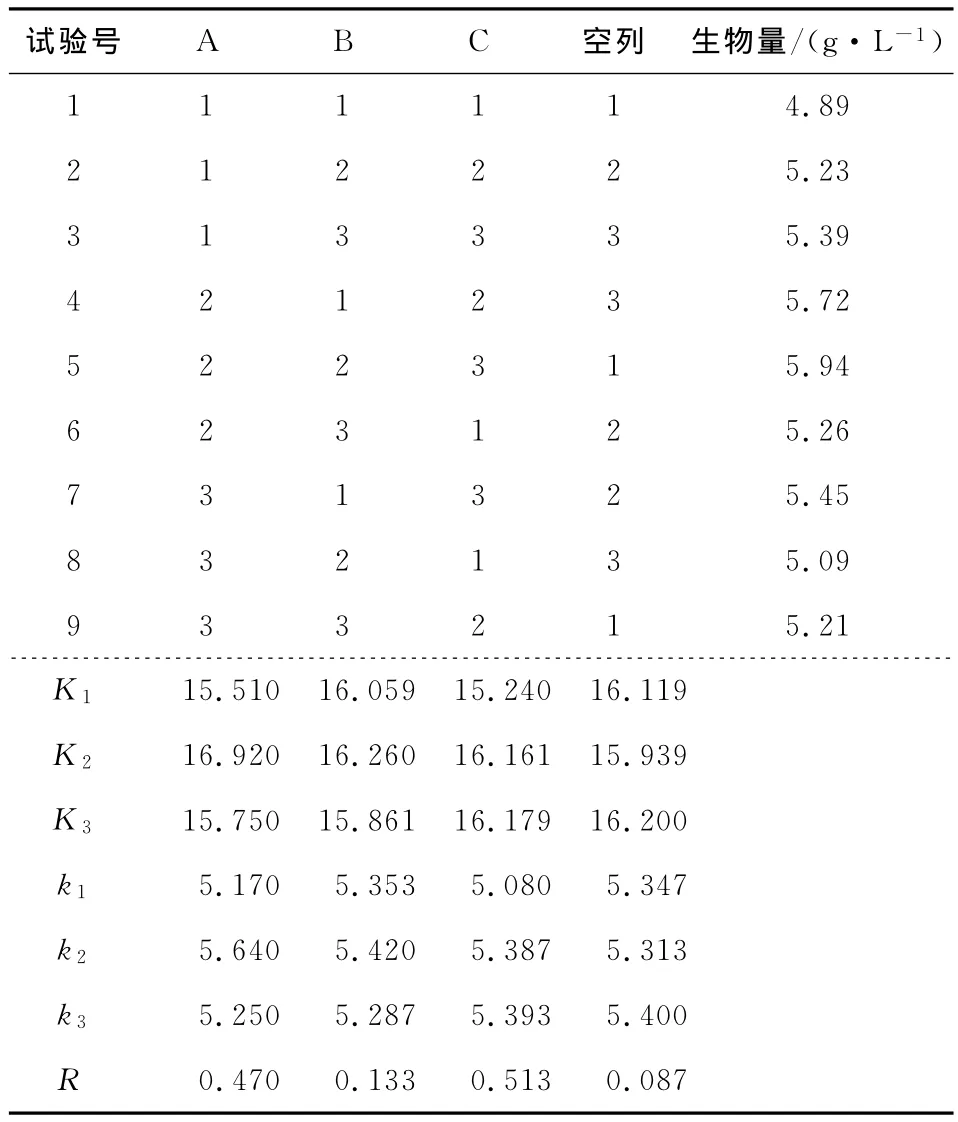
表2 正交试验结果的极差分析Table 2 Extreme value analysis of orthogonal experiment

表3 正交试验结果方差分析Table 3 The variance analysis of orthogonal test
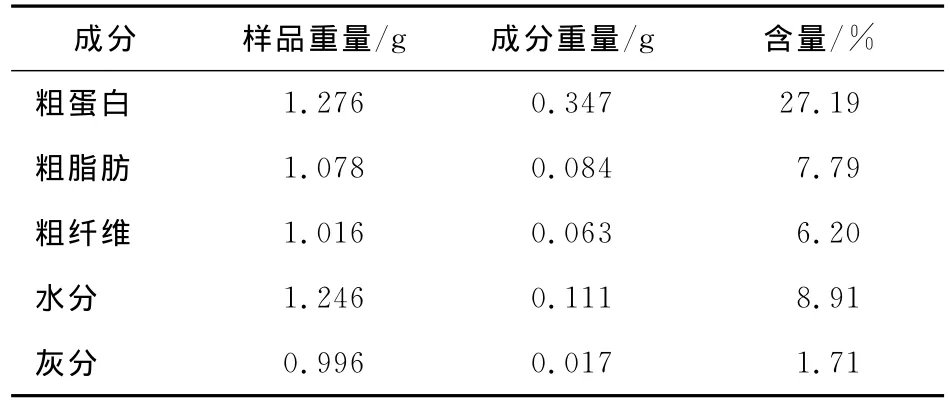
表4 蝉花菌丝体粗成分分析Table 4 Proximate compositions of fermented fermented mycelia of Cordyceps cicadae
2.4 蝉花菌丝体中的活性成分分析
2.4.1 虫草酸含量标准曲线与蝉花真菌含量标准曲线 根据高碘酸钠比色法,作虫草酸(D-甘露醇)含量的标准曲线(图7),虫草酸含量的回归方程:y =0.010 0x+0.019 4,R2=0.999 3。根据硫酸-苯酚法,作真菌多糖标准曲线(图8),真菌多糖含量的回归方程:y =0.006 1x-0.032 3,R2=0.997 1。

图7 虫草酸(D-甘露醇)含量标准曲线Figure 7 Standard curve of D-mannitol
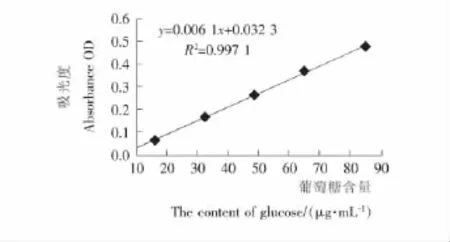
图8 葡萄糖含量标准曲线Figure 8 Standard curve of glucose
2.4.2 蝉花菌丝体中虫草酸(D-甘露醇)和真菌多糖含量的测定 取0.050g干燥菌丝体加入10mL水进行微波处理,处理完后经8 000r/min离心后取上清液加入到50mL容量瓶中进行定容。测量样液的OD值以进行虫草酸的测定。
称取0.050g干燥菌丝体进行前处理,处理完后装入50mL容量瓶中用去离子水定容。测定样液中的OD值,通过公式计算真菌多糖含量。
将测量所得的OD值通过线性回归方程的计算得表5,由表5可知,菌丝体中虫草酸(D-甘露醇)和虫草多糖含量均高于天然蝉花中的含量,菌丝体虫草酸的含量为149.52mg/g约高出天然蝉花(53.6mg/g)2倍,真菌多糖的含量为115.11mg/g约高出天然蝉花(33.2mg/g)3倍[6]。
3 结论
本试验对蝉花中的真菌进行了研究,分离出的蝉拟青霉系天然蝉花中主要真菌。通过对其的筛选和纯化,获得了较好的发酵菌种:该菌株可以脱离蝉花宿主进行生长,采用改良PDA培养基对其进行液体发酵,培养5d可获得较大的生物量。蝉花真菌的液态培养最优条件为28℃、接种量为4%、摇床转速为150r/min。经工艺优化,蝉花菌丝体的产量为5.94g/L。蝉花菌丝体中的化学成分与天然蝉花含量较为接近,其中粗蛋白的含量为27.19%,粗纤维含量为6.20%,粗脂肪含量为7.79%,水分含量8.91%,灰分含量1.71%。蝉花菌丝体中虫草酸与真菌多糖这两种活性物质分别为149.52,115.11mg/g,比天然蝉花的含量要高。因此可以将蝉花菌丝体应用于保健食品和药品上来替代天然蝉花,这样可以降低生产成本。本试验未研究蝉花菌丝体中虫草素和麦角甾醇等活性物质,在后续的试验中可对其他物质进行测定,这样有利于进一步证明蝉花真菌菌丝体的食用价值和药用价值。
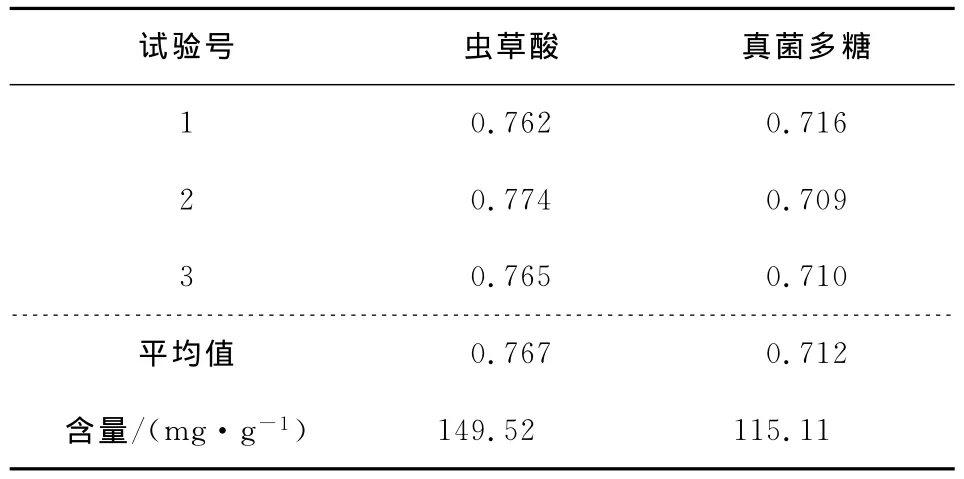
表5 蝉花菌丝体中虫草酸和真菌多糖的含量Table 5 Contents of D-mannitol and polysaccharide in in fermented mycelia
1 黄年来.中国大型真菌原色图鉴[M].北京:中国农业出版社,1998:71.
2 曾凡清,刘德云,宋小亚,等.蝉花的分离和培养研究[J].食药用菌,2008(4):28~29.
3 王春雷,芦柏震,侯桂兰,等.中国蝉花的研究进展[J].中国药学杂志,2006,41(4):244~247.
4 杨介钻,卓佳,陈柏坤,等.蝉拟青霉多糖对老年大鼠免疫功能的调节作用[J].中国中药杂志,2008,33(3):292~295.
5 金丽琴,熊中奎,吕建新.蝉拟青霉多糖免疫调节和抗肿瘤活性的实验研究[J].中国病理生理杂志,2008,24(3):494~497.
6 葛飞,夏成润,李春如,等.蝉拟青霉菌丝体与天然蝉花中化学成分的比较分析[J].菌物学报,2007,26(1):68~75.
7 中华人民共和国卫生部.GB 5009.3——2010食品中水分的测定[S].北京:中国标准出版社,2010.
8 中华人民共和国国家质量监督检验检疫总局.GB/T 5511——2008谷物和豆类 氮含量测定和粗蛋白质含量测定[S].北京:中国标准出版社,2008.
9 中华人民共和国国家质量监督检验检疫总局.GB/T 14772——2008食品中粗脂肪的测定[S].北京:中国标准出版社,2008.
10 中华人民共和国卫生部.GB/T 5009.10——2003植物类食品中粗纤维的测定[S].北京:中国标准出版社,2003.
11 中华人民共和国卫生部.GB 5009.4——2010食品中灰分的测定[S].北京:中国标准出版社,2010.
12 夏敏,温鲁.微波法提取虫草素研究[J].食品科学,2006,27(10):248~251.
13 董钰明,刘晖,张军,等.比色法测定复方虫草颗粒中甘露醇的含量[J].中草药,2001,32(8):697~699.
14 黄纯,马驰,宋慧智,等.亮菌多糖提取中脱蛋白和脱色方法比较[J].药学与临床研究,2007,15(1):45~46.
15 来永斌,王琦,孙月,等.蛹虫草多糖含量的测定与分析[J].中成药,2001,23(7):517~518.
