黄酒发酵动力学研究
2013-09-07彭金龙姬中伟黄桂东谢广发邹慧君
彭金龙 毛 健, 姬中伟 黄桂东 谢广发 邹慧君
(1.江南大学食品学院,江苏 无锡 214122;2.国家黄酒工程技术研究中心,浙江 绍兴 312000)
黄酒为世界三大古酒之一,源于中国,唯中国有之,因其富含糖类、氨基酸、维生素、蛋白质、多酚、微量元素、酯类等成份,且易被人体消化吸收,被誉为“液体蛋糕”[1-3]。千百年来,黄酒主要是采用传统的陶缸、陶坛作为发酵容器进行的手工作坊式生产[4,5]。但是传统的依靠自然气候条件发酵生产黄酒的过程,很难控制,从而造成了黄酒产量增长速度缓慢、各批次品质差异较大,这使得机械化大罐生产黄酒成为黄酒生产工艺革新的必然趋势[6],然而大罐生产黄酒的关键技术还未被完全突破。
发酵动力学是对试验过程进行定量分析,对试验指标进行较为准确的预测[7],对发酵过程放大及从分批发酵过渡到流加发酵、连续发酵有着重要指导作用的过程,目前在葡萄酒[8]、醋[9]、籼米酒[10]、樱桃果酒[11]等生产中已得到了广泛应用。本试验基于对黄酒发酵过程中的化学反应、菌体的新陈代谢机理等的研究,建立黄酒发酵的动力学方程,这将有利于更准确的掌握、了解黄酒发酵过程的各重要参数,对实现黄酒发酵自动化具有重要的指导意义。
1 材料与方法
1.1 试验材料
糯米:购于江苏无锡;
麦曲:浙江古越龙山绍兴酒股份有限公司;
活性干酵母:安琪酵母公司;
其他试剂:分析纯,国药集团化学试剂有限公司。
1.2 仪器与设备
电子分析天平:FA204N型,上海精密科学仪器有限公司;
离心机:4K15型,德国Sigma公司;
恒温水浴锅:HH-S2系列,江苏金坛环宇科学仪器厂;
分光光度计:722S型,上海精密科学仪器有限公司;
精密pH计:PHS-3C型,上海精密科学仪器有限公司;
酒度计:浙江余姚黄家埠玻璃仪表厂;
电热鼓风干燥箱:HG101-2型,南京实验仪器厂;
全自动控制黄酒专用发酵罐:BIOTECH 10L型,上海保兴生物设备工程有限公司。
1.3 黄酒的酿造工艺
按照机械化酿造黄酒的工艺酿造黄酒[12],发酵罐中投料量按照5L发酵罐配比投料(10L发酵罐投料相对5L放大1倍):糯米投料量1kg(室温浸米24h后蒸饭),酿酒用活性干酵母2g(用2g蔗糖,100mL蒸馏水,40℃活化40min,确保初始酵母菌数的数量为107个/g),加水1.5L(包括700mL米浆水),曲170g(原料米的17%)。前酵温度为30℃,后酵温度为15℃。前酵每隔12h取1次样,后酵每隔24h取1次样,测定残糖浓度、酒精度和菌体生物量。
1.4 检测方法
向发酵罐中冲入无菌空气将黄酒醪液混匀后,从发酵罐中取250mL醪液,测定残糖浓度、酒精度和菌体生物量。按照林巧等所述的细胞干重法[11]测定菌体生物量:10mL黄酒醪液3 000r/min离心3min后,上层液体再1 000r/min离心10min,倒去上清液待用,沉淀物(菌体)于105℃烘干至恒重后称量;另取240mL黄酒发酵醪液,用双层纱布过滤后,滤液3 000r/min离心5min,将离心后的上清液按照GB/T 13662——2008[13]中所述的亚铁氰化钾滴定法和蒸馏法测定残糖浓度和酒精度。
1.5 数据处理
使用 Matlab,结合csape、nlinfit、ppval、fnder软件,根据试验所得数据,对酵母生长动力学方程、酒精生成动力学方程和底物糖消耗动力学方程进行非线性回归,求解出模型的参数。
2 结果与分析
2.1 黄酒发酵过程主要物质变化曲线
将酿造黄酒所有原辅料投入到10L发酵罐中,按照机械化酿造黄酒工艺酿造黄酒,测定残糖浓度、酒精度和菌体生长量,所得黄酒发酵过程主要物质变化曲线见图1。

图1 黄酒发酵过程主要物质变化曲线Figure 1 Metabolic curves of fermentation process of Chinese rice wine
由图1可知,酵母菌的生长速度很快,接种后不久便开始进入对数生长期。当酵母菌发酵至4d后菌体生长进入了稳定期,此时菌体生物量达到最高值20.34g/L;7d后,黄酒发酵液中菌体细胞进入衰亡期,细胞生长环境恶化,活细胞死亡率增加,细胞浓度迅速降低。对于产物酒精,其产量在前5d内快速增长;5d后黄酒发酵进入后发酵期,发酵温度降为15℃,酵母产酒精也变得缓慢。体系中的总糖因维持菌体生长,形成产物,维持细胞呼吸新陈代谢作用而不断消耗,因此不断减小。
2.2 菌体生长动力学模型的建立
由于黄酒生产周期长,菌体生长可明显分为前期(生长期及稳定期)和后期(衰亡期)两个阶段,因此采用分段函数对菌体生长状况进行描述。
(1)发酵前期:Logistic模型是一个典型的S形曲线方程,广泛应用于发酵的细胞生长过程[14],能够较好地反映发酵过程中由于细胞浓度增加对其自身所产生的抑制效应。根据黄酒发酵特点,选用Logistic模型描述菌体细胞前期的生长情况,求解各参数:

式中:
X—— 菌体浓度,g/kg·醪液;
μm—— 最大比生长速率,h-1;
Xm—— 最大菌体浓度,g/L。
对式(1)两边积分得式(2):

根据发酵过程中的试验数据,X0=7.37,Xm=20.34及估算值μm=0.135,结合Logistic模型,使用Ode45,对微分方程(2)拟合求解得到X0=7.00,Xm=20.29及μm=0.277,并代入方程(2),得:

(2)发酵7d后,菌体细胞进入衰亡期,在衰亡期细胞生长环境恶化,活细胞死亡速率增加,细胞浓度迅速降低,在此不作考虑。
2.3 酒精生成模型
黄酒发酵过程中,酒精是酵母细胞代谢的产物,基于此理论,酒精的形成模型应该与菌体的质量浓度相关。由此,可采用较为通用的由 Luedeking R 和 Piret EL[15,16]于1959年所提出的数学模型:

式中:
α——生长相关系数;
β——非生长相关系数;
p—— 产物浓度,g/L;
对于酒精生成过程是与酵母生长相关的过程,因此黄酒发酵过程显然属于产物部分偶联型(α≠0,β≠0)的相关模型。式(4)两边积分得式(5):

通过软件拟合得到生长相关系数α=66.10,代入式(5)得到产物生成动力学模型公式:
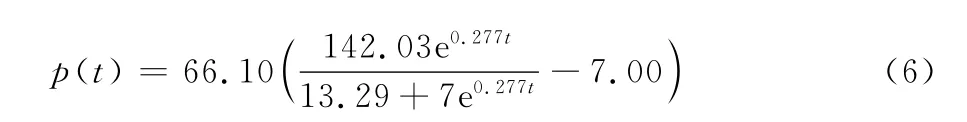
2.4 底物糖消耗模型
黄酒发酵过程中,底物消耗模型应从底物消耗的3个部分来考虑:形成产物,供给菌体生长,维持细胞呼吸新陈代谢作用[17]。基于此原理,黄酒发酵过程中底物糖消耗模型的建立形式为:

式中:
Yx/s—— 菌体对底物的得率系数;
Yp/s—— 酒精对底物的得率系数;
m—— 维持系数,h-1;
S—— 底物浓度,g/L;
底物在细胞内合成产物的模型取决于产物的生成是否与能量代谢过程相偶联。当产物的生成是以产能途径进行时,则由于细胞生长和维持能,生成产物则是不可避免的,此时无单独底物流入细胞用于生成产物,而所生成产物所消耗的底物来自于用于生长和维持能的底物,并且消耗于维持能的底物对细胞生长无作用。对于酵母发酵产酒精这一生理过程,生产酒精所消耗的底物来自于细胞生长维持能的底物,此时产物的生成直接与能量的生产相联系,因此底物的消耗速率方程不包括单独的产物生成项,可将原方程化简为:

上式两边积分得:

黄酒发酵过程中,以残糖含量作为底物消耗指标,通过拟合得到模型参数初始底物浓度S=107.7,底物的细胞生长得率系数Yx/s=0.066 9、维持系数m =0.193,代入上式得到底物消耗模型为:

2.5 模型验证
按照机械化酿造黄酒的工艺条件,进行黄酒分批发酵的重复试验,将分批发酵所得的实验值与上述参数代入后得到的动力学模型预测的理论值进行比较,结果见表1。比较发现:用动力学模型拟合分批发酵过程除极个别点外,大部分数据点的误差均小于10%,发酵终点的糖含量误差很大,可能是由亚铁氰化钾滴定法带来的误差,而且残糖浓度基本接近于零,可舍去该点。菌体生长、产物形成和底物消耗的平均相对偏差分别为8.88%、3.45%和1.58%,表明所拟合的动力学模型较好地反映了实际的发酵过程。

表1 动力学模型计算值与实验值的比较Table 1 Error proof of Dynamics model of pullulan fermentation
3 结论
本研究分别采用Logistic方程与Luedeking R经验方程描述酵母的生长与酒精合成、底物消耗过程,建立了黄酒发酵过程中菌体生长模型、酒精生成模型和底物糖消耗模型,并对模型加以验证。
通过对黄酒发酵动力学的研究,进一步了解了黄酒发酵过程中微生物生理特征,发酵过程中底物消耗和产物形成的规律,以及各参数之间的关系,为黄酒发酵过程工艺控制和黄酒大罐发酵的设计提供了理论基础。
1 傅金泉.黄酒生产技术[M].北京:化学工业出版社,2005:1~3.
2 王存厚.谈黄酒派生出的料酒及作用[J].中国酒,2002(6):62~63.
3 Legras J,Merdinoglu D,Cornuet J,et al.Bread,beer and wine:Saccharomyces cerevisiae diversity reflects human history[J].Molecular Ecology,2007,16(10):2 091~2 102.
4 周恒刚.古今酿酒与陶器[J].酿酒科技,2000(5):31~32.
5 Bautista-Ortin A,Lencina A,Cano-Lopez M,et al.The use of oak chips during the ageing of a red wine in stainless steel tanks or used barrels:effect of the contact time and size of the oak chips on aroma compounds[J].Australian Journal of Grape and Wine Research,2008,14(2):63~70.
6 梁庆华.黄酒弱势逆转须抓准7个关键点[N].中国食品报,2010-01-06(007).
7 Phisalaphong M,Nuttapan S,Tanthapanichakoon W.Mathematical modeling to investigate temperature effect on kinetic parameters of ethanol fermentation[J].Biochemical Engineering Journal,2006(28):36~43.
8 Mannazzu I,Angelozzi D,Belviso S,et al.Behaviour of Saccharomyces cerevisiae wine strains during adaptation to unfavourable conditions of fermentation on synthetic medium:Cell lipid composition,membrane integrity,viability and fermentative activity[J].International Journal of Food Microbiology,2008(21):84~91.
9 De Ory I,Romero L,Cantero D.Optimum starting-up protocol of a pilot plant scale acetifier for vinegar production[J].Journal of Food Engineering,2002,52(1):31~37.
10 刘小翠,赵思明,王莲.籼米甜酒的发酵动力学及工艺优化[J].食品科学,2007,28(12):263~267.
11 林巧,李燕红,孙小波,等.樱桃果酒发酵动力学研究[J].中国酿造,2007(7):65~67.
12 李家寿.黄酒酿造工艺[M].北京:中国酿酒工业协会黄酒分会编印,2004:147~150.
13 全国食品工业标准化技术委员会酿酒分技术委员会.GB/T 13662——2008黄酒[S].北京:中国标准出版社,2008.
14 Ikasari L,Mitchell D.Two-phase model of the kinetics of growth of Rhizopusoligosporus in membrane culture[J].Biotechnol.Bioeng,2000(68):619~627.
15 Luedeking R,Piret E L.A kinetic study of the lactic fermentation[J].Jornal of BiochemIcal and Microbiological Technology and English,1959(1):393~430.
16 Berry A,Franco C,Zhang W.Growth and lactic acid production in batch culture of Lactobacillus rhamnosus in a defined medium[J].Biotechnology Letters,1999(21):163~167.
17 张中义,张勇,孙君社.植物乳杆菌合成CLA发酵动力学研究[J].食品与机械,2007(5):7~10.
