白藜芦醇对呼吸道合胞病毒复制相关周期的影响
2013-09-06徐建亚李佳曦单进军汪受传
徐建亚, 徐 珊, 陈 超, 李佳曦, 单进军, 汪受传
(南京中医药大学第一临床医学院儿科研究所,江苏南京210046)
呼吸道合胞病毒 (Respiratory Syncyntial Virus,RSV)是引起婴幼儿下呼吸道感染的主要病原,可导致婴幼儿感染肺炎和支气管炎[1]。目前临床上治疗或预防RSV疾病的药物主要是核苷类似物利巴韦林 (病毒唑)与帕利珠单抗,但均有其局限性[2]。
金欣口服液 (麻黄、苦杏仁、生石膏、葶苈子、桑白皮、前胡、黄芩、虎杖组成),由南京中医药大学博导、中医儿科名医汪受传教授领衔研制,治疗RSV肺炎疗效显著优于利巴韦林注射液且临床使用安全[3]。为了探索金欣口服液治疗RSV肺炎的物质基础,前期本课题组研究了黄芩(复方组分之一)的主要有效成分黄芩苷对RSV复制周期的影响,发现黄芩苷不能抑制RSV的复制、转录及融合[4]。金欣口服液另一主要组分是具抗病毒、抗菌作用的清热解毒中药虎杖。国内外大量文献报道,虎杖的主要活性成分白藜芦醇 (Resveratrol)除抗肿瘤等生物活性外,还有抗病毒、抗炎等作用[5-6]。Drago等[7]研究表明白藜芦醇具有抗RSV的作用,而关文达等[8]研究结果相反。
为进一步探讨金欣口服液药效物质基础,研究白藜芦醇的抗RSV活性及其作用机制,从RSV感染周期角度开展了以下相关研究。
1 材料与方法
1.1 材料 Hep-2(人喉癌上皮细胞),中国科学院上海生命科学研究院细胞资源中心。Hep-2采用含10%小牛血清 (FCS)的DMEM培养液,于37℃、5%CO2及饱和湿度下培养。
RSV(Long株),武汉大学中国典型培养物保藏中心,于Hep-2细胞上扩增。以细胞病变法测定RSV半数细胞感染量 (TCID50)[4]。
白藜芦醇,中国药品生物制品检定所,批号:111535-200502,纯度95%以上。RSV的F蛋白抗体 (小鼠抗人),Fluor Alex488标记二抗 (羊抗小鼠),Invitrogen公司。RSV核酸测定试剂盒,上海之江生物科技有限公司。 [3H]CTP(-20 Ci/mmol),MA 02118,Boslon公司。
1.2 白藜芦醇对Hep-2的最大无毒浓度测定(MTT法) Hep-2于96孔板中长成单层后,漂洗后加白藜芦醇药液100 μL(5个浓度,分别为100、50、25、10、1 μmol/L;正常对照组换维持液),培养、观察细胞病变至72 h,并以MTT法测定白藜芦醇对Hep-2的最大无毒浓度。
1.3 白藜芦醇对RSV复制的影响 (RT-qPCR法)Hep-2于6孔板中生长并分组:正常对照组、RSV感染模型组、白藜芦醇干预组,分别简称正常组、病毒组、白藜芦醇组。至细胞数达5×107以上时,接种0.2 mL 100 TCID50的RSV液 (正常组除外)。吸附1.5h后 (37℃),正常组、病毒组分别加全培3 mL,白藜芦醇组加25 μmol/L药液3 mL,培养24 h后收集细胞,裂解、提取总RNA,qPCR法检测RSV mRNA水平。具体参照文献[4]。
1.4 白藜芦醇对RSV的RNA依赖的RNA聚合酶(RdRP)活性的影响 (体外转录法) 病毒感染及药物干预后的Hep-2分组基本同1.3项所述,只是改“药液中培养24 h后收集细胞”为药物干预19 h后再以2 μg/mL放线菌素D处理1 h再收集细胞,分离病毒核糖体复合体 (RNP complex)进行体外转录,最后用同位素法测定mRNA全长转录本含量。具体步骤参照Stephen的RSV poly(A)捕获法[4,9]。转录掺入的放射性核苷酸 [3H]CTP的强度用多功能微孔板检测仪 (芬兰HideX,Chameleon V型)检测。放射强度与体外转录的mRNA全长转录本水平正相关,而转录本水平越高说明RdRP的实际转录活性越高。
1.5 白藜芦醇对RSV介导的细胞融合效应的影响(IF/LSCM法) 制作Hep-2细胞爬片,培养18 h后接种100 TCID50RSV液0.2 mL(正常组不接种病毒)。吸附1.5 h后弃病毒液,除白藜芦醇组加25 μmol/L药液1 mL外,其余组均加培养液1 mL,培养48 h后进行免疫荧光标记 (IF)及激光扫描共聚焦显微镜 (LSCM)观察,具体参照文献[4]。
1.6 统计学分析 数据均采用SPSS11.5软件进行统计处理,数据用±s表示,多组间差异采用单因素方差分析,组间两两比较采用Tukey法。P<0.05认为差异有显著性。
2 结果
2.1 白藜芦醇对Hep-2细胞的最大无毒浓度 经细胞病变法及MTT法测定,白藜芦醇对Hep-2细胞的最大无毒浓度为25 μmol/L,其他实验中均以该浓度作为白藜芦醇的终浓度。
2.2 白藜芦醇对RSV核酸复制的影响 RT-qPCR结果如下:与正常组相比,病毒组mRNA水平显著升高 (P<0.001),表明病毒感染模型成功。与病毒模型组比较,25 μmol/L白藜芦醇对病毒mRNA水平无显著影响 (表1)。
表1 qPCR法测定RSV mRNA水平 (n=3,±s)Tab.1 Absolute level for RSV by qPCR(n=3,±s)

表1 qPCR法测定RSV mRNA水平 (n=3,±s)Tab.1 Absolute level for RSV by qPCR(n=3,±s)
注:与正常组比较,*P<0.001。
组别 RSV mRNA量 (×106)正常组0.001±0.000 02病毒组 2.023±0.034*白藜芦醇 (25 μmol/L)组2.155±0.090
2.3 白藜芦醇对RdRP活性的影响 病毒组与正常组相比较,放射性核苷酸辐射强度显著升高,25 μmol/L白藜芦醇作用于RSV感染细胞后,辐射强度显著降低 (图1)。
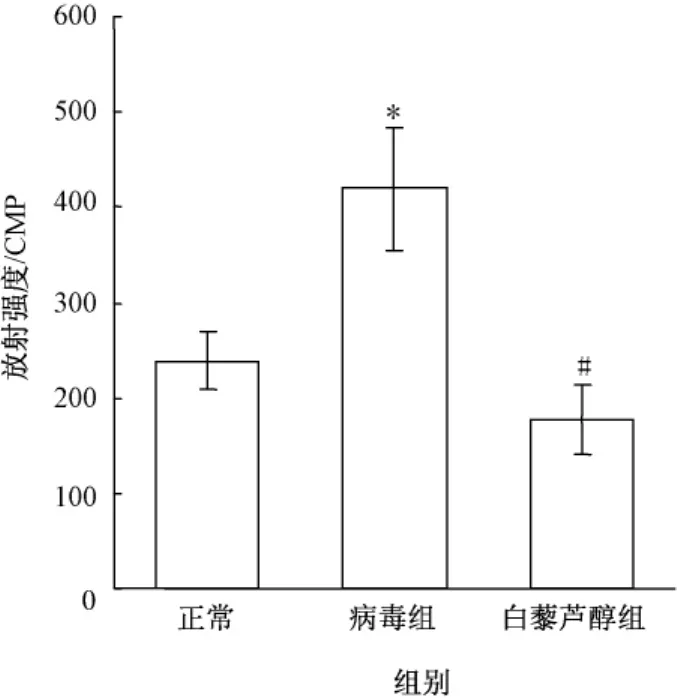
图1 白藜芦醇对放射强度的影响Fig.1 Effect of resveratrol on intensity of radiation
2.4 白藜芦醇对RSV介导的细胞融合的影响 IF结合LSCM实验结果如下:病毒组大面积融合形成典型融合大胞且绿色荧光强度高,表明细胞表达F蛋白量多;25 μmol/L白藜芦醇作用后,荧光强度减弱但不显著,表明F蛋白表达量稍减少,仍形成典型融合胞。正常组,无绿色荧光、无细胞融合。
3 讨论
白藜芦醇 (resveratrol),一种天然活性成分,化学名为3,4',5-三羟基-二苯乙烯,最早从毛叶藜芦Veratrum grandiflorum中分离得到,是虎杖的主要活性成分之一。《中国药典》确定其为虎杖的有效成分和质控指标之一。近年研究发现白藜芦醇具有多种生物学活性,其中不少研究表明其具有抗呼吸道病毒活性 (如甲 1 型流感病毒[10]、RSV[7])。但关文达等[8]研究表明白藜芦醇 (8.3 μg/mL)于体外抑制腺病毒7型作用,对RSV long株未见明显抑制作用。以上白藜芦醇抗RSV相关研究均仅限于细胞病变抑制法 (CPE)观察抗病毒效应。本课题组采用该方法研究结果表明白藜芦醇 (25 μmol/L相当于5.7 μg/mL)对RSV感染的 Hep-2病变具有抑制作用 (另文发表)。分析原因可能与关文达等采用的A549细胞与Hep-2相比对RSV的敏感性较差相关。
RSV感染细胞时,首先与细胞黏附,后与细胞融合并侵入细胞内,进行核酸复制、转录及翻译其核衣壳蛋白,最后装配及从细胞内释放子代病毒,以上过程组成其生命周期,其中任何一个阶段都是潜在的抗病毒靶标[11]。
本课题组前期研究证实了金欣口服液能抑制RSV介导的细胞融合,途径之一是通过调节RSV的F蛋白表达[12],但是该复方的主要组分之一——黄芩,其有效成分黄芩苷对RSV复制相关周期无显著作用[4]。本实验中采用相同方法研究了白藜芦醇对RSV复制、转录及融合的影响:首先采用RT-qPCR技术检测RSV的特异性RNA核酸片段,发现白藜芦醇干预病毒感染后的细胞对RSV核酸水平无明显影响,即白藜芦醇不能抑制RSV在细胞内复制;进一步采用RSV poly(A)捕获法[9]检测白藜芦醇对RdRP转录活性的影响,发现白藜芦醇能够抑制RNP体外转录mRNA,即能够抑制RSV的RdRP转录活性。
RSV的RNA聚合酶转录活性被抑制理论上意味着RSV核酸在细胞内转录被抑制,F蛋白表达量应显著降低,其介导的细胞融合亦应被抑制,但是本实验研究结果与理论不符。本实验采用IF结合LSCM检测表明白藜芦醇对RSV的F蛋白表达量及其介导的细胞融合抑制作用不明显。分析原因可能如下:本实验采用体外转录系统检测RNA聚合酶转录活性,与实际细胞内 (包括动物体内)转录有差别;体内 (细胞内)转录过程及转录后翻译可能存在负反馈调节机制,致使RSV在细胞内的实际转录结果未表现出被抑制。白藜芦醇抑制RSV感染的Hep-2病变效应可能通过其他途径实现的。
近年来,随着研究深入,发现RSV感染涉及到由多种细胞和细胞因子参与的固有免疫应答和适应性免疫应答,其中Toll样受体 (TLR),特别是TLR4、TLR3、TLR7等受体及其衔接蛋白MyD88与RSV感染关系密切[13-14]。白藜芦醇是否通过TLRs介导的信号通路调节机体免疫功能发挥抗RSV效应,本课题组正进行相关研究。初步研究结果表明白藜芦醇能够调控RSV感染初期TLR3介导的信号通路及下游相关炎症细胞因子的表达。
[1]Welliver R C.Pharmacotherapy of respiratory syncytial virus infection[J].Curr Opin Pharmacol,2010,10(3):289-293.
[2]Banning M.Respiratory syncytial virus:disease,development and treatment[J].Brit J Nur,2006,15(14):751-755.
[3]汪受传,韩新民,任现志,等.小儿病毒性肺炎痰热闭肺证治疗方法研究[J].南京中医药大学学报,2004,20(2):72-75.
[4]徐建亚,徐 珊,陈 超,等.黄芩苷对RSV转录、复制及融合效应的影响,中成药,2011,33(12):2055-2058.
[5]黎永胜,文 军.白藜芦醇的药理作用研究进展.医学综述,2008,14(3):469-471.
[6]Campagna M,Rivas C.Antiviral activity of resveratrol[J].Biochem Soc Trans,2010,38(Pt 1):50-53.
[7]Drago L,Nicola L,Ossola F,et al.In vitroantiviral activity of resveratrol against respiratory viruses[J].J Chemother,2008,20(3):393-394.
[8]关文达,杨子峰,刘 妮,等.白藜芦醇对多种呼吸道病毒作用体外实验研究.中药材,2008,31(9):1388-1390.
[9]Mason S W,Lawetz C,Gaudette Y,et al.Polyadenylation-dependent screening assay for respiratory syncytial virus RNA transcriptase activity and identification of an inhibitor[J].Nucl Acids Res,2004,32(16):4758-4767.
[10]Palamara A T,Nencioni L,Aquilano K,et al.Inhibition of Influenza A Virus Replication by Resveratrol[J].J Infect Dis,2005,191(10):1719-1929.
[11]Prober C G,Sullender W M.Advances in prevention of respiratory syncytial virus infections[J].J Pedia,1999,135(5):546-558.
[12]彭璐璐,徐建亚,汪受传,等.基于RSV对细胞的感染周期研究金欣口服液的干预作用,中成药,2011,33(11):143-145.
[13]Greene C M,McElvaney N G.Toll-like receptor expression and function in airway epithelial cells[J].Arch Immunol Ther Exp,2005,53(5):418-427.
[14]Cyr S L,Angers I,Guillot L,et al.TLR4 and MyD88 control protection and pulmonary granulocytic recruitment in a murine intranasal RSV immunization and challenge model[J].Vaccine,2009,27(3):421-430.
