冠心苏合胶囊大鼠含药血清抗氧化损伤致心肌凋亡机制研究
2013-09-06宋君秋娄建石
张 曦, 宋君秋, 汪 云, 李 欣, 康 毅, 娄建石
(天津医科大学基础医学院药理教研室,天津300070)
冠心病是由于冠状动脉固定性或动力性病变,致使血管管腔狭窄堵塞,引起心肌缺血缺氧或坏死的缺血性心脏病,是人类心血管健康的最大威胁。中医药治疗冠心病在缓解患者症状、改善病理损伤方面表现出独特的优势。
冠心苏合具有宽胸、理气、止痛的功效,临床用于治疗冠心病心绞痛。本课题采用血清药理学方法采集含药血清,利用生物化学检测手段探讨冠心苏合抗氧化损伤致心肌细胞凋亡作用机制,为临床用药提供理论依据。
1 材料与方法
1.1 实验材料
1.1.1 药物、试剂及仪器 冠心苏合胶囊 (天津宏仁堂药业有限公司,批号102009)、Hoechst染色试剂盒 (批号:KGA211)、BCA蛋白测定试剂盒 (批号:KGPBCA)、caspase-3活性测定试剂盒(批号:KAG203)均来自凯基生物有限公司、兔抗鼠多克隆抗体Bcl-2(批号:BS1511,Bioworld公司)、辣根过氧化物酶标记的山羊抗兔二抗 (批号:BS10350,Bioworld公司)、β-actin内参 (批号:AP0060,Bioworld公司)、兔抗鼠多克隆抗体Bax(批号20110910,ABcam公司,美国)、倒置相差显微镜 (型号:CK40-F200,Olympus公司生产,日本)、CO2孵箱 (型号:3111,Thermo Electron Corporation,美国)、酶标仪 (型号:Model680,BIORAD公司生产,美国)、荧光显微镜(型号:MF41,Olympus公司,日本)Western bloting相关耗材由BIORED公司提供。
1.1.2 动物 SD大鼠40只,雌雄各半,体质量230~280 g(军事医学科学院,动物合格证号0005984)。饲养条件:温度 (22±2)℃;相对湿度40%~60%;光照周期,12/12 h,自由进食进水;SD新生乳鼠 (3 d内),25只,雌雄不拘 (军事医学科学院,合格证号0005356)。
1.2 实验方法
1.2.1 含药血清与空白血清的制备 取40只SD种大鼠,随机分为正常对照组10只,冠心苏合组30只。冠心苏合组大鼠灌胃给予冠心苏合胶囊,800 mg/kg,给药体积为10 mL/kg,每日两次,连续给药4 d。正常对照组灌胃给予等量生理盐水,操作同上。末次给药后1 h,无菌条件下,经腹主动脉充分取血,分离含药血清。过滤除菌,分装,置-20℃保存备用。
1.2.2 原代乳鼠心肌细胞分离培养及氧化损伤模型的确立 取新生3 d内的SD乳鼠15只,在超净台中剪下心脏,加入37℃ 孵育的混合消化酶液(0.05%胰蛋白酶和0.055%胶原酶Ⅱ溶液)将心肌组织消化成单细胞悬液,差速贴壁去除非心肌细胞,调整细胞密度至5×105/mL种于25 cm2细胞培养瓶中,同时以1×104/孔接种于96孔板内,加入BrdU,于37℃、5%CO2孵箱中孵育。细胞贴壁48 h后方可换液,待大部分心肌细胞有搏动时加入H2O2使其终浓度分别为 100、200、400 μmol/L,继续培养1、2、4 h,确立最合适的H2O2损伤浓度和时间。
1.2.3 实验分组 将培养的心肌细胞随机分为阴性对照组、正常血清对照组、氧化损伤模型组、冠心苏合高剂量组 (含药血清原液)、中剂量组 (按含药血清原液∶DMEM=3∶1配制)和低剂量组(按含药血清原液∶DMEM=1∶1配制),除阴性对照组外,各组细胞在给药后2 h均加入终浓度为100 μmol/L 的 H2O2,继续培养2 h。
1.2.4 MTT法检测细胞存活率 培养结束后,各组细胞弃去原有培养基,加入 10 μL MTT(5 mg/mL)和90 μL无FBS高糖DMEM培养基,放入培养箱中继续培养4 h后,小心吸取上清液,每孔加入150 μL DMSO,490 nm波长处检测吸光度。细胞存活率 (%)=(OD检测组/OD对照组) ×100%。
1.2.5 Hoechst33258染色形态学研究 取6孔板中稳定搏动2 d原代心肌细胞建立H2O2氧化损伤模型,取各浓度药物作用于心肌细胞 (实验分组与MTT相同),在培养箱中37℃孵育1 h;弃去6孔板中液体,PBS洗细胞3次;4%甲醛于4℃固定细胞10 min;弃去甲醛,PBS洗细胞2次,自然晾干;每孔加入Hoeschst33258染料150 μL,避光染色10 min后水冲净晾干;荧光显微镜观察照相。
1.2.6 caspase-3活性的测定
(1)蛋白定量
根据BCA试剂盒要求绘制蛋白标准曲线;根据标准曲线定量蛋白。
(2)caspase-3检测
吸取50 μL细胞裂解上清 (蛋白质量浓度为100 ~200 μg/mL);加入 50 μL 的 Reaction buffer;加入5 μL caspase-3 Substrate并于37℃避光孵育4 h;用酶标仪在波长400 nm测定其吸光值。通过计算OD诱导剂/OD阴性对照的倍数来确定凋亡诱导剂组caspase-3活化程度。
1.2.7 Western blot测定Bcl-2及Bax蛋白的表达收集各组药物作用后的心肌细胞,裂解后BCA法进行蛋白定量;用loading buffer配制好上样蛋白,100℃煮蛋白20 min,分装,-20℃保存;根据蛋白分子量制备12%的分离胶和积层胶;上样完毕后按照积层胶恒压80 V,分离胶恒压120 V电泳,待溴酚蓝移至玻璃板最下端即可停止电泳。装好转膜装置,恒流350 mA电转2.5 h;按照marker指示切割目的条带,室温下封闭2 h;加入含兔抗小鼠多克隆抗体 (稀释比例为1∶1 000)的一抗工作液,4℃过夜;TBST摇洗3次,10 min/次;加入鼠抗兔IgG抗体,25℃孵育2 h;TBST摇洗3次,将多余二抗洗净,10 min/次;ECL超敏发光液处理目的条带1 min,暗室中曝光,显影,定影,待X光片干透即可扫描,用Quantity one软件对蛋白条带进行灰度分析。
2 结果
2.1 冠心苏合含药血清对H2O2所致乳鼠心肌细胞损伤存活率的影响 与阴性对照组比较,H2O2处理时细胞存活率显著降低 (P<0.01),与模型组比较,冠心苏合含药血清组细胞存活率均明显提高(P<0.01),且呈剂量相关性 (见表1)。
表1 冠心苏合含药血清对H2O2损伤的原代乳鼠心肌细胞存活率的影响(±s,n=6)Tab.1 Viability of H2O2injured primary cultured cardiomyocytes after being treated by Guanxin Suhe-containing serum for different doses(±s,n=6)
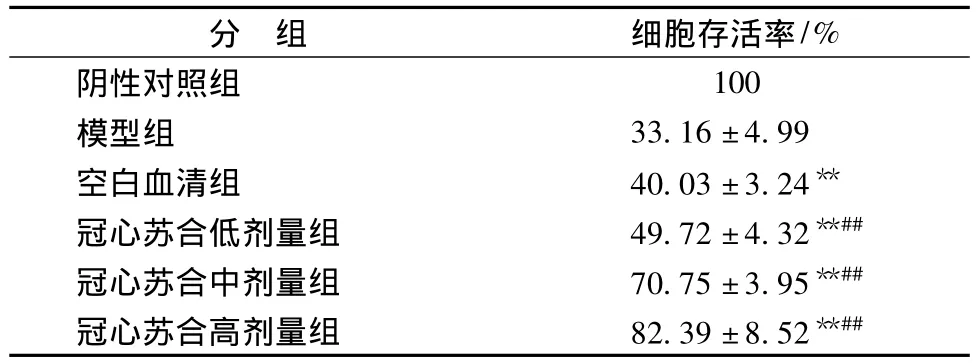
表1 冠心苏合含药血清对H2O2损伤的原代乳鼠心肌细胞存活率的影响(±s,n=6)Tab.1 Viability of H2O2injured primary cultured cardiomyocytes after being treated by Guanxin Suhe-containing serum for different doses(±s,n=6)
注:与阴性对照组比较,**P<0.01;与模型组比较,##P <0.01。
分 组 细胞存活率/%阴性对照组100模型组 33.16±4.99空白血清组 40.03 ±3.24**冠心苏合低剂量组 49.72±4.32**##冠心苏合中剂量组 70.75±3.95**##冠心苏合高剂量组 82.39±8.52**##
2.2 Hoechst33258染色结果显示 与模型组相比,空白血清组能稍微减少细胞核固缩凝聚,冠心苏合各剂量组随着药物浓度升高细胞核固缩凝聚减轻,碎片依次减少,说明冠心苏合各剂量组能够有效的抑制细胞凋亡。
2.3 caspase-3活性的测定结果 与阴性对照组相比,H2O2处理使得caspase-3活性明显升高 (P<0.01);与模型组相比空白血清组变化不大;与模型组及空白血清组相比,caspase-3活性随含药血清浓度增高而降低,说明含药血清能够阻止caspase-3的激活,结果如表2。
2.4 Bcl-2及Bax蛋白的表达 Western blot检测显示,与阴性对照组相比,H2O2处理使得Bax蛋白表达上调,Bcl-2蛋白表达下调 (P<0.01);与模型组相比,冠心苏合给药组能够下调Bax水平,上调Bcl-2水平 (P<0.01)且呈现剂量依赖性(见表3,图1)。
表2 冠心苏合含药血清对H2O2损伤的心肌细胞caspase-3活性的影响(± s,n=6)Tab.2 Effect of Guanxin Suhe-containing serum on caspase-3 activity in primary cultured cardiomyocytes injured by H2O2(± s,n=6)
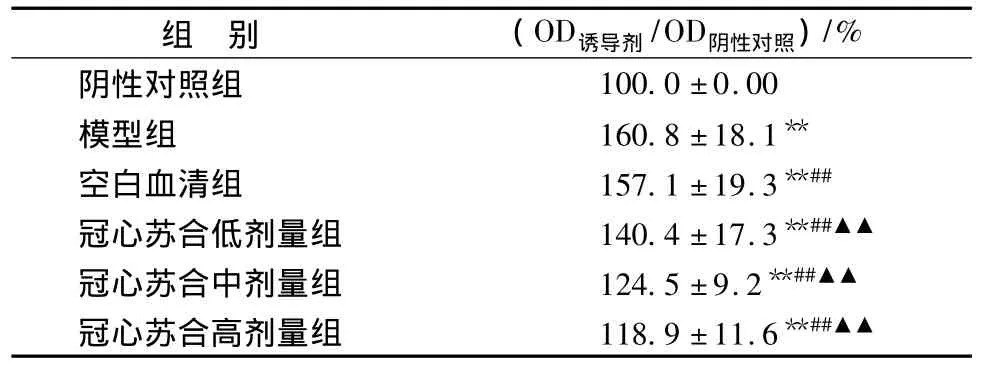
表2 冠心苏合含药血清对H2O2损伤的心肌细胞caspase-3活性的影响(± s,n=6)Tab.2 Effect of Guanxin Suhe-containing serum on caspase-3 activity in primary cultured cardiomyocytes injured by H2O2(± s,n=6)
注:与阴性对照组相比,**P<0.01;与模型相比,##P<0.01;与空白血清组相比,▲▲P<0.01。
组 别 (OD诱导剂/OD阴性对照)/%阴性对照组100.0±0.00模型组 160.8 ±18.1**空白血清组 157.1 ±19.3**##冠心苏合低剂量组 140.4 ±17.3**##▲▲冠心苏合中剂量组 124.5 ±9.2**##▲▲冠心苏合高剂量组 118.9 ±11.6**##▲▲
表3 冠心苏合含药血清对H2O2损伤心肌细胞Bax和Bcl-2表达的影响(±s,n=6)Tab.3 Effect of Guanxin Suhe-containing serum on Bcl-2 and Bax expression in primary cultured cardiomyocytes injured by H2O2(±s,n=6)

表3 冠心苏合含药血清对H2O2损伤心肌细胞Bax和Bcl-2表达的影响(±s,n=6)Tab.3 Effect of Guanxin Suhe-containing serum on Bcl-2 and Bax expression in primary cultured cardiomyocytes injured by H2O2(±s,n=6)
注:与阴性对照组相比,**P<0.01;与模型组相比,##P<0.01;与空白血清组相比,▲P<0.05,▲▲P<0.01。
组 别 ABcl-2∶Aβ-actin ABax∶Aβ-actin阴性对照组1.21±0.04 0.73±0.03空白血清组 0.81 ±0.05**## 1.77 ±0.04**##模型组 0.70±0.02** 1.88±0.01**冠心苏合低剂量组 0.75±0.04**##▲▲ 1.62±0.02**##▲▲冠心苏合中剂量组 0.85±0.06**##▲▲ 1.59±0.02**##▲▲冠心苏合高剂量组 1.07±0.05**##▲▲ 1.37±0.03**##▲▲

图1 冠心苏合含药血清对H2O2损伤心肌细胞中Bax和Bcl-2表达的影响Fig.1 Effect of Guanxin Suhe-containing serum on Bcl-2 and Bax expression in primary cultured cardiomyocytes injured by H2O2
3 讨论
冠心苏合胶囊含有苏合香、冰片、乳香、檀香、青木香等,具有芳香开窍、理气止痛的功效[1],是治疗冠心病心绞痛、心肌梗死等疾病的验方。国内学者[2-4]对此多有研究。但关于该方是否具有抗心肌细胞凋亡的作用研究鲜有报道。
应用血清药理学方法其价值在于,一是克服了用中药制剂直接进行体外实验时,中药制剂本身的理化性质对实验的干扰;二是实验结果与在体实验有较好的一致性,不仅能反映中药母体药物及其可能的代谢产物的药理作用,而且还能反映可能药物诱导机体内源性成分所产生的作用,为从细胞分子水平研究中药药理学提供了新的手段[5]。
本实验采用心肌细胞为研究对象,根据心脏在氧化损伤过程中氧化增强反应的原理,选用H2O2诱导细胞损伤,以模拟细胞病理模型。H2O2浓度在0.1~1 mmol/L范围内就能引起培养的心肌细胞早期的生物化学改变 (LDH释放,MDA生成和细胞周期的改变)。采用MTT法观察冠心苏合含药血清对氧化损伤的心肌细胞存活率的影响,结果发现,冠心苏合各剂量组能使损伤心肌细胞的存活率显著上升,且具有明显的剂量相关性,此结果表明冠心苏合含药血清对心肌细胞过氧化损伤存在着明显的保护作用。
细胞凋亡最突出的特点是细胞凋亡起始于细胞核的改变,细胞核凋亡小体的形成即是细胞凋亡的主要形态学特征。本实验将不同浓度冠心苏合含药血清作用于H2O2损伤后的原代心肌细胞后,经Hoechst 33258染色后发现:H2O2损伤模型组可见到明显的凋亡细胞特征——细胞膜完整,细胞染色质断裂聚集,固缩,可见到凋亡小体,符从冠心苏合各剂量组凋亡小体随浓度增加而减少。
Bcl-2家族是调控细胞凋亡的基因家族中最受重视的,分为抑凋亡基因和促凋亡基因两类。基因转染的实验已证实,Bcl-2蛋白能阻止并能消除多因素介导的凋亡,说明Bcl-2基因处于凋亡调控的终末部分,其表达状态可决定细胞的生存与死亡。Bax可诱导细胞色素C的释放,激活caspase-3蛋白酶,引起细胞凋亡。细胞内Bax与Bcl-2的比例调节了凋亡的发生[7-8]。本实验结果发现,冠心苏合各剂量组可使模型损伤组细胞中Bcl-2水平上调,Bax水平下降,且呈现一定的剂量依赖性。由此可推测,冠心苏合含药血清可能是通过上调Bcl-2与Bax的比值,使Bax/Bax同二聚体减少对细胞凋亡起到抑制作用的。
在caspase家族成员中,caspase-3被认为是各种凋亡刺激因子激活的关键蛋白酶,是细胞凋亡下游的主要和关键执行者,是凋亡蛋白酶级联反应的必经之路[9-10]。本实验用不同浓度冠心苏合含药血清处理H2O2损伤后的心肌细胞后发现,冠心苏合含药血清可阻止caspase-3途径的激活,且呈一定剂量依赖性。
此外,CytoC、p-AKT/AKT、pERK/ERK等蛋白也可以从不同的通路验证凋亡的发生。硫氧还蛋白 (TRX)为细胞内重要的氧化还原调节分子之一[11],细胞缺氧时,TRX发生从胞浆到胞核的转位,故检测细胞裂解后悬液中TRX的表达也是探讨药物作用机制很好的指标。近年来文献资料显示,热休克蛋白家族在心肌缺血再灌注损伤中有良好的保护作用,可明显提高心肌细胞对缺血的耐受性,减少了心肌梗死的面积[12]。
[1]陈 锐.冠心苏合丸临床应用解析[J].中国社区医师报,2011,27(28):16.
[2]李春香,丁里玉,李 清,等.新冠心苏合滴丸抗大鼠急性心肌缺血的实验研究[J].中药新药与临床药理,2008,19(2):109-111.
[3]李贻奎,张金艳,李连达.冠心苏合丸原方及改进方对心肌细胞过氧化氢损伤的影响[J].中成药,2008,30(9):1279-1283.
[4]张金艳,李贻奎,李连达,等.冠心苏合丸系列组方对心肌梗死模型大鼠心肌细胞凋亡及凋亡相关基因表达的影响[J]. 中成药,2008,30(10):1528-1530.
[5]柯 玮,朱建华.中药血清药理方法学的研究概况[J].中国医药指南,2011,9(6):24-25.
[6]Irkin V,Joos S,Zornig M,et al.The role of Bcl-2 family members in tumorigenesis[J].Biochim Biophys Acta,2004,1644(2-3):229-249.
[7]Hideaki I,Takao K,Seiji K,et al.Microtubule inhibitor D-24851 induces p53-independentapoptotic cell death in malignant glioma cells through Bcl-2 phosphorylation and Bax translocation[J].Int J Oncol,2005,26(3):589-596.
[8]Wu Lixin,Gu Xianfeng,Chun Yizhu,et al.Protective effects of novel single compound,Hirsutine on hypoxic neonatal rat cardiomyocytes[J].Eur J Pharmacol,2011,650(1):290-297.
[9]Di Paola R,Mazzon E,Paterniti I,et al.Olprinone,a PDE3 inhibitor,modulates the inflammation associated with myocardial ischemia-reperfusion injury in rats[J].Eur J Pharmacol,2011,650(2-3):612-620.
[10]Zhang C L,Wu L J,Tashiro S,et al.Oridonin induces apoptosis of HeLa cells via altering expression of Bcl-2/Bax and activating Caspase-3/ICAD pathway[J].Acta Pharmacol Sin,2004,25(5):691-698.
[11]李小刚,罗开元,白 洁.硫氧还蛋白与肿瘤相关性的研究进展[J].中华临床医学实践杂志,2006,5(6):539-541.
[12]陈怀东,司忠义.热休克蛋白70心肌保护的研究进展[J].心血管病学进展,2010,31(2):312-315.
