骆驼蓬生物碱对银屑病模型小鼠的作用
2013-09-06曾灿丽马桂芝戴秀勇于富生王长虹
曾灿丽 马桂芝 滕 亮, 戴秀勇 于富生 王长虹
(1.新疆医科大学药学院,新疆乌鲁木齐 830011;2.新疆华圣元医药科技有限公司,新疆乌鲁木齐 830011;3.上海中医药大学中药研究所,中药标准化教育部重点实验室,上海 201203)
银屑病是一种以表皮过度增生和真皮慢性炎症反应为特征的常见皮肤病,自然人群的患病率约为2%,有逐年升高的趋势[1]。骆驼蓬是蒺藜科Zygophyllaceae骆驼蓬属Peganum植物骆驼蓬Peganum harmalaL.的全草及种子,植物资源丰富[2]。骆驼蓬种子主要含有生物碱类成分,具有抗肿瘤、抗阿尔茨海默病、抗糖尿病、抗凝血、镇痛、抗菌、抗原虫等多方面药理作用[3]。维吾尔医学理论则认为骆驼蓬种子具有清除异常黑胆汁和黏液质的功能[4]。
文献报道骆驼蓬生物碱具有较为明确的抗银屑病作用。刘锦莲等在临床上应用骆驼蓬总生物碱片内服治疗寻常型银屑病127例,结果表明骆驼篷总碱对银屑病显示出一定的治疗作用[5]。李宇晶等发现去氢骆驼蓬碱对细胞有丝分裂有明显的抑制作用,而且能使表皮颗粒层形成,促进表皮细胞正常分化[6]。本实验采用小鼠阴道上皮细胞有丝分裂模型和鼠尾鳞片颗粒层模型,同时对骆驼蓬总碱和去氢骆驼蓬碱单体抗银屑病药效进行比较研究,并对去氢骆驼蓬碱的量-效关系进行考察,为骆驼蓬治疗银屑病的研究提供实验基础。
1 材料
昆明小鼠,SPF级,体质量18~22 g,新疆医科大学实验动物中心提供,合格证号SCXK(新)2011-0004。
骆驼蓬总碱 (新疆华圣元医药科技有限公司提供,纯度>85%);盐酸去氢骆驼碱 (新疆华圣元医药科技有限公司提供,纯度>98%);1∶100 000牛皮癣软膏 (新疆医科大学第一附属医院药剂科,批号:110825);0.9%氯化钠注射液(西安京西双鹤药业有限公司,批号为110506377);苯甲酸雌二醇注射液 (天津金耀氨基酸有限公司,批号:1007051);秋水仙碱 (上海蓝季科技发展有限公司,批号:20110915)。
BS110S电子天平 (北京赛多利斯天平有限公司);S312-60数显恒速搅拌器 (上海梅颖浦仪器仪表制造有限公司);恒温水浴锅 (DK-S26型,上海精宏实验设备有限公司);徕卡DFC425数字显微镜 (徕卡测量系统股份有限公司)。
2 方法
2.1 骆驼蓬总碱乳膏和去氢骆驼蓬碱乳膏的制备取处方量的单硬脂酸甘油酯、凡士林、液体石蜡、司盘-80、氮酮、尼泊金乙酯混合后,水浴加热至79℃;另取吐温-80、十二烷基硫酸钠混合后加蒸馏水溶解,水浴加热至81℃。在搅拌状况下将水相缓缓加入油相,再加入与甘油研和后的骆驼蓬总碱或去氢骆驼蓬碱,保持转速不变,继续搅拌,冷却至室温即得含0.4%去氢骆驼蓬碱的骆驼蓬总碱乳膏和0.4%去氢骆驼蓬碱乳膏。空白乳膏基质制备除不加药物外,其他制备方法均相同。
2.2 骆驼蓬总碱与去氢骆驼蓬碱抗银屑病药效学比较
2.2.1 对小鼠增生上皮细胞有丝核分裂的影响参照有关文献[6-9]方法,将60只昆明种雌性小鼠随机分为6组,分别为正常组、模型组、乳膏基质组 (阴性对照)、牛皮癣软膏组 (阳性对照)、骆驼蓬总碱乳膏组和去氢骆驼蓬碱乳膏组。除正常组腹腔注射0.01 mL/g生理盐水外,其余各组均给予苯甲酸雌二醇0.01 mg/(g·d),连续3 d(3 d后隔天注射1次,至实验结束),使小鼠阴道上皮处于增生状态。除正常组和模型组给予生理盐水外,其余各组于第4天按软膏3.25 mg/(g·d)剂量分别灌注空白乳膏基质、牛皮癣软膏、骆驼蓬总碱乳膏和去氢骆驼蓬碱乳膏于小鼠阴道内,连续10 d。第14天末次给药1 h后给各组小鼠腹腔注射秋水仙碱2 mg/kg,使其细胞处于有丝分裂中期以便计数。5 h后处死小鼠,切取阴道组织以10%甲醛固定,石蜡包埋、切片、HE染色。在光镜下计数300个基底细胞的有丝分裂数,换算成100个基底细胞的有丝核分裂数 (有丝分裂指数),并对各组数据进行统计学处理。
2.2.2 对表皮分化 (颗粒层生成)的影响 参照文献 [6-8]方法,取50只昆明种小鼠,雌雄各半,随机分为5组,分别为正常组、乳膏基质组 (阴性对照)、牛皮癣软膏组 (阳性对照)、骆驼蓬总碱乳膏组和去氢骆驼蓬碱乳膏组。除正常组外,其余各组均按软膏0.2 mg/(g·d)涂抹小鼠尾部,连续14 d。末次给药结束后4 h处死小鼠,取距鼠尾根1~2 cm处大小约1.5 cm ×0.2 cm的皮肤,10%甲醛固定、石蜡包埋、切片、HE染色,在光镜下进行观察。凡是两个相邻的毛囊间表皮 (即鳞片表皮)具有连续的颗粒层细胞者称为有颗粒层的鳞片,计数每100个鳞片中有颗粒层的鳞片数,并对各组数据进行统计学处理。
2.3 去氢骆驼蓬碱抗银屑病的量效关系
2.3.1 对小鼠增生上皮细胞有丝核分裂的影响取70只昆明种雌性小鼠随机分为7组,即正常组、模型组、乳膏基质组 (阴性对照)、牛皮癣软膏组(阳性对照)、去氢骆驼蓬碱乳膏高、中、低剂量组 (0.6%、0.4%、0.2%)。其它操作同2.2.1项下方法。
2.3.2 对表皮分化 (颗粒层生成)的影响 取60只昆明种小鼠,雌雄各半,随机分为6组,即正常组、乳膏基质组 (阴性对照)、牛皮癣软膏组 (阳性对照)、去氢骆驼蓬碱乳膏高、中、低剂量组(0.6%、0.4%、0.2%)。其它操作同2.2.2项下方法。
3 结果
3.1 骆驼蓬总碱与去氢骆驼蓬碱抗银屑病药效学比较
3.1.1 对小鼠增生上皮细胞有丝核分裂的影响高倍光镜下观察小鼠阴道细胞的有丝分裂情况,结果见表1和图1。
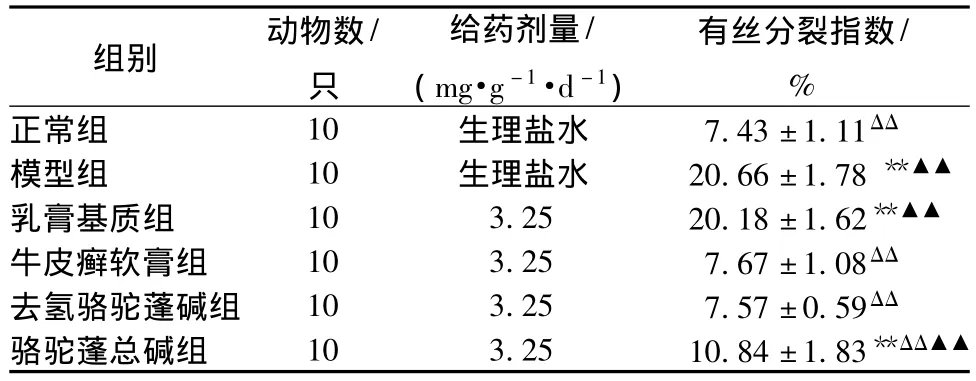
表1 不同实验药物组对小鼠阴道上皮细胞有丝分裂的影响Tab.1 Effects of different test drugs on vagina epithelium mitosis of model mice
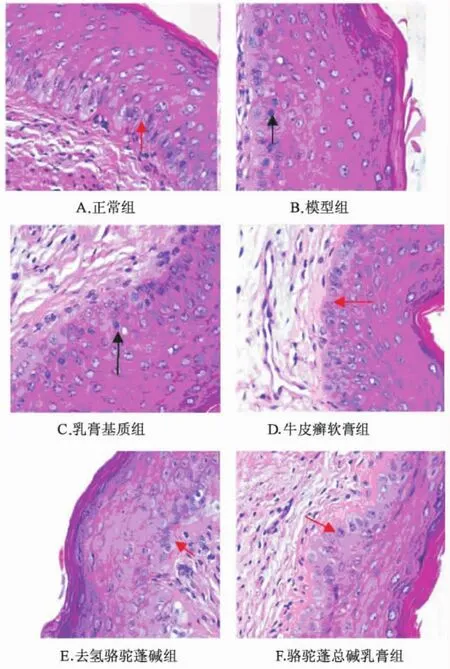
图1 不同药物组小鼠阴道细胞的有丝分裂病理学检查(×400)Fig.1 Histopathological results of vagina epithelium mitosis obtained from different test groups(×400)
病理学检查可见:正常组的阴道组织被覆分化良好的鳞状上皮,基底层偶见处于核分裂相的细胞;模型组小鼠的阴道上皮细胞呈多层,基底层细胞增生活跃,有较多细胞核浓缩深染,呈不规则的分裂或多核状态,体积增大;阳性组、骆驼蓬总碱和去氢骆驼蓬碱乳膏组的基底层处于核分裂相的细胞较模型组减少。与正常组比较,模型组、乳膏基质组、骆驼蓬总碱组小鼠阴道上皮细胞基底层细胞增生活跃 (P<0.01);与模型组比较,牛皮癣软膏组、去氢骆驼蓬碱、骆驼蓬总碱乳膏组均可显著抑制阴道上皮基底细胞的有丝分裂 (P<0.01);在此基础上,进行去氢骆驼蓬碱组和骆驼蓬总碱乳膏组与牛皮癣软膏组的比较,结果表明去氢骆驼蓬碱乳膏组的抑制作用与牛皮癣软膏组相比无统计学差异 (P>0.05),骆驼蓬总碱乳膏组的抑制作用与牛皮癣软膏组相比有统计学差异 (P<0.01)。
3.1.2 对表皮分化 (颗粒层生成)的影响 高倍光镜下观察小鼠尾部颗粒层生成情况,结果见表2和图2A~2E。病理学检查可见:正常组缺乏或仅有少量的颗粒层,牛皮癣软膏组、骆驼蓬总碱组和去氢骆驼蓬碱组颗粒层细胞均有不同程度的增加,促进表皮正常分化。与正常组相比,牛皮癣软膏组、去氢骆驼蓬碱和骆驼蓬总碱乳膏组均可显著促进小鼠尾部表皮分化 (P<0.01)。在此基础上,进行去氢骆驼蓬碱组和骆驼蓬总碱乳膏组与牛皮癣软膏组的比较,结果表明骆驼蓬总碱乳膏组对表皮分化的影响与牛皮癣软膏组相比无统计学差异 (P>0.05),去氢骆驼蓬碱乳膏组对表皮分化的影响与牛皮癣软膏组相比有统计学差异 (P<0.01)。

表2 不同实验药物组对小鼠鼠尾颗粒层细胞形成的影响Tab.2 Effects of different test drugs on the formation of granular layer in scale epidermis of mice tails
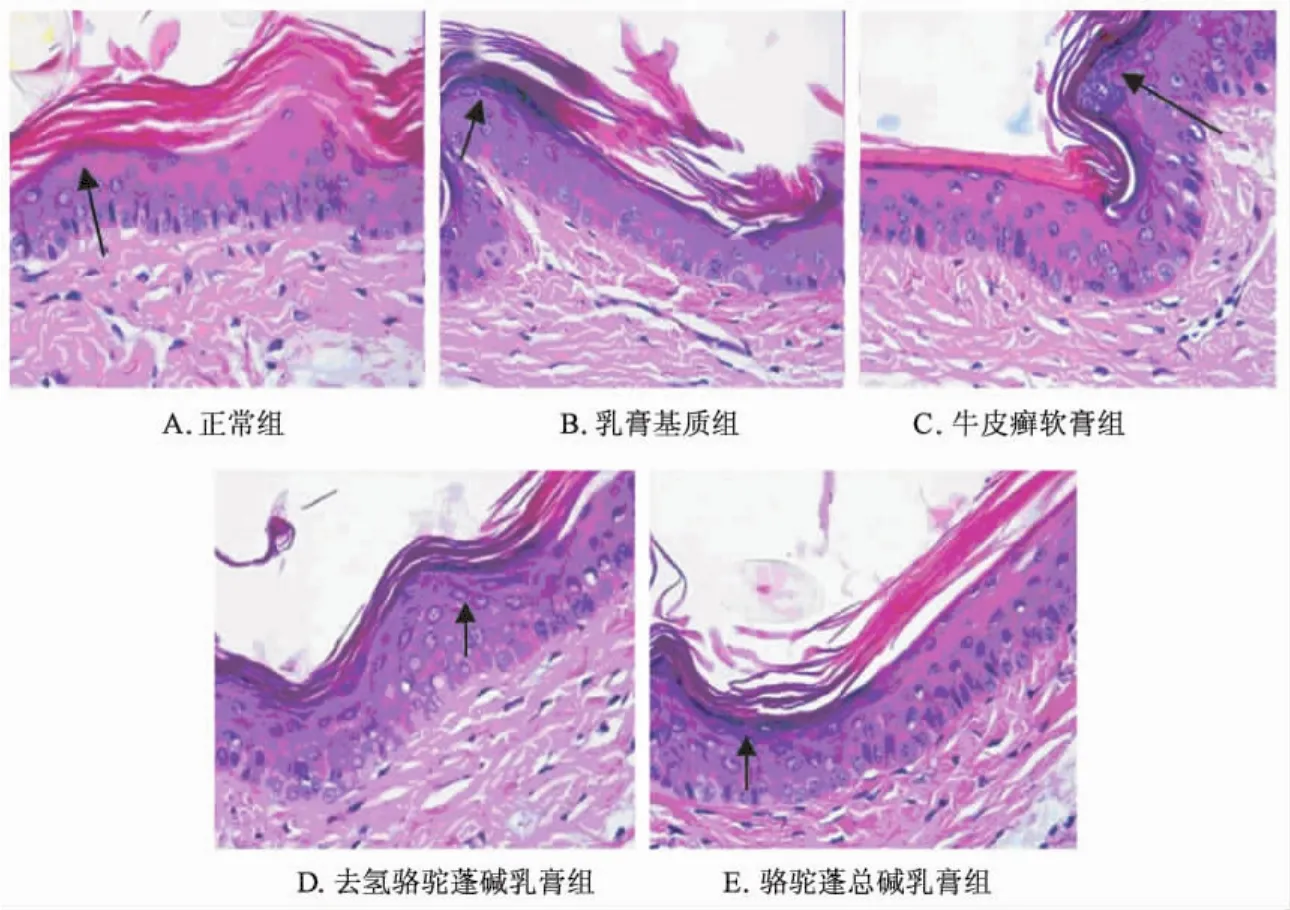
图2 不同试验药物组小鼠尾部颗粒层病理学检查 (×400)Fig.2 Histopathologic examination results of granular layer in scale epidermis of mice tails from different test groups(×400)
3.2 去氢骆驼蓬碱乳膏抗银屑病的量效关系
3.2.1 对小鼠增生上皮细胞有丝核分裂的影响高倍光镜下观察小鼠阴道细胞的有丝分裂情况,结果见表3和图3A~3C(正常组、模型组、乳膏基质组、牛皮癣软膏组结果参见图1A~1D)。病理学检查可见去氢骆驼蓬碱不同剂量组的基底层处于核分裂相的细胞较模型组均有较大程度较少。与正常组比较,模型组、乳膏基质组、0.2%去氢骆驼蓬碱乳膏组小鼠阴道上皮细胞基底层细胞增生活跃(P<0.01),牛皮癣软膏组、0.4%去氢骆驼蓬碱乳膏组小鼠阴道上皮细胞基底层细胞增生不明显(P>0.01),0.6%去氢骆驼蓬碱乳膏组小鼠阴道上皮细胞基底层细胞增生受抑制 (P<0.01);与模型组相比,牛皮癣软膏组、不同剂量的去氢骆驼蓬碱乳膏组均可显著抑制阴道上皮基底细胞的有丝分裂 (P<0.01);在此基础上,进行不同剂量的去氢骆驼蓬碱组与牛皮癣软膏组的比较,结果表明0.4%去氢骆驼蓬碱乳膏组的抑制作用与牛皮癣软膏组相比无统计学差异 (P>0.05),0.2%骆驼蓬总碱乳膏组、0.6%骆驼蓬总碱乳膏组的抑制作用与牛皮癣软膏组相比有统计学差异 (P<0.01)。结果提示,去氢骆驼蓬碱乳膏对小鼠增生上皮细胞有丝核分裂的影响呈现出明显的剂量依赖性。
3.2.2 对表皮分化 (颗粒层生成)的影响 高倍光镜下观察小鼠尾部颗粒层生成情况,结果见表4和图4A~4C(正常组、乳膏基质组、牛皮癣软膏组结果参见图2A~2C)。病理学检查可见去氢骆驼蓬碱不同剂量组的小鼠尾部颗粒层细胞较正常组均有较大程度增加。与正常组相比,牛皮癣软膏组、不同剂量的去氢骆驼蓬碱乳膏组均可显著促进小鼠尾部表皮分化 (P<0.01);在此基础上,进行不同剂量去氢骆驼蓬碱组与牛皮癣软膏组的比较,结果表明不同剂量去氢骆驼蓬碱乳膏组对表皮分化的影响与牛皮癣软膏组相比均有统计学差异(P<0.05),且0.6%去氢骆驼蓬碱乳膏组的促表皮分化作用优于牛皮癣软膏组 (P<0.01)。结果提示,去氢骆驼蓬碱乳膏对小鼠尾部颗粒层生成的影响呈现出明显的剂量依赖性。
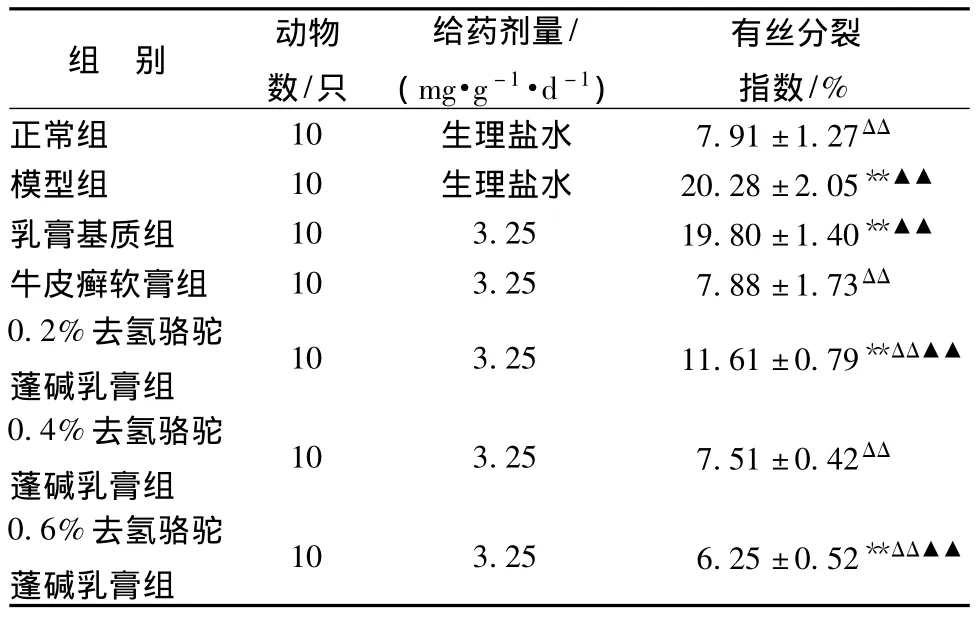
表3 不同剂量去氢骆驼蓬碱对小鼠阴道上皮细胞有丝分裂的影响Tab.3 Effects of harmin with different doses on vagina epithelium mitosis of model mice

图3 不同剂量去氢骆驼蓬碱乳膏组小鼠阴道上皮细胞有丝分裂病理学检查(×400)。Fig.3 Histopathological examination results of vagina epithelium mitosis of model mice from different dose groups(×400)

表4 不同剂量去氢骆驼蓬碱对小鼠鼠尾颗粒层细胞形成的影响Tab.4 Effects of harmine with different doses on the formation of granular layer in scale epidermis of mice tails
4 讨论
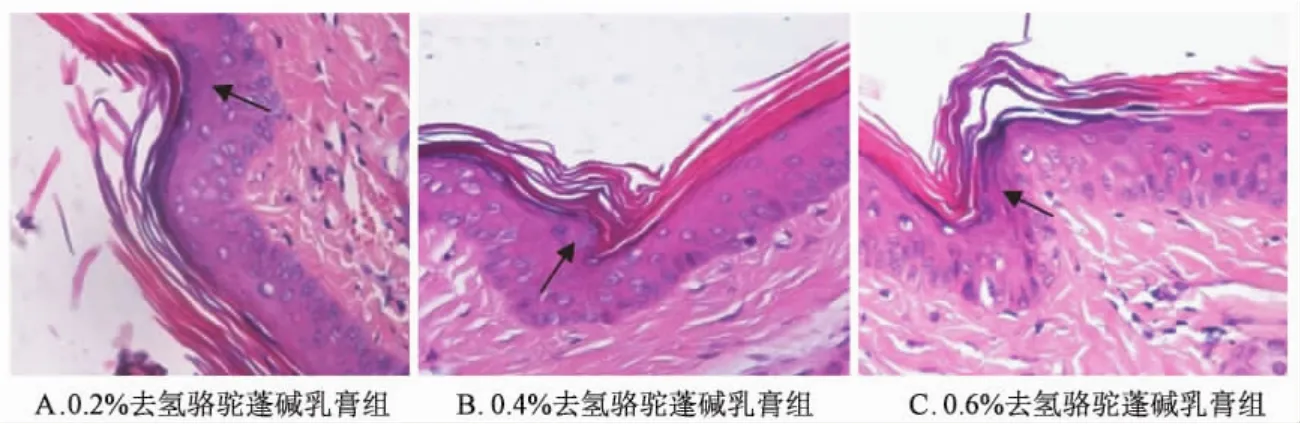
图4 不同剂量去氢骆驼蓬碱乳膏组小鼠尾部颗粒层病理学检查 (×400)Fig.4 Histopathological examination results of granular layer in scale epidermis of mice tails from different dose harmine groups
银屑病病因、发病机制目前仍不十分明确。维吾尔医学认为其病因多由在体内外各种不良因素影响下体液失衡,气质失调,碱性黏液质偏盛变成异常黑胆质,并凝结沉着于皮肤,损害局部所致[10]。银屑病的主要病理改变为表皮增殖过快、细胞有丝分裂数增加和角化不全。雌激素周期小鼠阴道上皮增生活跃模型模拟了人类银屑病表皮增生过快的特点,Van-Scott等[11]最早利用该模型评价了药物的抑制作用。小鼠鼠尾表皮天然缺少颗粒层,类似人类银屑病表皮分化障碍的病理改变,Spearmant等[12]和 Jarrett[13]最早用此模型评价了药物促进表皮正常分化的作用。这两种动物模型模拟了人类银屑病的某些病理生理改变,是国内外常采用的筛选抗银屑病药物的方法。
银屑病是一种免疫介导的疾病,免疫抑制药物治疗该病有效[1]。作为传统的医院制剂[14],牛皮癣芥子气软膏疗效明确[15]。该软膏在新疆医科大学第一附属医院应用多年,临床应用也证明其作用可靠。本实验以外用乳膏剂为药物给药载体,以牛皮癣芥子气软膏为阳性对照,采用两种动物模型考察了骆驼蓬总碱和去氢骆驼蓬碱对小鼠银屑病模型的作用。结果表明骆驼蓬总生物碱和去氢骆驼蓬碱对小鼠银屑病模型有较好的治疗作用。去氢骆驼蓬碱生物活性具有明显的剂量依赖性。
骆驼蓬生物碱对小鼠银屑病的作用可能与其多方面的药理作用相关:骆驼蓬生物碱对人类肿瘤细胞株具有广泛的细胞毒性[16],对直接参与细胞增殖、复制、基因表达的DNA拓扑异构酶Ⅰ[17]和Ⅱ[18]具有抑制作用;骆驼蓬生物碱能减轻免疫器官质量,具有抑制细胞免疫和体液免疫的作用[19];病理条件下,角质形成细胞可以分泌细胞因子、胺类、神经肽、神经生长因子、类罂粟碱和类花生酸等多种内源性致痒物质,刺激肥大细胞释放组胺或直接致敏皮肤C-神经纤维感受器诱发皮肤瘙痒。而骆驼蓬生物碱对磷酸组胺、五羟色胺引起的瘙痒均有抑制作用,有助于缓解银屑病所致瘙痒症状[20-21]。
给药剂量的准确性对于提高实验结果的可信度很重要。在小鼠阴道上皮细胞增殖活跃实验模型中,先依据小鼠体质量计算给药剂量,再采用注射器吸取药物至钝性管中,称质量,进行阴道灌注,利用减重法计算给药前后给药器的质量,以保证给药剂量的准确性。阴道给药时注意切勿弄伤小鼠,否则无法进行灌注。鼠尾表皮颗粒层的实验模型中各给药组尾部给药时要注意给药面积 (在距离小鼠尾根约0.5 cm,长约3 cm处涂抹一整圈)的一致性,同时利用减重法计算给药棉签给药前后的质量差以保证涂抹给药剂量的准确性。
[1]张广中,王 萍,李若瑜,等.银屑病流行病学研究进展[J].实用皮肤病学杂志,2008,1(4):247-249.
[2]王长虹,刘 军,郑立明,等.不同产地骆驼蓬不同药部位中生物碱的含量分析[J].中国药学杂志,2002,37(3):211-215.
[3]赵 婷,王长虹,王峥涛.骆驼蓬属植物中生物碱类化学成分及其药理活性研究进展[J].国际药学研究杂志,2010,37(5):333-339.
[4]中华人民共和国卫生部药典委员会.中华人民共和国卫生部药品标准 (维吾尔药分册)[S].新疆:新疆科技卫生出版社,1999:80.
[5]刘锦莲,郭学芝,刘得玺,等.驼蓬总碱治疗寻常型银屑病的疗效及电镜观察[J].中国皮肤病杂志,1991,5(3):141-142.
[6]李宇晶,陈蔚茹,王根厚.去氢骆驼蓬碱软膏对小鼠上皮细胞有丝分裂及表皮角化的影响[J].新疆医科大学学报,2000,23(1):8-9.
[7]田应彪,陈泽慧,袁 勤,等.复方莪术油乳膏治疗银屑病样动物模型作用研究[J].中药药理与临床,2009,25(3):57-59.
[8]谭梦晖,金若敏,庞惠芳,等.复方银屑颗粒治疗小鼠银屑病模型的实验研究[J].上海中医药大学学报,2008,22(2):48-49.
[9]施惠娟,周 茹,金少举,等.氧化苦参碱对银屑病小鼠模型血清中 IL-2、IL-10、TNF-α水平的影响[J].华西药学杂志,2010,25(4):418-420.
[10]依力哈木·买买提,海尔泥沙·黑提甫,热孜万·吾买尔.维吾尔医药治疗银屑病研究概况[J].中国民族医药杂志,2009(5):66-68.
[11]Van-Scott E J,Bonder R H.Intravaginal and intrarectal screening of antimitotic drugs for topical effectiveners[J].Invest Dermatol,1971,56(2):132-139.
[12]Spearman R I,Jarret A.Biological comparison of isomers and chemical forms of vitamin A[J].Br J Dermatol,1974,90(5):553-560.
[13]Jarret A.The physiology and pathophysiology of the skin[M].London,New York:Academic Press,1973:123.
[14]顾学裘.药物制剂注解[M].北京人民卫生出版社,1983,1040-1041.
[15]杨积顺,徐立平,胡晋红.芥子气软膏治疗豚鼠银屑病样皮损的作用机制[J].医药导报,2011,30(12):1562-1564.
[16]Jahaniani F,Ebrahimi S A,Rahbar-Roshandel N,et al.Xanthomicrol is the main cytotoxic component ofDracocephalum kotschyiiand a potential anti-cancer agent[J].Phytochemistry,2005,66(13):1581-1592.
[17]Sobhanim A M,Ebrahimi S A,Mahmoudian M.Anin vitroevaluation of human DNA topoisomeraseⅠinhibition byPeganum harmalaL.seeds extract and its β-carboline alkaloids[J].J Pharm Pharmaceut Sci,2002,5(1):19-23.
[18]王长虹,程雪梅,刘忠渊,等.骆驼蓬种子提取物及其β-咔保啉生物碱对DNA拓扑异构酶Ⅱ活性的抑制作用[J].中国临床药理学杂志,2008,24(5):422-425.
[19]边 棣,李观海,张洪泉.去氢骆驼蓬碱对小鼠免疫功能的影响[J].新疆医科大学学报,1987,(04):299.
[20]陈蔚如,张海丽,张 岩,等.去氢骆驼蓬碱在小鼠的抗炎镇痛及止痒作用[J].天津医药,2004,3(11):681-683.
[21]丁志荣,滕 亮,戴秀勇,等.盐酸去氢骆驼蓬碱乳膏处方筛选及其止痒药效学研究[J].中成药,2010,32(5):753-757.
