香蕉多糖的提取和色谱分析
2013-09-05张景强李清春张奇志邓焕英孙延一
张景强,李清春,*,张奇志,邓焕英,孙延一
(1.电子科技大学中山学院化学与生物工程学院,广东中山 528402;2.广东农工商职业技术学院,广东广州 510507)
香蕉多糖的提取和色谱分析
张景强1,李清春1,*,张奇志2,邓焕英2,孙延一1
(1.电子科技大学中山学院化学与生物工程学院,广东中山 528402;2.广东农工商职业技术学院,广东广州 510507)
摘 要:香蕉多糖的研究尚处于起步阶段,本文探讨了冷热交替处理、纤维素酶和果胶酶混合酶解处理等预处理技术对多糖得率影响,并以脱蛋白、透析等技术提高多糖纯度。采用提取工艺为:成熟香蕉→剥皮、切段→高温灭酶→粉碎打浆→冷处理(4℃~8℃,1 h)、热处理(40℃,20 min)→混合酶作用(48℃,2 h)→热水浸提(90℃,3h)→乙醇沉淀→脱蛋白→透析→低温真空干燥,制得的香蕉多糖纯度达到70.29%。以离子色谱仪分析香蕉多糖的水解液,数据显示组成香蕉多糖的单糖主要是阿拉伯糖、半乳糖、葡萄糖、木糖、甘露糖,它们的物质的量之比为0.11∶0.05∶0.67∶0.07∶0.10。
关键词:香蕉多糖;提取工艺;色谱分析
最新研究发现糖类在生物体中的作用不仅是作为能量资源或结构材料,更重要的是广泛地参与细胞识别、细胞生长、分化、代谢、胚胎发育、细胞癌变、病毒感染、免疫应答等细胞活动,具有多种多样的生物学功能[1]。其中,一些分子量在几千以上,具有很强生物活性的多糖更是现代医学和食品功能化学共同关注的焦点。多糖在自然界中分布很广,具有增强免疫功能、抗辐射、抗肿瘤、抗炎、降血糖等生物学活性,目前国内外对多糖的研究主要集中在药用植物多糖和真菌多糖,而对日常果蔬中的多糖研究相对较少[2]。
香蕉,属巴蕉科(Musaeae),巴蕉属(musa),为草木果树。我国香蕉资源丰富,年产量超800万t。香蕉作为常见的果实,其食用、药用价值极高,但目前对香蕉的研究开发主要集中在香蕉的生产和粗加工上,如加工成香蕉酒、香蕉饮料、香蕉干等,而其药用价值往往被忽略。香蕉中含糖量近20%,许多研究证明,香蕉多糖是香蕉的主要活性成分,具有免疫活性、抗氧化活性及抗肿瘤作用等[3-5],具有广阔的应用发展空间。本文研究了香蕉多糖的提取工艺,并对所得香蕉多糖进行了水解分析,为香蕉多糖的下一步应用打下了基础。
1 材料与方法
1.1 材料
香蕉:市售,皮上有少许黑点的成熟香蕉;纤维素酶、果胶酶:上海伯奥生物科技有限公司。
1.2 仪器
RE-300B0旋转蒸发器:上海亚荣生化仪器厂;GL-20C高速离心机:上海安亭科学仪器厂;BZF-30真空干燥箱:上海博迅实业有限公司;UV-Vis 2450紫外-可见分光光度计:日本岛津制作所;ICS-3000离子色谱分析仪:美国戴安公司。
1.3 实验方法
1.3.1 香蕉预处理
将香蕉剥皮、切成1 cm左右的小段,以高温蒸汽灭酶(105℃,10 min),以粉碎机打碎后制成的浆状样品作为对照样品备用;取适量浆状样品放入4℃~8℃冰箱中冷藏1 h,取出后在40℃水浴中保温20 min,得到冷热交替处理的样品。配制0.05%的纤维素酶和果胶酶的混合酶液(纤维素酶和果胶酶的质量比为1∶1),取适量冷热交替处理的样品,按照0.1%的质量比加入混合酶液,在48℃恒温下酶解2 h,得到混合酶处理的样品。
1.3.2 香蕉多糖的提取
在上述酶解作用后的香蕉浆中加入4倍体积水,在90℃水浴中回流浸提3h,过滤后残渣另用,所得滤液上旋转蒸发器浓缩至原体积的1/4,再加入4倍体积的无水乙醇,于4℃~8℃低温下过夜沉淀;离心(5 000 r/min,10 min)后所得沉淀,加少许水溶解后,再加入4倍体积的无水乙醇低温下过夜沉淀,离心后所得沉淀用丙酮脱水2次,于真空干燥箱中烘至恒重。所得多糖即为香蕉粗多糖。
1.3.3 脱蛋白处理
香蕉粗多糖中含有少量游离蛋白质,需要进行脱蛋白处理,分别以三氯乙酸、Sevag试剂(200 mL氯仿与40 mL正丁醇混合)、三氯乙酸+丁醇(200 mL三氯乙酸与10 mL正丁醇混合)来除去蛋白质。以多糖溶液在280 nm处的吸光度值来衡量脱蛋白的效果[6]。
1.3.4 透析处理
将透析袋剪成适当长度,煮沸10 min,以蒸馏水清洗后备用。将多糖浓缩液装入透析袋中,排除空气,用棉线扎口,悬挂在清水容器中,在低温4℃~8℃下用蒸馏水透析48 h。之后取出,在低温下真空干燥至恒重即得到香蕉多糖成品。
1.3.5 香蕉多糖含量的检测
采用苯酚-硫酸法检测香蕉多糖中的多糖含量[7]。
精确称葡萄糖(AR)1.000 0 g,溶解后,于 100 mL容量瓶中定容,配制成浓度为10 mg/mL的葡萄糖标准母液,分别取 1.25、2.50、3.75、5.00、6.25、7.50 mL 于25 mL容量瓶中,加水稀释至刻度,分别得到浓度为0.5、1.0、1.5、2.0、2.5、3.0 mg/mL 的葡萄糖标准溶液。
精确吸取上述各标准溶液2.00 mL于10 mL具塞比色管中,同时取2.00 mL蒸馏水作为空白,分别加入5%的苯酚溶液1.00mL,摇匀,迅速加入浓硫酸5.00mL,振摇5min,沸水浴加热15min后于冰水浴冷却10min,在波长489 nm下检测其吸光度值A,建立A~c标准曲线。
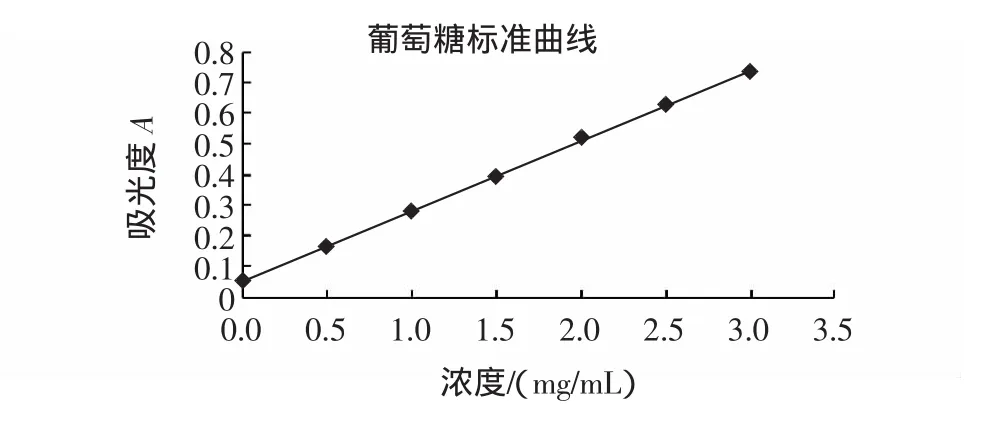
数据经回归处理得:A=0.2273c+0.0558,r=0.9996。
1.3.6 香蕉多糖的理化性质检测
精确称取香蕉多糖0.100 0g于100 mL容量瓶中,以蒸馏水定容至刻度,配成1 mg/mL浓度的香蕉多糖溶液。
1.3.6.1 碘-碘化钾反应
取1 mL上述多糖溶液,加入碘-碘化钾溶液,观察颜色变化。
1.3.6.2 茚三酮反应
取1 mL上述多糖溶液,加入0.5 mL 0.1%茚三酮乙醇溶液,混匀,煮沸1min~2min,冷却,观察颜色变化。
1.3.6.3 Molish反应
取1 mL上述多糖溶液,加入2滴Molish试剂即10%的α-萘酚的乙醇溶液,混合均匀后将试管倾斜45°,沿试管壁慢慢加入1 mL浓硫酸(勿摇动),竖立试管,观察浓硫酸和糖交界面颜色的变化。
1.3.7 香蕉多糖的水解
精确称取干燥好的香蕉多糖0.030 5 g,加入6.5%的硫酸20mL,在105℃下水解2.5h,水解液移入100mL容量瓶中,调pH至7.0,以蒸馏水定容至刻度。
1.3.8 香蕉多糖的离子色谱分析[8]
多糖水解产物上美国戴安公司的ICS-3000离子色谱仪进行分析。仪器条件为:脉冲安培检测器(PAD),AS40自动进样器,保护柱为CarboPacTM PA1 guard(2×50 mm),色谱柱为 CarboPacTM PA1 column(2×250mm)。淋洗液为100mmol/L的NaAC和2mmol/L的NaOH混合液,淋洗液流速为0.25 mL/min,进样量为50 μL;分析软件为变色龙6.8中文版。以峰面积(Peak area)值计算产物浓度。
2 结果与讨论
2.1 冷热交替处理对香蕉多糖提取的影响
将香蕉打浆,采取先冷藏后加热的交替处理可破坏细胞壁结构,有利于后续的浸提工艺来提取多糖。经冷热交替处理样品的多糖得率和多糖含量均优于对照样品,结果见表1。
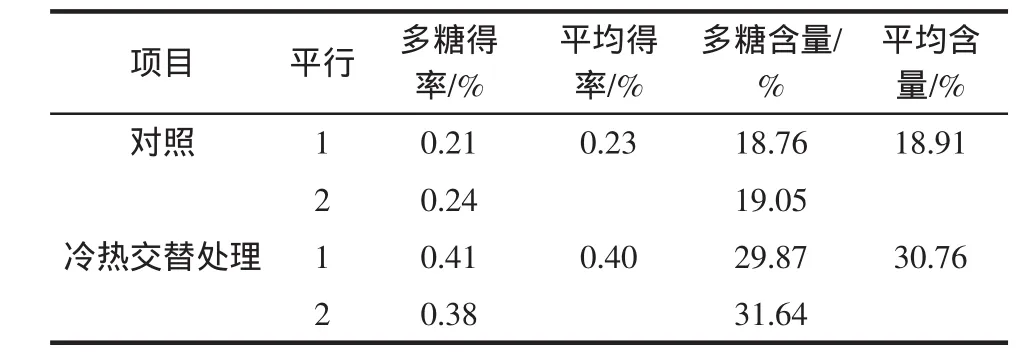
表1 冷热交替处理对香蕉多糖得率、含量的影响Table 1 Enhancement of yield&purity of banana polysaccharide by pretreatment alternating hot and cold
从表1可知,采用冷热交替的预处理后,香蕉多糖的得率从0.23%提高到0.40%,是对照处理样品的1.74倍;多糖含量从18.91%提高到30.76%,是对照处理样品的1.63倍。
2.2 混合酶处理对香蕉多糖提取的影响
香蕉细胞壁中含有大量纤维素和果胶质物质,会阻碍香蕉多糖的提取。通过纤维素酶和果胶酶组成的混合酶液的预处理,可以降解并破坏香蕉细胞壁网状结构,使细胞内容物最大限度地释放出来,从而大大提高香蕉多糖的得率。表2是采用混合酶处理对香蕉多糖得率和多糖含量的影响。
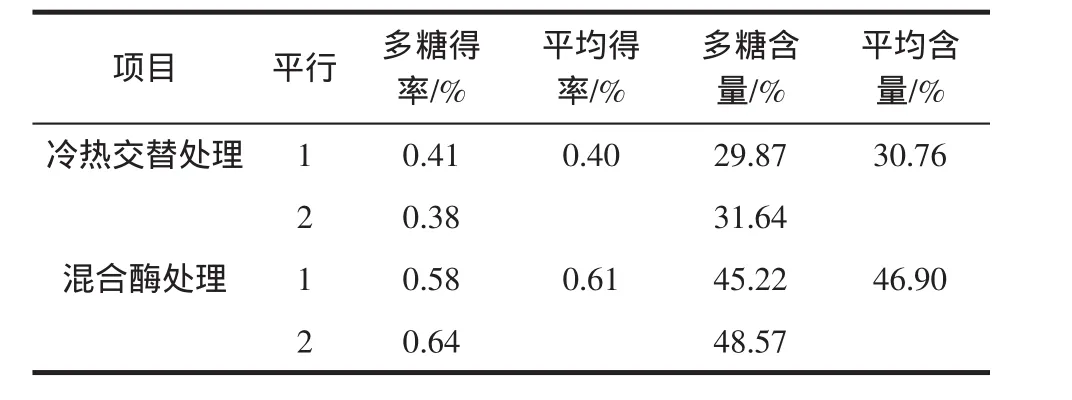
表2 混合酶处理对香蕉多糖得率、含量的影响Table 2 Enhancement of yield&purity of banana polysaccharide by mixed enzymes hydrolysis
从表2可知,在冷热交替的预处理的基础上,再采用混合酶预处理,香蕉多糖的得率和多糖含量进一步提高。其中香蕉多糖得率进一步从0.40%提高到0.61%,是冷热交替处理样品的1.53倍;多糖含量从30.76%提高到46.90%,是冷热交替处理样品的1.52倍。
综合表1和表2可知,冷热交替处理结合混合酶处理的预处理方式,可有效破坏细胞壁结构,大大提高香蕉多糖得率和多糖含量,其中香蕉多糖得率是对照样品的2.65倍,多糖含量是对照样品的2.48倍。
2.3 不同脱蛋白试剂的脱蛋白效果
三种脱蛋白试剂去除香蕉多糖中游离蛋白质的效果有较大差别,其中以三氯乙酸和正丁醇的混合液的去除效果最好,处理后的香蕉多糖含量达到62.43%,多糖溶液在280 nm处的吸光值很小,仅仅为0.102。
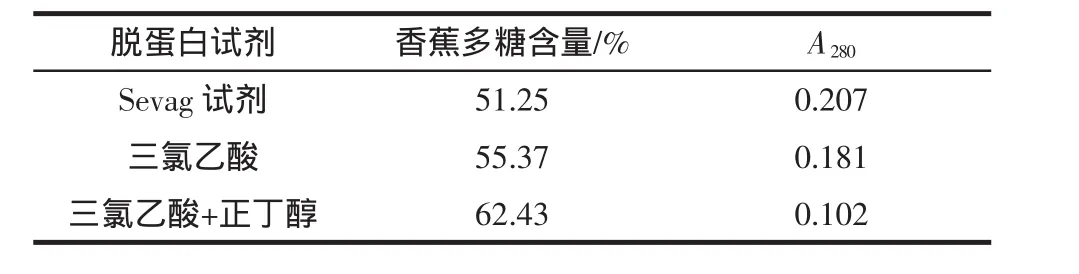
表3 不同脱蛋白试剂的处理效果Table 3 Effect of three deproteinized reagents
2.4 透析处理对香蕉多糖含量的影响
香蕉多糖的纯度越高,其生物活性作用越高。脱蛋白处理香蕉多糖纯度可达到62.43%,透析处理后,除去了其中的一些小分子杂质,多糖的纯度进一步提高。结果见图1。
图1中数据显示,透析48 h后样品中香蕉多糖含量可达到70.29%,比透析前提高了12.59%。
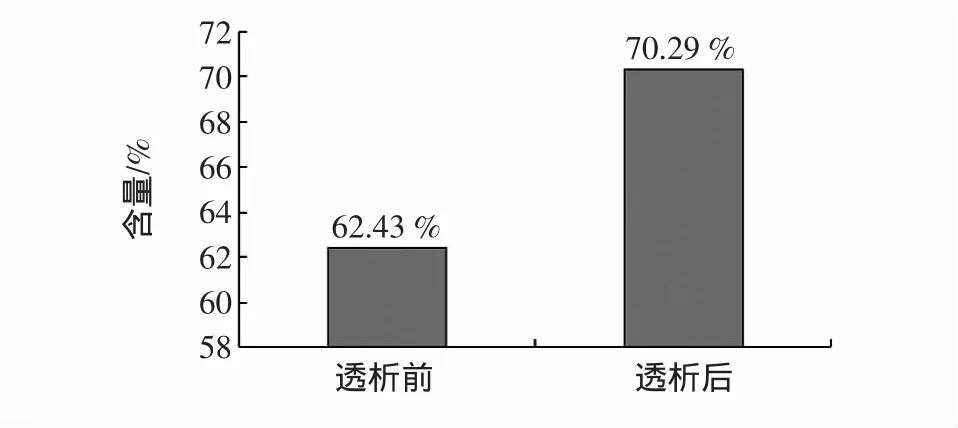
图1 透析前后香蕉多糖的含量Fig.1 Banana polysaccharide content before and after dialysis
2.5 香蕉多糖理化性质
分离纯化后的香蕉多糖易溶于水,不溶于乙醇、丙酮、乙醚、氯仿等有机溶剂。理化性质检测结果为苯酚-硫酸反应呈阳性,碘-碘化钾反应和茚三酮反应均呈阴性,说明样品中不含淀粉、氨基酸和蛋白。而Molish反应呈阳性,说明样品是非淀粉糖。因此,香蕉多糖经分离纯化后,纯度高,属于水溶性中性多糖。
2.6 香蕉粗多糖水解液的离子色谱分析
分别称取适量色谱纯的阿拉伯糖、半乳糖、葡萄糖、木糖、甘露糖,均配制成浓度为5 μg/mL的混合溶液,上离子色谱仪后得到以下色谱图2。同时,将处理好的香蕉多糖水解液也上离子色谱仪得到图3。

图2 五种标准单糖的离子色谱图Fig.2 Ion chromatogram of five standard monosaccharides
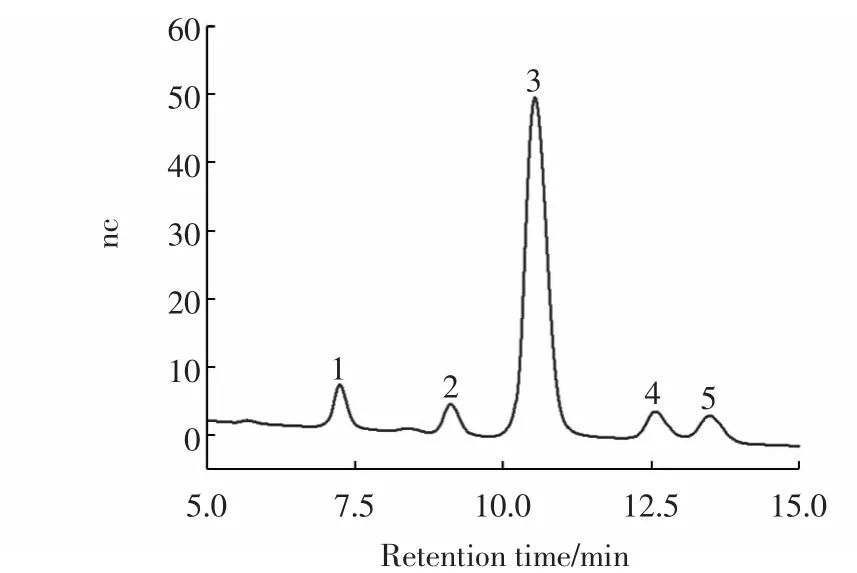
图3 香蕉多糖水解液的离子色谱图Fig.3 Ion chromatogram of hydrolyzate of banana polysaccharide
图2中各标准单糖的保留时间分别为:阿拉伯糖(7.267 min)、半乳糖(9.167 min)、葡萄糖(10.667 min)、木糖(12.700 min)、甘露糖(13.617 min)。
图3中香蕉多糖水解液的离子色谱图有5个峰,其保留时间分别为 7.233 min、9.117 min、10.533 min、12.567 min、13.483 min。与图2中标准单糖色谱峰比对,可知图3中的峰1为阿拉伯糖、峰2为半乳糖、峰3为葡萄糖、峰4为木糖、峰5为甘露糖。
通过峰面积定量计算可得,香蕉水解液中各单糖的浓度分别为:阿拉伯糖1.762 μg/mL、半乳糖0.995 μg/mL、葡萄糖 12.606 μg/mL、木糖 1.075 μg/mL、甘露糖1.829 μg/mL。香蕉多糖的组成为阿拉伯糖、半乳糖、葡萄糖、木糖、甘露糖等五种单糖,其物质量的比为 0.11∶0.05∶0.67∶0.07∶0.10。
3 结论
香蕉多糖的研究尚处于起步阶段,选择合适的香蕉多糖提取工艺可获得高纯度多糖。本文的提取工艺为:成熟香蕉→剥皮、切段→高温灭酶→粉碎打浆→冷处理(4℃~8℃,1 h)、热处理(40℃,20 min)→混合酶作用(48℃,2 h)→热水浸提(90℃,3 h)→乙醇沉淀→脱蛋白→透析→干燥得成品,本工艺所制得香蕉多糖纯度可达到70.29%。将香蕉多糖的水解液上离子色谱仪分析其组成可知,组成香蕉多糖的单糖主要是阿拉伯糖、半乳糖、葡萄糖、木糖、甘露糖,它们的物质的量之比为 0.11∶0.05∶0.67∶0.07∶0.10。
:
[1]刘杰超,焦中高,周红平,等.水果活性多糖的研究现状与展望[J].食品科学,2008,29(10):675-679
[2]郑宝东,郑金贵,曾绍校.果蔬多糖的研究现状及应用前景[J].食品科学,2003,24(1):152-155
[3]沈建林,何晓明.香蕉多糖的免疫活性研究[J].湖北职业技术学院学报,2004,7(3):79-81
[4]沈建林,沈红元.香蕉多糖的抗氧化活性研究[J].食品科技,2007(2):264-266
[5]熊燕飞,韩志红,刘欣,等.香蕉多糖的提取及抗肿瘤作用研究[J].中华实用中西医杂志,2005,18(2):261-263
[6]刘捷,张体祥,于立芹,等.红薯叶多糖的分离纯化及其结构鉴定[J].河南工业大学学报:自然科学版,2010,31(5):46-50
[7]贡济宇,于波,于澎.酚硫酸法测定灵芝多糖含量的实验研究[J].长春中医学院学报,2002,18(1):45
[8]Jian-Bin Shi,Qiu-Lin Yang,Lu Lin,et al.The strcutural changes of the bagasse hemicellulose during the cooking process involving active oxygen and solid alkali[J].Carbohydrate research,2012,359:65-69
The Extraction of Banana Polysaccharide and Chromatography Analysis
ZHANG Jing-qiang1,LI Qing-chun1,*,ZHANG Qi-zhi2,DENG Huan-ying2,SUN Yan-yi1
(1.College of Chemistry&Biology Engineering,University of Electronic Science and Technology of China Zhongshan Institute,Zhongshan 528402,Guangdong,China;2.Guangdong AIB Polytechnic College,Guangzhou 510507,Guangdong,China)
Abstract:The study on banana polysaccharide is still on its primary stage.In this paper, some pretreatments of extraction, such as cold&hot treatment, mixed enzymatic treatment (cellulase mixed with pectinase), were adopted to improve the yield of banana polysaccharide.At the same time, some purification technologies, such as deproteinization, dialysis bag, were adopted to enhance the purity of banana polysaccharide.The adopted extraction process is:ripe banana skinned&cut→ enzyme inactivation→ crushed&pulping→ cold treatment(4℃~8℃,1 h),heat treatment(40℃,20 min)→ mixed enzymatic treatment(48℃,2 h)→ extraction in hot water (90℃,3h)→ precipitation in ethanol solution→ deproteinization→ dialysis→ drying(cryogentic vacuum).The purity of obtained banana polysaccharide is as high as 70.29%.The hydrolysis solution of banana polysaccharide was analyzed by ion chromatograph.The results were showed that banana polysaccharide was mainly composed of arabinose,galactose,glucose,xylose and mannose,and their molar ratio was 0.11∶0.05∶0.67∶0.07∶0.10.
Key words:banana polysaccharide;extraction process;chromatography analysis
DOI:10.3969/j.issn.1005-6521.2013.14.021
广东省中山市科技计划项目(20103A249);电子科技大学中山学院科研启动基金项目(409YKQ07)
张景强(1974—),男(汉),讲师,博士,从事资源化学与食品分析研究。
李清春(1975—),女(汉),讲师,硕士,从事食品发酵与功能食品研究。
2013-02-17
