壳聚糖膜对体外培养大鼠软骨细胞增殖活性及分泌细胞外基质的影响
2013-09-05王卫星
麦 果,王卫星,贺 斌
(武汉大学人民医院,武汉 430060)
壳聚糖是广泛存在于自然界中的甲壳素衍生物,是由D-氨基葡聚糖与少量乙酰化氨基葡聚糖通过β(1-4)糖苷键连接形成的氨基葡聚糖类似物,其结构类似于透明软骨中的透明质酸、硫酸角质素等,并具有与他们类似的理化特性和生物学功能[1,2],同时具有良好的生物兼容性和生物可降解性[3]。已有研究表明,关节腔内注射壳聚糖可以促进软骨细胞增殖,增加软骨细胞密度[4];软骨细胞体外培养结果也表明,壳聚糖可以维持细胞表型,阻止软骨细胞因长时间体外培养和传代过多而出现的去分化现象[5]。因此,近年来新型生物材料——壳聚糖膜越来越受到广大学者的关注,但其能否促进软骨细胞增殖及分泌细胞外基质目前仍无相关报道。2011年3月~2012年5月,我们观察了壳聚糖膜对体外培养大鼠软骨细胞增殖及分泌细胞外基质的影响。现报告如下。
1 材料与方法
1.1 材料 健康SD大鼠30只,SPF级,雌雄不限,1月龄,体质量(100±20)g,由武汉大学医学部实验动物中心提供,许可证号:SYXK(鄂)2003_0013。DMEM/F-12培养基、胎牛血清,美国Gibco公司;胰蛋白酶、Ⅱ型胶原酶,美国 Sigma公司;Real-time PCR引物,美国Invitrogen公司;CCK-8试剂盒,日本Dojindo公司;Collagen-2、Aggrecan一抗,美国 Cell Signal公司;β-actin一抗,美国Santa Cruz公司;免疫组化试剂盒,武汉博士德生物公司。
1.2 方法
1.2.1 壳聚糖膜的制备 将壳聚糖粉溶于1.5%的乙酸溶液中,配制成浓度为2%的溶液,过滤,将定量液体倾注于不锈钢板上,60~70℃烘干取下,在1 mol/L的氢氧化钠溶液中浸泡2 h,再用蒸馏水洗涤至中性,自然干燥,贮存于无色硅胶干燥器中,以界面出现良好折光面为样品制备成功。
1.2.2 大鼠软骨细胞体外培养及分组 将SD大鼠引颈处死,取大鼠膝关节软骨组织,放入盛有DHanks液(含青—链双抗)的青瓶内,用PBS缓冲液漂洗3遍并去除组织上污染的血液。往青瓶内加入0.25%胰蛋白酶-0.02%EDTA消化液5 mL,然后用显微剪刀将髓核组织剪成1 mm×1 mm×1 mm大小的小碎块,吸入离心管中,置于37℃空气摇床中消化1 h。1000 r/min离心 5 min,弃上清,加入0.1% Ⅱ型胶原酶5 mL于无菌离心管内,37℃下消化4 h。1000 r/min离心5 min,弃上清,加入3 mL DMEM/F12(含10%FBS)细胞培养液,轻轻吹打细胞将细胞悬液吸入25 mL细胞培养瓶内,加入DMEM/F12(含10%FBS的 50 U/mL青霉素,50 μg/mL链霉素)培养基2 mL。将培养瓶置于37℃、5%CO2的培养箱中培养。培养72 h后首次换液,以后隔天换液1次。取对数生长期的传2代软骨细胞,随机分成4组:培养于6孔板细胞组、种植于壳聚糖膜细胞组、PBS处理组、壳聚糖膜浸出液处理组。
1.2.3 体外培养软骨细胞鉴定 取第2代培养软骨细胞爬片,4%多聚甲醛固定20 min,PBS洗涤3次,每次3 min。晾干后滴加正常山羊血清封闭液室温封闭20 min,晾干后滴加1∶150稀释的Ⅱ型胶原单克隆抗体,4℃孵育过夜,PBS洗涤3次,每次3 min。滴加生物素化二抗,37℃孵育20 min,PBS洗涤3次,每次3 min。滴加SABC试剂,37℃孵育20 min,PBS洗涤3次,每次5 min。滴加DAB显色剂,显微镜下观察控制显色情况。冲洗、脱水、封片,光镜下观察拍照。
1.2.4 CCK-8法检测软骨细胞的增殖情况 将各组细胞置于0.25%胰蛋白酶中消化,制成单细胞悬液,1000 r/min离心5 min,弃上清,用含有10%胎牛血清的DMEM/F12培养基调整细胞浓度为1×104/mL,接种于96孔板中。待细胞贴壁后采用无血清培养法培养24 h。培养于6孔板细胞组、种植于壳聚糖膜细胞组加入细胞培养基培养,PBS处理组、壳聚糖膜浸出液处理组分别加入PBS、壳聚糖浸出液,将培养细胞置于37℃培养箱中培养24 h,终止培养前2 h每孔加入CCK-8试剂20 μL,在酶标仪上检测450 nm波长下各孔的吸光度值,重复6次。
1.2.5 Real-time PCR检测软骨细胞分泌细胞外基质 将各组细胞培养24 h后提取RNA。使用Trizol法提取,将RNA溶于DEPC处理的无菌水中,测定RNA的浓度(A260/A280>1.8)以确保RNA的纯度。应用大连宝生物工程有限公司(TaKaRa)提供的RT试剂盒将提取的 mRNA逆转录为 cDNA。采用SYBR GreenⅠ染料进行标记,并通过ABI 7500 Real-time PCR系统对Ⅱ型胶原(Collagen-2)及聚集蛋白聚糖(Aggrecan)的表达进行分析,引物序列如表1所示。PCR反应条件为:95℃变性10 s,95℃ 5 s,循环40次后,60℃延伸30 s。然后得到标准曲线,在本实验中GAPDH作为内参,通过与内参的比较来得到各种基因的相对表达量。
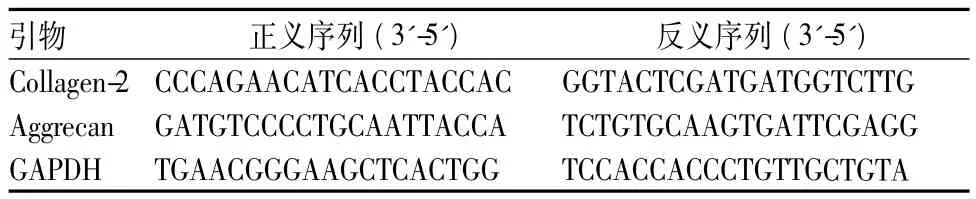
表1 荧光定量PCR引物序列
1.2.6 统计学方法 采用SPSS16.0统计软件,数据以表示,结果比较采用单因素方差分析。P≤0.05为差异有统计学意义。
2 结果
2.1 软骨细胞体外培养及鉴定 自大鼠膝关节软骨组织中分离培养的软骨细胞,培养72 h后细胞生长状态良好,可见细胞生长融合成片,形态呈铺路石或多角形外观。经Collagen-2免疫组化染色确定该细胞可分泌Collagen-2,确定为软骨细胞。见图1。
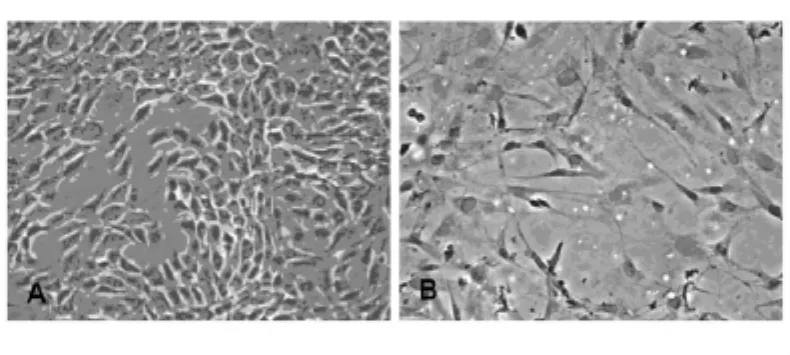
图1 软骨细胞形态及鉴定
2.2 壳聚糖膜对软骨细胞增殖的影响 与6孔板细胞组比较,种植于壳聚糖膜细胞组软骨细胞增殖活性明显增高(P<0.05),增殖活性增高55%。与PBS处理组比较,壳聚糖膜浸出液处理组软骨细胞增殖活性明显增高(P<0.05),增殖活性增高47%。见图1。
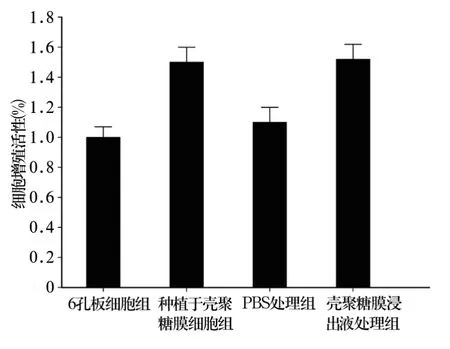
图2 壳聚糖膜对软骨细胞增殖的影响
2.3 壳聚糖膜对软骨细胞分泌细胞外基质的影响种植于壳聚糖膜细胞组、壳聚糖膜浸出液处理组软骨细胞分泌细胞外基质Collagen-2、Aggrecan的量较6孔板细胞组、PBS处理组明显增加(P均<0.05)。种植于壳聚糖膜细胞组软骨细胞分泌Collagen-2的量明显高于6孔板细胞组,分泌量约提高57%;壳聚糖膜浸出液处理组软骨细胞分泌Aggrecan的量明显高于PBS处理组,分泌量约提高44%。见图 3、4。
3 讨论
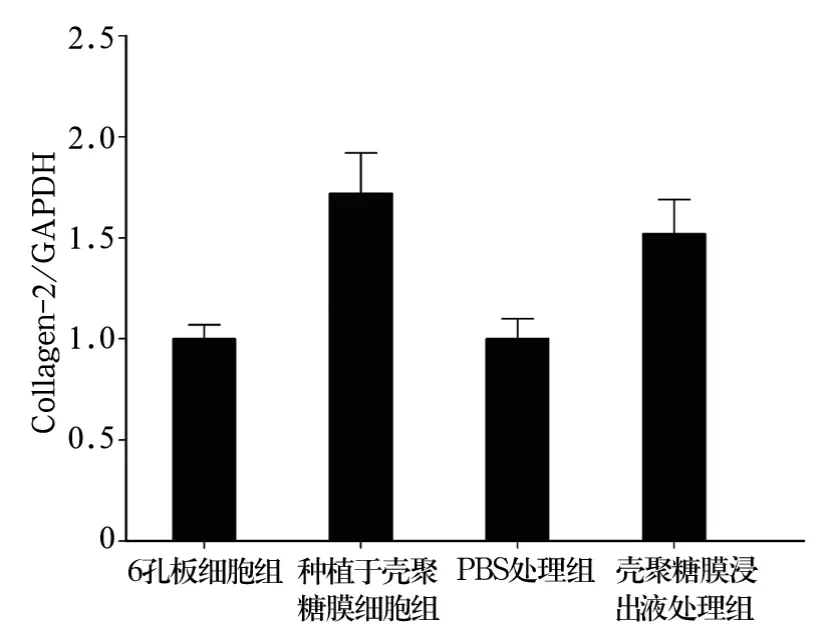
图3 壳聚糖膜对软骨细胞表达Collagen-2的影响
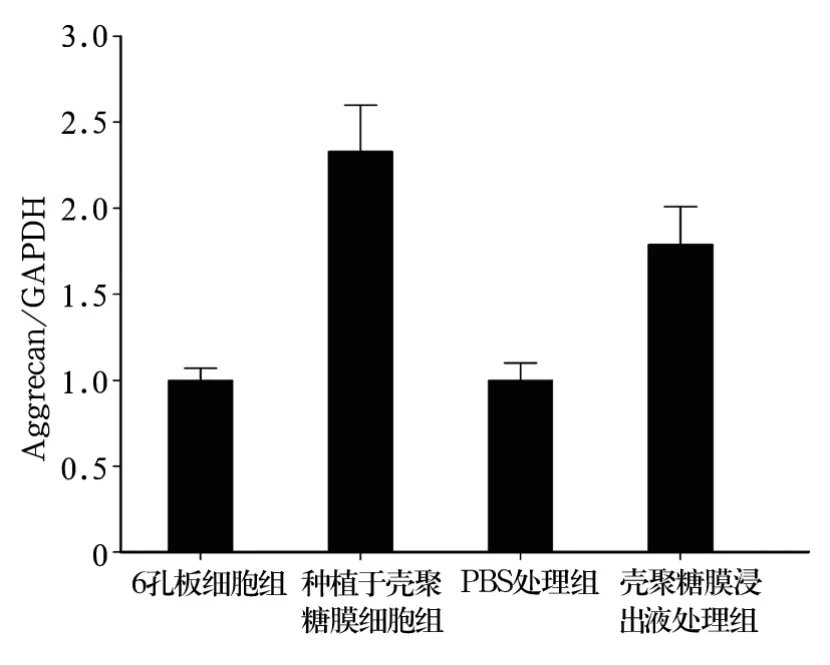
图4 壳聚糖膜对软骨细胞表达Aggrecan的影响
骨关节炎(OA)是骨科的常见病、多发病之一,其病因目前尚不明确。有研究表明,软骨细胞表型的改变在OA的发病中起着重要的作用,主要表现为软骨细胞分泌及增殖活性降低。正常软骨细胞的表型特点是细胞呈多边形,具有合成、分泌Ⅱ型胶原和蛋白多糖的能力。软骨损伤或病变后,由软骨细胞分泌细胞外基质发挥修复作用。而炎症刺激下的软骨细胞表型发生变化,部分细胞呈梭形改变,Ⅱ型胶原和蛋白多糖合成减少,Ⅰ型胶原合成增加,其分泌的细胞外基质不能达到正常软骨基质在组成及力学方面的要求,软骨纤维化,基质钙化,水分丢失,弹性下降,功能丧失,从而导致软骨修复失败。因此,稳定软骨细胞表型,促进细胞增殖及细胞分泌细胞外基质在OA的治疗中具有重要的意义。
近年研究发现,甲壳素及其衍生物材料具有良好的亲水性[6],特别是壳聚糖,由于完全脱去了乙酰基,亲水性很高,润湿性很好。润湿性越好、亲水性越高,与分子接触机会就越多,细胞在材料表明的附着也就越紧密、均匀,材料的界面结合就越好。壳聚糖具有很强的吸附能力,植入体内后在其表明形成由水分子、氨基酸、蛋白质及多种离子构成的水结构层,有利于细胞与材料的结合,并为黏附受体反应提供了许多位点。壳聚糖具有刚性骨架和较强的分子间氢键,使得大分子具有有序结构和三种晶体结构;同时也具有较多的侧位基团功能,可以在伯胺基、伯羟基、仲羟基上进行各种化学反应,也可以像纤维素一样进行酯化、醚化、氧化、磺化以及一系列铰链连接等反应。由于壳聚糖分子中存在一些游离的碱性-NH3基团,导致材料表面及其周围的pH偏碱性。在偏碱性的环境里,细胞酶的活性水平较高,细胞生长处于活跃状态,新生细胞增殖较快。因此,就可以使组织界面对细胞生长有利。
本研究结果表明,壳聚糖不仅能保证软骨细胞在膜上的正常生长,还能促进其增殖,证实了壳聚糖膜不仅具有良好的生物兼容性,还具有一定的生物活性。本研究还发现,壳聚糖膜渗出液可以促进体外培养软骨细胞增殖,并促进软骨细胞分泌软骨细胞细胞外基质Collagen-2与Aggrecan,而这2种大分子蛋白质是正常软骨细胞分泌的主要细胞外基质,壳聚糖膜可促进其分泌则表明壳聚糖膜对软骨细胞退变具有保护作用,这为将来壳聚糖膜应用于临床治疗OA提供了重要的实验依据。目前关于壳聚糖促进细胞增殖的原因与机制还不是很明确,有学者认为[7],壳聚糖因为结构特性与氨基葡聚糖相似,所以在功能上也与氨基葡聚糖相似。而氨基葡聚糖作为细胞外基质中重要的糖蛋白,在细胞附着、分化及形态发生中起着重要的作用。
综上所述,在体外培养条件下,壳聚糖膜可以显著促进软骨细胞增殖与分泌细胞外基质。
[1]Suh JK,Matthew HW.Application of chitosan-based polysaccharide biomaterials in cartilage tissue engineering:a review[J].Biomaterials,2000,21(24):2589-2598.
[2]Aiba SI.Studies on chitosan:6.Relationship between N-acetyl group distribution pattern and chitinase digestibility of partially N-acetylated chitosans[J].Int J Biol Macromol,1993,15(4):241-245.
[3]VandeVord PJ,Matthew HW,DeSilva SP,et al.Evaluation of the biocompatibility of a chitosan scaffold in mice[J].J Biomed Mater Res,2002,59(3):585-590.
[4]Lu JX,Prudhommeaux F,Meunier A,et al.Effect of chitosan on rat knee cartilage[J].Biomaterials,1999,20(20):1937-1944.
[5]Lahiji A,Sohrabi A,Hungerford DS,et al.Chitosan supports the expression of extracellular matrix proteins in human osteoblasts and chondrocytes[J].J Biomed Mater Res,2000,51(4):586-595.
[6]Piehler J,Brecht A,Geckeler KE,et al.Surface modification for direct immunoprobes[J].Biosens Bioelectron,1996,11(6-7):579-590.
[7]Muzzarelli R,Baldassarre V,Conti F,et al.Biological activity of chitosan:ultrastructural study[J].Biomaterials,1988,9(3):247-252.
