双碳源流加对重组毕赤酵母高效表达葡萄糖氧化酶的影响
2013-09-04沈伊娜顾磊张娟陈坚堵国成
沈伊娜,顾磊 ,张娟,陈坚,堵国成
1 江南大学 工业生物技术教育部重点实验室,江苏 无锡 214122
2 江南大学 粮食发酵工艺与技术国家工程实验室,江苏 无锡 214122
3 江南大学 生物工程学院,江苏 无锡 214122
巴斯德毕赤酵母Pichia pastoris是一种广泛应用的外源蛋白表达系统,目前已经有数百种外源蛋白及多肽在这个系统中得到了成功的表达,并进行了工业化生产[1-2]。葡萄糖氧化酶(β-D-glucose : oxygen 1-oxidoreductase ; EC 1.1.3.4,简称 GOD) 是一种富含糖基的黄素蛋白,它通过利用分子氧作为电子受体专一性催化β-D-葡萄糖生成葡萄糖酸和过氧化氢[3]。GOD是生物领域中最主要的工具酶之一,被广泛应用于食品、饲料、医药等行业中[3-4]。GOD大规模生产广泛采用黑曲霉或青霉发酵,然而青霉和黑曲霉发酵产生许多杂蛋白不利于下游提取,产酶量低也成为生产瓶颈,为了解决这些问题,近年来使用基因工程菌重组表达GOD受到研究人员的青睐[5-9]。周亚凤等[9]利用P. pastorisGS115表达载体成功地构建了 GOD高产甲基酵母工程菌株,GOD活力可达30~40 U/mL。Malherbe等[7]利用酿酒酵母为宿主,整合来自黑曲霉GOD基因,GOD最高产量为125 U/mL,是目前已报道的最高产量[3],但是仍然存在表达效率不高、产量低、酶活低等问题。
本研究室在前期的研究工作中,筛选了一株葡萄糖氧化酶高产菌株Aspergillus nigerBBE11721,扩增出其编码葡萄糖氧化酶的基因,并在P. pastorisGS115中成功表达。在此基础上为了提高GOD的产量和降低生产成本,本文进一步优化了发酵条件。
P. pastoris在以甲醇作为唯一碳源和能源表达外源目的蛋白时,细胞生长与蛋白表达争夺碳源和能源,增加了细胞的代谢负担,并导致表达效率低下[10-11]。如何提高表达效率以及降低甲醇对细胞的毒害作用,以进一步提高葡萄糖氧化酶的产量成为关键因素[12-13]。因此,本研究在详尽分析生物量和甲醇浓度对重组P. pastoris高效表达影响的基础上,通过甘油、山梨醇以及甘露醇和甲醇双碳源混合流加策略,来降低甲醇的毒害作用提高菌体密度,提高胞内启动子AOX1的表达效率和GOD生产强度,从而实现葡萄糖氧化酶的高效表达。
1 材料与方法
1.1 菌株
以P. pastorisGS115为宿主,整合来自Aspergillus nigerBBE11721的葡萄糖氧化酶(GOD) 基因 (拷贝数为5个),同时具有His+和Mut+表型,由本实验室构建并保藏于中国典型培养物保藏中心,保藏编号为 CCTCC No. M 2012266。
1.2 培养基
1.2.1 YPD活化培养基
葡萄糖20 g/L,蛋白胨20 g/L,酵母膏10 g/L。
1.2.2 分批发酵培养基(BSM)
85%磷酸 26.7 mL/L,CaSO4·H2O 0.93 g/L,K2SO418.2 g/L,MgSO4·7H2O 14.9 g/L,KOH 4.13 g/L,甘油 40.0 g/L,PTM1 4.35 mL/L[14]。
1.3 培养方法
1.3.1 摇瓶培养
活化后,挑单菌落接种于 50 mL YPD中(50 mL培养基/500 mL三角瓶),并于 30 ℃、200 r/min培养24 h。
1.3.2 补料高密度发酵培养
将YPD中菌液按10%接种量接入3 L全自动发酵罐 (LiFlus GM BioTRON,Korea) 中。以50%氨水和磷酸溶液控制pH 5.5,温度30 ℃,调节搅拌转速和通气量维持溶氧30%以上。当甘油耗尽 (DO迅速上升,且 DO>60%时),开始流加 50% (W/V)甘油 (含 12 mL/L PTM1)。当菌体达到一定浓度后 (60 g/L、80 g/L或100 g/L左右),停止补料。待甘油再次耗尽,继续保持基质匮乏状态约 1 h且 DO>60%后,开始流加100%甲醇或者流加甘油、山梨醇、甘露醇和甲醇以不同质量比混合的诱导培养基 (含12 mL/L PTM1),并且把诱导温度降低至22 ℃诱导GOD表达。发酵过程由发酵罐控制系统软件进行在线控制和数据采集[15]。
1.4 测定方法
1.4.1 菌体干重的测定
取10 mL发酵液置于离心管中,8 000 r/min离心10 min,弃上清液,将离心菌体置于105 ℃,烘至恒重,称量并计算菌体干重 (DCW,dry cell weight,单位为 g/L)。
1.4.2 葡萄糖氧化酶活性的测定
方法参见文献[16]。酶活力单位定义:在30 ℃,pH 6.0 的条件下,1 min 从 1 μmol的 β-D-葡萄糖氧化成D-葡萄糖酸和H2O2所需的酶量为1个葡萄糖氧化酶酶活力单位,以 U/mL表示。
1.4.3 甘油浓度的测定
方法参见文献[17]。
1.4.4 甲醇、山梨醇、甘露醇浓度的测定
甲醇残留浓度采用流加检测仪测定与控制器 (FC2002,East China University of Science and Technology)。山梨醇、甘露醇采用高效液相色谱(HPLC) 法,应用Agilent 1100高效液相色谱仪进行测定。色谱柱为 Aminex HPX-87H(Bio-Rad);流动相:0.005 mol/L H2SO4;流速:0.6 mL/min;柱温:35 ℃;进样量:5 μL;检测器:示差折光检测器。
1.4.5 醇氧化酶(AOX)活力测定
方法参见文献[18]。酶活力单位 (1 U/g) 定义为:在一定菌体浓度下,37 ℃、pH 6.0的条件下,每分钟产生1 μmol的过氧化氢所需的酶量。
2 结果与分析
2.1 诱导前初始菌体浓度对GOD表达的影响
在大多数情况下,胞外重组蛋白的分泌同细胞浓度的增长趋势大致相同,所以高密度发酵是P. pastoris表达外源蛋白的普遍策略。
基于前期摇瓶优化结果,维持诱导阶段的甲醇浓度为18 g/L,不同菌体浓度对GOD表达的影响如图 1所示。当诱导前初始菌体浓度为60.5 g/L时,诱导156 h GOD产量仅为243.3 U/mL,干重为121 g/L。增加菌体浓度到101.6 g/L时,诱导156 h GOD产量达427.6 U/mL,比菌体浓度为60.5 g/L和83.8 g/L (310 U/mL) 时分别提高了75.8%和37.9%。在诱导初期,当P. pastoris利用的碳源从甘油转换到甲醇时,需要先由细胞合成一系列与甲醇代谢途径相关的酶[19],菌体浓度较大则含核糖体比较多,更有利于甲醇代谢途径关键酶的合成[20],从而能快速代谢甲醇,诱导GOD更高效地表达。
2.2 甲醇浓度对GOD表达的影响
甲醇的浓度对P. pastoris异源蛋白的表达量有一定的影响,最适的甲醇浓度需要根据不同的异源蛋白进行确定。

图1 诱导初始菌体浓度对GOD表达的影响Fig. 1 Effect of initial cell concentration on GOD production (A) and biomass (B) in the induction phase.
维持诱导前初始菌体浓度为100 g/L左右,不同甲醇浓度 (12、18和30 g/L) 对GOD表达的影响如图2。当甲醇浓度为18 g/L时,干重为179.2 g/L,GOD产量为427.6 U/mL,比甲醇浓度为 12 g/L (322.9 U/mL) 和 30 g/L (195.9 U/mL),分别提高了 32.4%和 118.3%。体系中过高的甲醇浓度可能使细胞“中毒”,并裂解或死亡而释放的胞内蛋白酶[1]导致了重组蛋白 GOD降解;或者是由于过高的甲醇浓度抑制了甲醇代谢和其他代谢途径关键酶的活性[21],从而影响菌体产酶。甲醇浓度不足则可能难以启动AOX1基因,不能充分诱导外源基因表达。因此,在一定的菌体浓度下,只有在合适的甲醇诱导强度下,才能使P. pastorisGS115高效表达GOD。
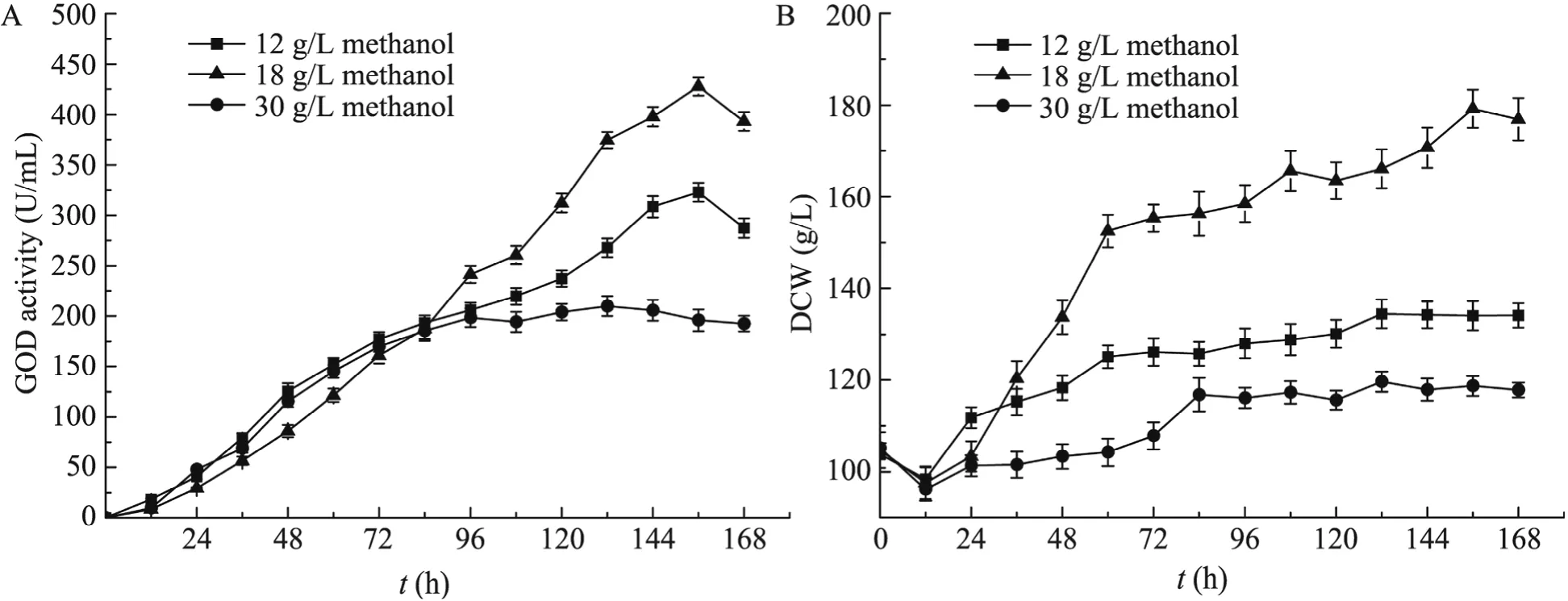
图2 甲醇浓度对GOD表达的影响Fig. 2 Effect of methanol concentration on GOD production (A) and biomass (B) in the induction phase.
2.3 诱导阶段的双碳源流加策略
2.3.1 甘油和甲醇的混合流加策略
甘油是P. pastoris最容易吸收利用的碳源,在诱导期加入少量甘油可以提高细胞活力,增加菌体密度和比生长速率,从而提高单位体积外源蛋白的产量[22-24]。
维持诱导前初始菌体浓度为 100 g/L,甲醇残留浓度18 g/L,甲醇与甘油以不同的比例 (0、20∶1 (W/W)、20∶2 (W/W)、20∶4 (W/W)) 混合添加对产酶的影响,结果如图3A所示。当甲醇与甘油混合添加的比例为20∶2 (W/W) 时,效果最为明显,GOD产量可达547.3 U/mL,比对照(427.6 U/mL) 提高了28.0%。而当甲醇与甘油混合添加的比例为20∶4 (W/W) 时,体系中测出甘油存在少量累积,GOD的产量也和对照组相近。体系内过量的甘油限制了AOX1启动子,从而影响外源基因的表达以及外源蛋白的比生产速率[25]。因此,甘油和甲醇以合适的比例混合添加虽然可以提高GOD产量,但对其残留浓度控制要求较高,不利于大规模发酵。
2.3.2 山梨醇和甲醇的混合流加策略
与甘油不同,山梨醇是一种不会抑制AOX1启动子的碳源[23-25],体系内残余的山梨醇不会对AOX1启动子产生抑制,而且山梨醇的存在可以有效减轻由于外源蛋白大量表达对细胞代谢造成的负担,减少高浓度甲醇对细胞的毒害作用,并且增加碳源和能量供应,提高菌体密度,从而提高外源蛋白表达量和比生产速率,并能降低产热和耗氧速率,更有利于P. pastoris大规模高密度的发酵[26]。
本研究采用山梨醇和甲醇的双碳源混合流加策略,即在诱导期采用甲醇和山梨醇混合添加(0、20∶1 (W/W)、20∶2 (W/W)、20∶4 (W/W)),诱导期 GOD的产量结果如图 3B所示。当甲醇和山梨醇混合比例为20∶2 (W/W),发酵156 h,GOD的产量为 645.3 U/mL,比对照提高了50.9%。而当甲醇和山梨醇混合比例为 20∶4(W/W) 时,GOD产量仅为440 U/mL,可能当山梨醇添加量较多时改变了发酵体系的渗透压,也有可能虽然蛋白质的合成率提高了,但此时内质网的折叠能力会接近饱和,因此新合成的蛋白质无法正确折叠,会在内质网中积累或者在胞内被分解,加重了细胞的代谢负担[27-28],影响菌体生长和发酵产酶。由此可见,当甲醇和山梨醇以合适的比例混合流加时,能显著增加GOD的产量。
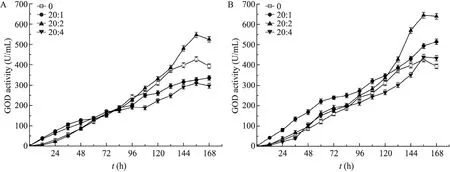
图3 甘油、山梨醇与甲醇混合添加的发酵过程曲线Fig. 3 GOD production under the mixed carbon feeding strategy in the induction phase. (A) Glycerol co-feeding.(B) Sorbitol co-feeding.
2.3.3 甘露醇和甲醇的混合流加策略
甘露醇是山梨醇的同分异构体,也是一种非抑制性碳源[26],但是在P. pastorisMut+表型的报道很罕见。
本实验研究了甲醇和甘露醇 (0、40∶1(W/W)、20∶1 (W/W)、20∶2 (W/W)) 混合添加对P. pastorisGS115 Mut+产GOD的影响,诱导期的生物量、GOD产量结果如图 4所示。当甲醇与甘露醇混合添加比例为20∶1 (W/W),诱导156 h时,GOD的产量和菌体密度为 711.3 U/mL和219.9 g/L,比甲醇单一流加策略下分别提高了66.3%和22.7%,同时比酶活为62 613 U/g,比对照 (54 845 U/g) 提高了14.2%。由此可见甘露醇和山梨醇一样,不会影响菌体对甲醇的利用效果,同时也能提高菌体密度,显著增加了 GOD的产量和增强了其生产强度。
2.3.4 双碳源混合流加对GOD生产的综合比较
表1比较了在诱导期3种不同的碳源和甲醇混合添加对发酵重要指标的影响。在诱导期通过甘油、山梨醇以及甘露醇和甲醇的混合流加均增加了菌体密度、比生长速率和 GOD比酶活,从而提高单位体积GOD产量。当甲醇与甘露醇混合添加时GOD产量最高,达到711.3 U/mL,比添加山梨醇时提高了10.2%,比添加甘油时提高了30.0%,比对照提高了66.3%。甘露醇与甲醇的混合添加也显著增强了 GOD的生产强度,诱导156 h生产强度为4.60 U/(mL·h),是添加山梨醇的1.1倍,是添加甘油时的1.3倍,是对照的1.7倍。与单碳源和甘油相比,添加甘露醇和山梨醇的比产酶速率也有所提高。采用合适双碳源混合流加策略可以提高菌体密度,增加单位体积外源蛋白的产量,使GOD的产量大幅度提高。同时甘露醇的添加量比山梨醇和甘油少,甲醇消耗减少的幅度也是比较大的,这非常有利于P. pastoris大规模发酵,在提高GOD产量同时也降低产热及好氧速率[26],降低生产成本。

图4 甘露醇与甲醇混合添加的发酵过程曲线Fig. 4 Course of biomass (■), residual methanol concentration (○), GOD production (▲) and residual mannitol concentration (●) under the different mannitol co-feeding strategy in the induction phase. (A) Methanol: mannitol=0.(B) Methanol: mannitol=20:1.

表1 不同流加方式下细胞生长和GOD合成过程参数比较Table 1 Comparison of parameters for GOD production under different mixed carbon sources during the induction phase
2.3.5 不同碳源对胞内AOX酶的影响
Jungo等[27]提出 AOX醇氧化酶的合成受不同的碳源影响较大。P. pastoris的外源蛋白表达受AOX1启动子调控,AOX醇氧化酶是甲醇代谢途径中第一个关键酶,它受甲醇的诱导启动,受碳源葡萄糖和甘油的阻遏[29]。然而山梨醇、甘露醇与甘油不同,它们是不会对胞内启动子AOX1造成抑制的碳源,即发酵体系内的山梨醇和甘露醇不会抑制AOX醇氧化酶的表达[23-25]。
通过测定AOX酶活性,结果如图5所示。我们发现在诱导前期,当流加甘露醇 (20∶1(W/W)) 山梨醇 (20∶2 (W/W)) 以及甲醇单一流加策略下时,AOX酶活性均急剧增加,在60 h时达到最大值,分别为8.8 U/g、8.2 U/g和5.2 U/g。由此可见,在诱导初期甘露醇、山梨醇等碳源以合适的比例与甲醇混合流加时,AOX醇氧化酶活性并没有受到抑制,甚至分别比甲醇单一流加情况下提高了69.2%和57.7%,从这里初步推断,在诱导前期甘露醇和山梨醇的存在可能在一定程度上减轻了由于大量表达外源蛋白对细胞代谢造成的负担——降低产热和好氧速率并且增加碳源和能量供应[26],从而提高了AOX1启动子的表达效率,加快了甲醇氧化途径的代谢,进而增加了GOD产量。而当流加甘油 (20∶2,W/W)时,由于发酵体系中甘油的积累,在诱导 48 h之前AOX酶活性均受到抑制,表达效率不高。
在诱导中后期,不同混合碳源流加时的AOX酶活性差异不大,均先以相似的速度急剧下降,诱导96 h之后稳定在一定范围内。初步推断可能是因为发酵体系内残余甲醇浓度是一定的,但由于诱导表达中后期生物量的不断快速增加而导致甲醇诱导不足,AOX1基因表达效率不高致使中后期AOX酶活性降低;也可能是因为甲醇长时间的诱导对细胞产生了毒害作用,同时抑制了甲醇代谢和其他代谢途径关键酶的活性[30],即细胞整体活力不足而导致对甲醇的代谢速率减慢,以致中后期AOX醇氧化酶活性降低。

图5 混合碳源流加对胞内醇氧化酶 (AOX) 的影响Fig. 5 Intracellular AOX activity under mixed carbon sources feeding strategies in the post-induction phase.
3 结论
甲醇诱导阶段GOD酶活随着诱导初始菌体浓度的增加而增加,并且在一定菌体浓度条件下,过高或者过低的甲醇浓度均不利于GOD生产。当诱导阶段初始菌体浓度为 100 g/L,维持体系中甲醇浓度 18 g/L,GOD产量最高为427.6 U/mL。
采用合适的双碳源混合流加策略可以增加菌体密度,提高GOD的产量。尤其山梨醇和甘露醇是属于对AOX1启动子的非抑制性碳源,能显著增强醇氧化酶的活力,提高外源蛋白生产强度和表达效率,同时减少甲醇消耗。
其中,甘露醇与甲醇混合添加的效果最为显著,GOD产量最高能达711.3 U/mL,是同类文献报道最高水平的6倍,实现了葡萄糖氧化酶的高效生产。
研究过程中发现由于3 L发酵罐的限制,对于诱导初始菌体浓度的增加有一定影响,在以后大规模发酵中可以对其进行进一步优化,以及如何提高中后期AOX醇氧化酶的活力和进一步提高GOD的产量等是我们以后研究的方向。
[1]Patrick SM, Fazenda ML, Harvey LM, et al.Heterologous protein production using thePichia pastorisexpression system. Yeast, 2005, 22(4):249−270.
[2]Cereghino JL, Cregg JM. Heterologous protein expression in the methylotrophic yeastPichia pastoris. FEMS Microb Rev, 2000, 24(1): 45−66.
[3]Bankar SB, Bule MV, Singhal RS, et al. Glucose oxidase-an overview.Biotechnol Adv, 2009, 27(4):489−501.
[4]Zakhartsev M, Momeu C. Purification of glucose oxidase from complex fermentation medium using tandem chromatography.J Chromatogr B, 2007,858(1/2): 151−158.
[5]Crognale S, Pulci V, Brozzoli, et al. Expression ofPenicillium variabileP16 glucose oxidase gene inPichia pastorisand characterization of the recombinant enzyme. Enzyme Microb Technol,2006, 39(6): 1230−1235.
[6]Park EH, Shin YM, Lim YY, et al. Expression of glucose oxidase by using recombinant yeast.J Biotechnol, 2000, 81(1): 35−44.
[7]Malherbe D, Toit M, Cordero Otero RR, et al.Expression of theAspergillus nigerglucose oxidase gene inSaccharomyces cerevisiaeand its potential applications in wine production.Appl Microbiol Biotechnol, 2003, 61(5−6): 502−511.
[8]Yamaguchi M, Tahara Y, Nakano A, et al.Secretory and continuous expression ofAspergillus nigerglucose oxidase gene inPichia pastoris.Protein Expres Purif, 2007, 55(2): 273−278.
[9]Zhou YF, Zhang XE, Liu H, et al. Cloning and expression ofAspergillus nigerglucose oxidase gene in methylotrophic yeast. Chin J Biotech, 2001,17(4): 400−405 (in Chinese).
周亚凤, 张先恩, 刘虹, 等. 黑曲霉葡萄糖氧化酶基因的克隆及其在酵母中的高效表达. 生物工程学报, 2001, 17(4): 400−405.
[10]Xie J, Zhou Q, Du P, et al. Use of different carbon sources in cultivation of recombinantPichia pastorisfor angiostatin production.Enzyme Microb Technol, 2005, 36(2−3): 210−216.
[11]Guo MJ, Chu J, Zhuang YP, et al.Carbon source metabolism analysis for recombinantPichia pastorisin chemostat based on oxygen and carbon balances. CIESC J, 2003, 54(12): 1724−1728 (in Chinese).
郭美锦, 储炬, 庄英萍, 等. 基于氧碳平衡的重组巴氏毕赤酵母碳源代谢分析. 化 工 学 报,2003, 54(12): 1724−1728.
[12]Inan M and Meagher MM. Non-repressing carbon sources for alcohol oxidase (AOX1) promoter ofPichia pastoris. J Biosci Bioeng, 2001, 92(6):585−589.
[13]Wang ZH, Wang Y, Zhang DX, et al. Enhancement of cell viability and alkaline polygalacturonate lyase production by sorbitol co-feeding with methanol inPichiapastorisfermentation.Bioresour Technol, 2010, 101(4): 1318−1323.
[14]Zhang WH, Sinha J, Smith LA, et al. Maximization of production of secreted recombinant proteins inPichia pastorisfed-batch fermentation. Biotechnol Prog, 2008, 21(2): 386−393.
[15]Lee CY, Lee SJ, Jung KH, et al. High dissolved oxygen tension enhances heterologous protein expression by recombinantPichia pastoris. Process Biochem, 2003, 38(8): 1147−1154.
[16]Gao ZW. Codon optimization and high level expression inPichia pastorisof glucose oxidase[D].Chongqing: Southwest University, 2010.
郜赵伟. 葡萄糖氧化酶基因密码子优化及其在毕赤酵母中的高效表达[D]. 重庆: 西南大学,2010.
[17]Zhang YS, Gao H, Wang YP. Determination of glycerol content in clavulanic aci broth by Spectrophotometry. J Tianjin Univ Sci Technol,2006, 21(1): 15−17 (in Chinese).
张永生, 高辉, 王艳萍. 克拉维酸发酵液中碳源−−甘油含量的比色法测定. 天津科技大学学报,2006, 21(1): 15−17.
[18]Suye SI, Ogawa A, Yokoyama S, et al. Screening and identification ofCandida methanosorbosaas alcohol oxidase producing methanol using yeast.Agric Biol Chem, 1990, 54: 1297−1298.
[19]Hu G, Guo MJ, Chu J, et al. Analysis of key enzymes in metabolic pathways of recombinantPichia pastoris(MutS) at transition phase. J East Chin Univ Sci Technol, 2004, 1: 392−397.
[20]Wang Y, Wang Z, Du GC, et al. Enhancement of alkaline polygalacturonate lyase production in recombinantPichia pastorisaccording to the ratio of methanol to cell concentration. Bioresour Technol, 2009, 100(3): 1343−1349.
[21]Sreekrishna K, Brankamp RG, Kropp KE, et al.Strategies for optimal synthesis and secretion of heterologous proteins in the methylotrophic yeastPichia pastoris. Gene, 1997, 190(1): 55−62.
[22]Zhang W, Potter KH, Plantz BA, et al.Pichia pastorisfermentation with mixed-feeds of glycerol and methanol: growth kinetics and production improvement. J Ind Microbiol Biotechnol, 2003,30(4): 210−215.
[23]Jungo C, Marison I, Von Stockar U. Mixed feeds of glycerol and methanol can improve the performance ofPichia pastoriscultures: A quantitative study based on concentration gradients in transient continuous cultures. J Biotechnol, 2007,128(4): 824−837.
[24]Jungo C, Schenk J, Pasquier M, et al. A quantitative analysis of the benefits of mixed feeds of sorbitol and methanol for the production of recombinant avidin withPichia pastoris. J Biotechnol, 2007, 131(1): 57−66.
[25]Files D, Ogawa M, Scaman CH, et al. APichia pastorisfermentation process for producing high-levels of recombinant human cystatin C.Enzyme Microb Technol, 2001, 29(6/7): 335−340.
[26]Ramón R, Ferrer P, and Valero F. Sorbitol co-feeding reduces metabolic burden caused by the overexpression of aRhizopus oryzaelipase inPichia pastoris. J Biotechnol, 2007, 130(1): 39−46.
[27]Jungo C, Rerat C, Marison IM, et al. Quantitative characterization of the regulation of the synthesis of alcohol oxidase and of the expression of recombinant avidin in aPichia pastorisMut+strain.Enzyme Microb Technol, 2006, 39(4): 936−944.
[28]Zhu T, You L, Gong F, et al. Combinatorial strategy of sorbitol feeding and low temperature induction leads to high level production of alkaline β-mannanase inPichia pastoris. Enzyme Microb Technol, 2011, 49(4): 407−412.
[29]Zhang H, Loovers HM, Xu L, et al. Alcohol oxidase (AOX1) fromPichia pastorisis a novel inhibitor of prion propagation and a potential ATPase. Mol Microb, 2009, 71(3): 702−716.
[30]Hartner FS, Glieder A. Regulation of methanol utilisation pathway genes in yeasts. Microb Cell Factories, 2006, 5: 1−21.
