酵母表面展示脂肪酶合成己二酸二异辛酯
2013-09-04张娜金子林影郑穗平韩双艳
张娜,金子,林影,郑穗平,韩双艳
华南理工大学生物科学与工程学院,广东 广州 510006
己二酸二异辛酯 (Diisooctyl adipate,DIOA)的热稳定性及低温性能好、闪点高、粘度指数高、挥发性低,是具有良好生物降解性能及良好润滑性能的绿色润滑油基础油[1]。利用化学催化剂和传统加热方法合成 DIOA,反应温度较高,物料容易氧化,催化剂自身也容易溶解或分散于物料中,得到的产品存在颜色深、酸值高、品质低等问题[2]。
采用脂肪酶作为催化剂,具有专一性与选择性较好,反应条件温和,产品质量好等优点。近年来,国内外已有一些用脂肪酶合成己二酸酯的研究[3-4]。其中,商品化脂肪酶反应效率高,易于回收,但价格昂贵。利用酵母表面展示技术,外源脂肪酶可借助锚定于细胞壁的载体蛋白固定在酵母细胞表面,类似于酶的固定化[5]。但酿酒酵母表面展示酶存在反应时间长、效率低的问题[5]。采用毕赤酵母能够高效地表达外源蛋白,且其高密度发酵工艺成熟,易得到大量展示有CALB的酵母细胞,经过冷冻干燥或喷雾干燥即可作为生物催化剂进行使用[6]。
本研究采用实验室自制的表面展示 CALB的毕赤酵母细胞为催化剂合成DIOA,初步探索该合成反应的最优工艺条件。
1 材料与方法
1.1 材料
酵母表面展示脂肪酶为本实验室自制[8]。己二酸二异辛酯购于西格玛奥德里奇 (上海) 贸易有限公司,其他试剂均为市售分析纯试剂。
1.2 方法
1.2.1 酵母表面展示脂肪酶的制备
按照文献[7]进行。
1.2.2 酵母表面展示脂肪酶和底物的水活度预平衡
按照文献[8]进行。
1.2.3 酯化反应及产率的计算
所有反应均在恒温振荡摇床中进行,首先以一定的摩尔比将己二酸和异辛醇加入 50 mL具塞三角瓶中,再加入一定体积的有机溶剂,充分混和后加入一定质量的酵母表面展示脂肪酶,在特定的温度下反应48 h,摇床转速为200 r/min。用气相色谱测定酯化反应的产率。反应初速度的计算及200 mL的放大反应按照文献[11]进行。

1.2.4 气相色谱分析
采用安捷伦 7890A气相色谱仪 (氢火焰离子检测器,DB-FFAP毛细管柱)。分析条件:载气 (氮气) 流速20 mL/min,干燥空气流速400 mL/min,氢气流速 30 mL/min。柱温设定采用程序升温:100 ℃维持 1 min,然后分别以 20 ℃/min升温至160 ℃维持2 min,再以80 ℃/min升温至 240 ℃维持5 min。进样器温度250 ℃,检测器温度为300 ℃。采用外标法测定酯的含量,每个样品重复测定3次。
1.2.5 减压蒸馏
采用旋转蒸发仪,设定压力为60 mmHg,油浴温度100 ℃,转速100 r/min,蒸馏20 min。
2 结果与分析
2.1 溶剂对己二酸二异辛酯产率的影响
脂肪酶的催化活性和催化特异性与溶剂的性质有关,通常有机溶剂的log P越大,脂肪酶的合成活性和稳定性越高。当溶剂log P<2,溶剂极性较强,易夺取酶分子的必需水,从而影响酶的分子构象,造成酶的失活[9]。
不同log P值的有机溶剂体系对酵母表面展示脂肪酶合成DIOA的影响见表1。结果表明,当溶剂log P在3.5~5.1这个范围内时,DIOA的产率较高。综合考虑溶剂的毒性及后续产品纯化难度,选择正庚烷为合成DIOA的溶剂。
2.2 醇酸摩尔比对己二酸二异辛酯产率的影响
适当提高异辛醇的添加量,有利于反应平衡向生成DIOA的方向移动。酸醇摩尔比对反应的影响如图1所示,可知醇酸摩尔比为3.5∶1时,酵母表面展示脂肪酶合成DIOA的产率达到最高,酸醇摩尔比继续提高,DIOA产率基本不变,但将提高生产成本和产物分离的难度。因此,异辛醇和己二酸的最优摩尔比为3.5∶1。
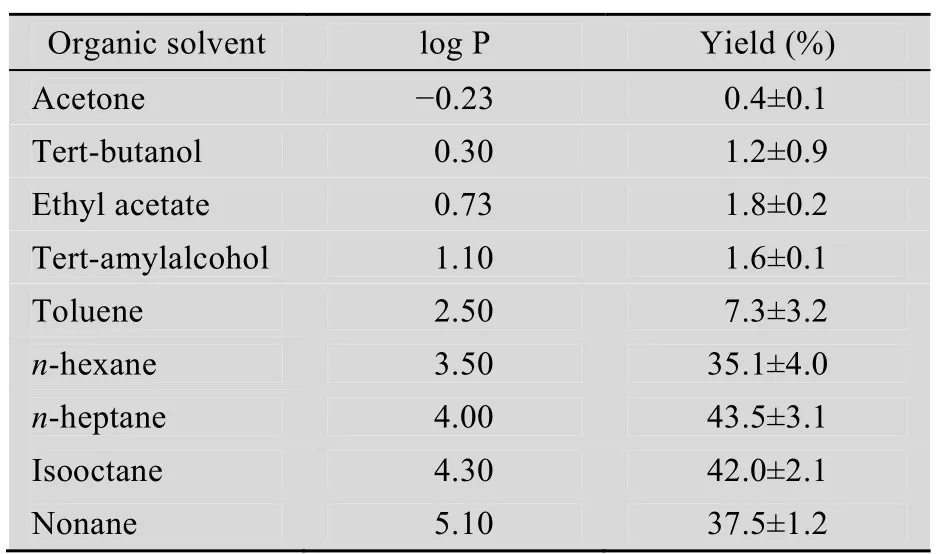
表1 溶剂对DIOA产率的影响Table 1 Effect of different organic solvents on yield of DIOA
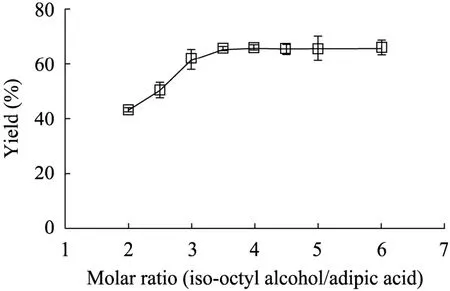
图1 底物醇酸摩尔比对DIOA产率的影响Fig. 1 Effect of the initial mole ratio of iso-octyl alcohol to adipic acid on yield of DIOA. Reaction conditions:adipic acid 0.2 mol/L, 0.3 g displayed lipases, 0.6 g molecular sieve, 55 ℃.
2.3 底物浓度对己二酸二异辛酯产率的影响
底物浓度对酯化反应的影响由图2所示,DIOA产率先随着底物浓度的增加而增大,当己二酸浓度增加到0.2 mol/L时,产率达到最大值,己二酸浓度继续增加,产率则呈现下降趋势。因此该反应的最优己二酸浓度为0.2 mol/L。
2.4 酶量对己二酸二异辛酯产率的影响
对于酶促反应,提高酶的添加量,可使酶与底物接触的机率增加,提高催化速度。但当酵母表面展示脂肪酶的添加量过大时,容易造成细胞聚集,阻碍底物与酶活性位点的接触[10]。从图3可知,以毕赤酵母展示脂肪酶作为催化剂催化合成DIOA,其最优添加量为0.4 g。

图2 底物浓度对DIOA产率的影响Fig. 2 Effect of different adipic acid concentration on yield of DIOA. Reaction conditions: molar ratio of iso-octyl alcohol to adipic acid fixed to 3.5:1, 0.3 g displayed lipases,0.6 g molecular sieve, 55℃.
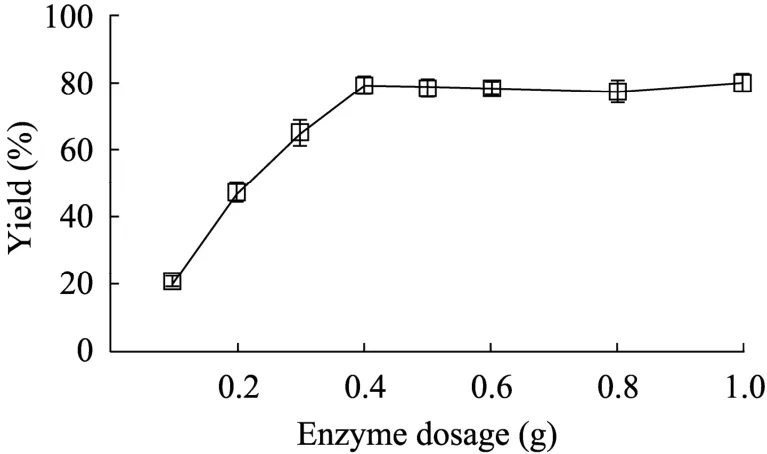
图3 酵母表面展示脂肪酶浓度对DIOA产率的影响Fig. 3 Effect of the concentration of lipase on yield of DIOA. Reaction conditions: adipic acid 0.2 mol/L, molar ratio of iso-octyl alcohol to adipic acid fixed to 3.5: 1, 0.6 g molecular sieve, 55 ℃.
2.5 水活度对己二酸二异辛酯产率的影响
微量的水分在维持酶结构和构象方面起着重要的作用。可使酶分子有足够的“柔性”,处于催化作用所必需的构象状态[11]。
由表2可知,经MgCl2饱和溶液 (aw=0.33) 处理后的酵母表面展示脂肪酶合成 DIOA的产率最高,可能是由于该水活度条件下,酶分子处于催化作用所必需的最佳构象。而水活度过高,会导致细胞聚集影响传质。
2.6 分子筛对己二酸二异辛酯产率的影响
水是酯化反应中的副产物,反应体系中水的积累不利于反应向合成DIOA的方向进行。因此,应将多余的水从反应体系中除去。本研究采用分子筛作为脱水剂,其成本低且易于分离和回收。分子筛添加量对己二酸二异辛酯产率的影响如图4所示,则该反应最优的分子筛添加量为0.8 g。
2.7 反应温度对己二酸二异辛酯产率的影响
温度是酶催化反应的重要影响因素,可以影响酶的活性、稳定性以及反应的热力学参数[12]。在不同温度下进行酯化反应,结果如图5所示,当反应温度由50 ℃升高到70 ℃,反应初速度也随之提高,可能是较高的温度有利于分子扩散。反应48 h时,DIOA的产率随着温度的升高而增加,55 ℃时达到最高产率85.0%,当温度超过55 ℃,DIOA的产率开始下降,可能是由于较高的温度造成了酶的部分失活[8]。因此反应最佳温度为55 ℃。

表2 酵母表面展示脂肪酶的水活度对DIOA产率的影响Table 2 Effect of different initial water activities of displayed lipases on yield of DIOA

图4 分子筛添加量对DIOA产率的影响Fig. 4 Effect of the concentration of molecular sieve on yield of DIOA. Reaction conditions: adipic acid 0.2 mol/L,molar ratio of adipic acid to iso-octyl alcohol fixed to 1:3.5,0.4 g displayed lipases, 55 ℃.

图5 温度对己二酸二异辛酯产率的影响Fig. 5 Effect of temperature on yield of DIOA. Reaction conditions: adipic acid 0.2 mol/L, molar ratio of iso-octyl alcohol to adipic acid fixed to 3.5:1, displayed lipases 0.4 g(аw=0.33), 0.8 g molecular sieve.
2.8 反应的初步放大与产品分离
采用以上各因素优化条件,在搅拌反应装置中,将反应体系放大到 200 mL,对规模制备进行初步探索。结果表明,表面展示脂肪酶的酵母细胞可高效催化合成DIOA,其产率可达97.8%。经减压蒸馏提纯产品,己二酸收率达91.6%,产品己二酸二异辛酯纯度达98.2%。
3 结论
通过对几个影响酯化反应因素的考察,得出酵母表面展示脂肪酶合成DIOA的最佳工艺条件。在10 mL反应体系中,以正庚烷为溶剂,反应初始水活度为 0.33,己二酸浓度为 0.2 mol/L,底物醇酸摩尔比为3.5:1,添加0.8 g分子筛及0.4 g酵母表面展示脂肪酶,55 ℃反应48 h后,DIOA产率可达85.0%。将反应放大到 200 mL,DIOA产率可达97.8%。经减压蒸馏后,DIOA纯度为98.2%。
采用毕赤酵母表面展示脂肪酶作为催化剂,可以较好地合成DIOA,且后期产物分离难度低;反应条件温和,不仅避免了对反应设备的腐蚀,更节省了大量的设备维护和运行费用。采用优化后的工艺条件,在搅拌反应装置中,实现了反应体系放大。表明该表面展示脂肪酶具有用于酶法合成高质量的绿色润滑油生产的潜力。
[1]Kolwzan B, Gryglewicz S. Synthesis and biodegradability of some adipic and sebacic esters. J Synthetic Lubric, 2003, 20:99−107.
[2]Tan TW, Chen BQ. Lipase fromCandidasp. 99-125 and its application in synthesis of chemicals. CIESC J, 2010, 61(7):1687−1692 (in Chinese).
谭天伟, 陈必强.Candidasp. 99-125脂肪酶及其在化学品合成中的应用. 化工学报, 2010, 61(7): 1687−1692.
[3]Chaibakhsh N, Rahman A, Vahabzadeh F, et al.Optimization of operational conditions for adipate ester synthesis in a stirred tank reactor. Biotechnol Bioproc E,2010, 15(5): 846−853.
[4]T Tanino, T Ohno, T Aoki, et al. Development of yeast cells displayingCandida antarcticalipase B and their application to ester synthesis reaction. Appl Microbiol Biotechnol, 2007,75: 1319−1325.
[5]Shiraga S, Kawakami M, Ishiguro M, et al. Enhanced reactivity ofRhizopus oryzaelipase displayed on yeast cell surfaces in organic solvents: potential as a whole-cell biocatalyst in organic solvents. Appl Environ Microbiol,2005, 71(8): 4335−4338.
[6]Jin Z, Lin Y, Huang DF. Synthesis of flavor esters catalyzed by CALB-displayingPichia pastoriswhole-cells in non-aqueous phase. Chin J Biotech, 2009, 25(12):1927−1932 (in Chinese).
金子, 林影, 黄登峰, 等. 展示南极假丝酵母脂肪酶 B的毕赤酵母全细胞催化合成短链芳香酯. 生物工程学报,2009, 25(12): 1927−1932.
[7]Jin Z, Han SY, Zhang L, et al. Combined utilization of lipase-displayingPichia pastoriswhole-cell biocatalysts to improve biodiesel production in co-solvent media.Bioresource Technol, 2013, 130: 102−109.
[8]Zheng SP, Ren CQ, Han SY, et al. Synthesis of glucose laurate monoester catalyzed byCandida antarcticalipase B-displayingPichia pastoriswhole-cells. Chin J Biotech,2009, 25(12): 1933−1939 (in Chinese).
郑穗平, 任昌琼, 韩双艳, 等. 毕赤酵母表面展示南极假丝酵母脂肪酶B全细胞催化合成葡萄糖月桂酸酯. 生物工程学报, 2009, 25(12): 1933−1939.
[9]Laane C, Boeren S, Vos K, Veeger C. Rules for optimization of biocatalyst is in organic solvents. Biotechnol Bioeng,1987, 30(1): 81−87.
[10]Jin Z, Ntwali J, Han SY, et al. Production of fl avor esters catalyzed by CALB-displayingPichia pastoriswhole-cells in a batch reactor. J Biotechnol, 2012,159 (1/2): 108−114.
[11]Hirofuml H, Katsuhiko H, Takao Y. Lipase-catalyzed transesterification in organic solvent: effects of water and solvent, thermal stability and some applications. J Biotechnol, 1990, 14: 157−167.
[12]Han SY, Pan ZY, Huang DF, et al. Highly ef fi cient synthesis of ethyl hexanoate catalyzed by CALB-displayingSaccharomyces cerevisiaewhole cells in non-aqueous phase.J Mol Catal B: Enzym, 2009, 59(1/3): 168−172.
