经内镜黏膜下隧道肿瘤切除术治疗上消化道黏膜下肿瘤的应用研究▲
2013-09-04姜海行覃山羽黄杰安李晓敏覃凤燕雷荣娥
姜海行 覃山羽 黄杰安 李晓敏 覃凤燕 雷荣娥
(广西医科大学第一附属医院消化内科,南宁市 530021)
近年来,随着内镜诊疗技术的飞速发展,尤其是内镜超声检查术(EUS)和内镜黏膜下剥离术(ESD)的广泛应用,消化道病变的内镜诊治水平明显提高,上消化道黏膜下肿瘤(SMTs)的检出率逐年上升。既往对源于固有肌层的肿瘤,因顾虑病变层次较深,内镜下不易彻底切除,且容易造成穿孔等并发症,多采取外科手术切除和定期观察随访治疗。经内镜黏膜下隧道切除术(submucosal tunneling endoscopic resection,STER)作为一项新近开展起来的内镜技术,由上海中山医院徐美东等[1]于2011年首次报道。我院消化内镜中心在广泛应用EUS及ESD的基础上总结经验,积极开展STER新技术,应用STER治疗12例源于固有肌层的上消化道SMTs病例,并对其临床疗效和安全性进行评估,现报告如下。
1 资料与方法
1.1 研究对象 2012年11月至2013年11月在我院内镜中心经胃镜、超声内镜和CT(平扫+增强)检查诊断为源于固有肌层的上消化道SMTs患者12例,其中男8例、女4例,年龄22~65岁,平均44.9岁,患者基本情况及临床资料详见表1。病变距门齿23~37 cm,瘤体长径0.8 ~5.0 cm,平均2.2 cm;超声胃镜显示肿瘤均来源于固有肌层,1例部分位于黏膜肌层,内部呈低回声,回声均匀,均提示源于固有肌层的黏膜下隆起(平滑肌瘤可能性大)。所有患者术前均被告知可能获得的益处和风险,并签署知情同意书。对入组病例的治疗结果、并发症发生情况、住院时间以及近期随访结果进行回顾性分析。
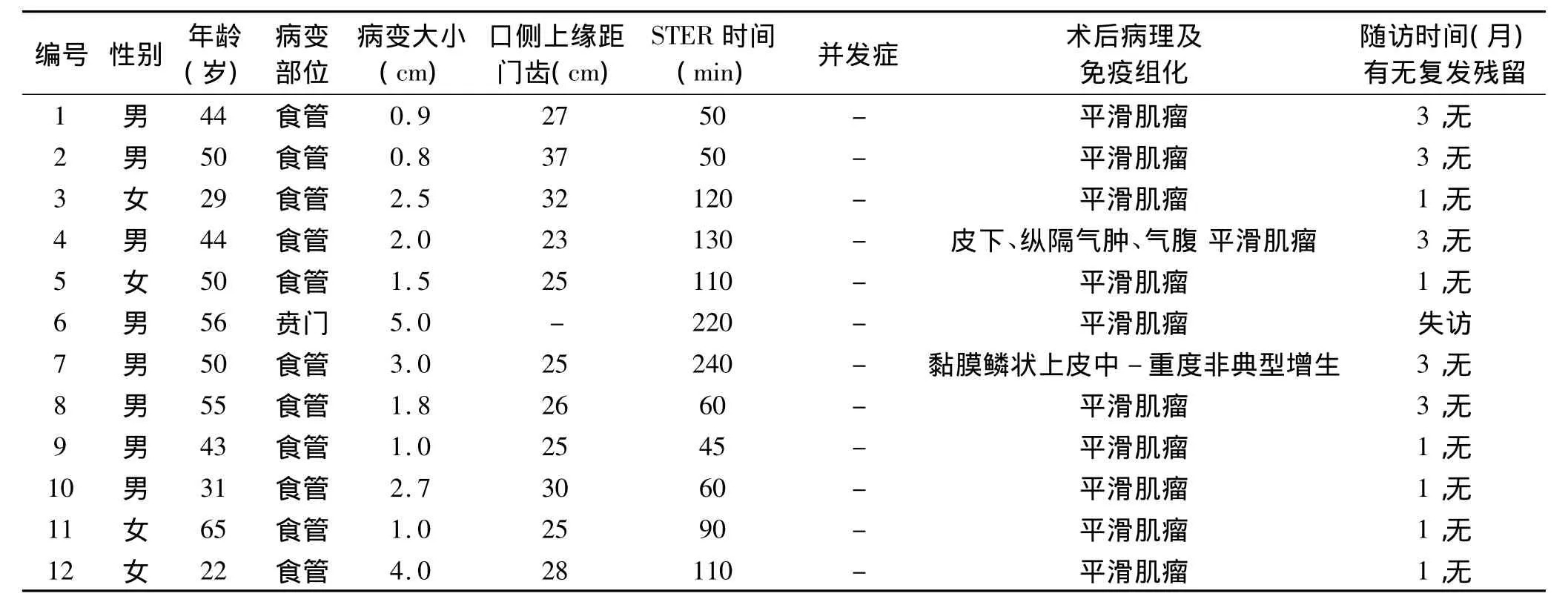
表1 12例来源于固有肌层的上消化道黏膜下肿瘤患者的部分临床资料
1.2 研究器械 Olympus公司生产的GIF Q260J胃镜,EU-M2000超声内镜系统,微超声探头采用UM-2R和UM-3R,NM-200V-0423注射针,FD-M-1热活检钳,Dual刀,IT刀,ERBE公司ICC-200高频电切装置,APC300氩离子凝固器,KD-620LR HOOK刀,KD-10Q-1针形切开刀,HX-600-135金属止血夹,D-201-11802透明帽,SD-230U.20 圈套器,CO2气泵。
1.3 研究方法
1.3.1 STER操作方法 所有患者术前半小时静脉使用抗生素预防感染,随后行气管插管,在全身麻醉下进行内镜操作,操作过程中胃镜前端附加透明帽。具体操作方法如下。①胃镜检查:在胃镜下找到肿瘤部位;②建立黏膜下隧道:选择距离肿瘤近口侧直线距离3~5 cm处黏膜作为切口,先用1∶10 000肾上腺素+靛胭紫进行黏膜下注射,使局部黏膜隆起,用Dual刀或海博刀纵行切开黏膜层1.5~2.0 cm,显露黏膜下层,然后用HOOK刀锐性分离或用内镜透明帽钝性分离黏膜下层,在两者之间建立黏膜下隧道,直至显露肿瘤;③完整切除肿瘤:找到肿瘤后,用IT刀沿瘤体周边分离瘤体与周围的组织,尽可能保持瘤体包膜完整,逐步将瘤体自固有肌层剥离,用异物钳或网篮将瘤体自隧道内取出,送病理科检查;④缝合黏膜切口:肿瘤切除取出后,用氩离子凝固术(APC)或热活检钳处理出血灶和可见的小血管,用生理盐水反复冲洗,洗净黏膜下隧道,并将“隧道”内液体吸尽,退镜至黏膜层切口,直视下用多枚金属夹对缝黏膜层切口。详见图1。
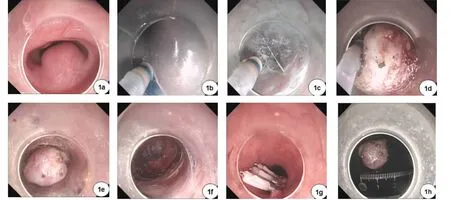
图1 经内镜黏膜下肿瘤切除术过程 1a:食管中段(距门齿28 cm)的黏膜下肿瘤(SMTs);1b:距SMTs近口侧5 cm处纵形切开黏膜2 cm;1c:分离黏膜下层及肌层,在黏膜下层和肌层之间建立黏膜下隧道;1d:显露肿瘤;1e:直视下完整切除肿瘤;1f:洗净黏膜下隧道,并将“隧道”内液体吸尽;1g:缝合黏膜切口;1h:切除瘤体,大小约1.8 cm×2.0 cm
1.3.2 术后处理 术后禁食3 d,出现皮下气肿等并发症时须禁食延长至5 d。严密观察生命体征,注意观察有无胸闷、胸痛和皮下气肿,予常规补液、抑酸、止血、黏膜保护、预防应用抗生素等处理。
1.4 随访 出院后第1个月、3个月复查上消化道内镜,观察病变有无残留或复发。
2 结果
2.1 治疗结果 本研究12例患者均能耐受手术,11例病灶位于食管,1例病灶位于贲门。11例患者病灶均由STER一次性完整切除,1例因病灶粘连明显,手术难度大,剥离出血多,耗时长,为保证病人安全,仅部分切除肿物。病灶长径0.8~5.0 cm,平均 2.2 cm;手术时间(自黏膜下注射到夹闭黏膜层切口)为45~240 min,平均107 min;完整缝合创面需要金属夹8~20枚,平均13枚。11例患者术后病理及免疫组化诊断提示均为平滑肌瘤,1例术后病理诊断为食管黏膜鳞状上皮中-重度非典型增生,未能诊断为癌。11例患者出院后第1个月、3个月行内镜复查,未见病变残留、复发,1例失访。详见表1。
2.2 并发症 所有患者SRER操作过程中创面均有少量出血,均经电凝、氩离子凝固术成功止血,无接受输血治疗者。有1例患者术中出现皮下及纵隔气肿、气腹,术后诉胸闷、胸痛、腹胀等不适,予对症和抗感染治疗3 d后复查胸片,提示气体基本上被吸收完全,患者症状好转出院。全组无1例与手术相关死亡病例,所有并发症经对症、保守治疗痊愈,无追加外科手术病例。所有患者术后常规使用质子泵抑制剂、抗生素和止血药,术后禁食3 d后予进食流质,住院5~9 d,平均7 d。术后第1个月、3个月复查胃镜,所有患者创面愈合良好,无病灶残留或复发。
3 讨论
上消化道SMTs是一组来源于黏膜下方各层病变的统称,他们在内镜下表现形态相似,即表面覆有正常黏膜的隆起性病变。按其来源层次不同,可来源于黏膜肌层、黏膜下层和固有肌层。上消化道SMTs一般无特殊临床症状,多在行内镜检查时偶然发现,但其来源和性质很难确定,尤其是来源于固有肌层的胃肠道间叶组织肿瘤,具有恶变潜能,当肿瘤生长到一定体积时,即会出现浸润邻近组织器官或血性转移等恶性肿瘤的特征。因此,早期切除肿瘤,获取准确、完整的病理诊断是必要的[2]。
EUS和ESD在临床的应用和发展,上消化道SMTs的诊治水平有了显著提高。EUS虽可了解SMTs的来源层次、大小,但无法准确判断其良恶性。普通的ESD主要用于黏膜和黏膜下层病变的切除,很少用于切除源于固有肌层的黏膜下肿物,因为后者穿孔概率极高,一旦穿孔则闭合难度较大。而STER是在经口内镜下食管括约肌切断术(POEM)的基础上发展而来的一种新的内镜微创治疗新技术,也是ESD技术的延伸,是国际上首创的隧道内镜技术[3]。截止2012年3月,上海中山医院内镜中心完成120余例STER,手术成功率在99%以上,未发生一例严重并发症和死亡病例,术后无迟发性消化道出血、消化道瘘和胸腔感染者。随访时间最长18个月,无一例病变残留复发或隧道内种植[2]。
STER通过在距病变部位的口侧端上方3~5 cm处切开黏膜,在黏膜下层进行剥离,建立黏膜下隧道,并逐步剥离达到肿瘤部位,充分暴露肿瘤后,直视下将肿瘤完整切除,这样既能完整切除肿瘤,又可避免损伤周围的组织和脏器而导致严重并发症的发生;然后经由隧道取出肿瘤,最后关闭隧道入口黏膜。这种操作方法既不同于传统消化内镜下治疗,亦不同于经自然腔道内镜手术(NOTES),而是巧妙地利用消化道黏膜和固有肌层之间的空间(像一个被打开的隧道)建立隧道进行操作[4~6]。适用于上消化道SMTs的切除。该内镜切除方法有效地回避了外科手术对于上消化道周边组织的损伤,仅一定程度地损伤了容易自我修复的黏膜及黏膜下层组织,所以患者术后均无任何不适症状。
与ESD手术一样,STER也存在着并发症发生的可能性。除常见的出血、穿孔以及术后胸痛、腹痛、腹胀等并发症外,STER特有的最常见并发症是纵隔和皮下气肿以及气胸和气腹[6]。徐美东等[1]对26例经超声内镜和CT诊断为来源于固有肌层的上消化道SMTs患者全麻下行STER治疗,发生皮下气肿2例,左侧气胸伴皮下气肿1例,气腹2例,均予保守治疗痊愈。对于轻度的皮下气肿和气胸(气胸体积小于30%),均可通过保守治疗,如保持半卧位、吸氧、心电监护、鼓励患者咳嗽和抗生素静脉滴注等获得好转和治愈。本研究中有1例患者术中出现皮下及纵隔气肿、气腹,可能的原因为瘤体较大较深,与浆膜粘连,在肿瘤切除时损伤食管外膜或出现了穿孔。故在切除肿瘤时要尽可能保证食管外膜的完整,气体灌注过程中采用在人体内弥散和吸收较快的CO2,当出现皮下气肿、气胸时,应注意控制送气,如出现气道压力明显增高超过20 mmHg(1 mmHg=0.133 kPa)、血氧饱和度 <90%,并发气胸时,可用深静脉穿刺细管胸腔闭式引流。
STER通过在肿物上方切开黏膜,建立黏膜下“隧道”,并逐步剥离达到肿瘤部位,进行切除上消化道固有肌层肿瘤时,术后上消化道黏膜下层感染是可能发生的并发症。周平红等[7]对45例患者建立“隧道”行内镜下肌切术治疗贲门失弛缓症,其中1例出现金属夹全部脱落、黏膜下层窦道形成;他们考虑该并发症与术后较早时间内大量进食和金属夹缝合不严密有关。Inoue等[4]也报道过此并发症。因此,对于STER术切除上消化道固有肌层肿瘤的患者,术中注意钛夹缝合需严密,术后需禁食3 d,开放饮食须渐进,由流质逐步过渡到半流质和普通软食,并且控制每次进食量。本研究全部患者术后均给予禁食、抑酸、补液3 d,3 d后改为流质饮食2周,后从半流质逐渐过渡到普通饮食。术后第1个月、3个月复查胃镜示食管创面愈合良好,且无明显由手术瘢痕引起的局部挛缩、食管狭窄等并发症。
建立黏膜下隧道时,一般要沿着黏膜下层和固有肌层间隙进行,可以减少术中出血。术中对黏膜下层粗大血管,要采用热活检钳远离黏膜面进行预防性电凝处理。在对固有肌层进行操作时,由于肌肉层中小血管及侧支循环较为丰富,如术中没有采取预防性止血措施,易发生术中出血,而隧道内空间有限,一旦发生较大量的出血,会严重影响手术视野,给止血和继续手术带来很大困扰,且易导致黏膜层和肌层的损伤而致穿孔。术后迟发性出血较为少见,本研究无1例术中大出血,术后无1例迟发型消化道出血,出血、穿孔发生率均为0%。
黏膜下隧道内术后发生黏膜下层继发感染也是可能的并发症,感染发生的基础是出血和积液。为防止上消化道黏膜下层感染和胸、腹腔感染,术前预防性使用抗生素。黏膜层切开前,要将食管与胃内的消化液冲洗吸净;术中创面要严密止血,关闭黏膜切口前可以用无菌生理盐水反复冲洗隧道,清除坏死组织和焦痂;术毕严密牢靠地缝合黏膜切口,术后使用抗生素3 d。本研究中所有患者术前半小时均给予预防性应用抗生素,但仍有2例患者术后出现了肺炎,予更换抗生素、加强抗感染治疗后,患者症状好转,术后3~5 d后均病愈出院。
STER通过建立病变近口侧黏膜下隧道间隙,完成肿瘤的剥离切除,有效地保护了病变剥离区域的消化道黏膜层的完整性,从而消除了全层切除可能带来的瘘道并发症,降低了内镜下上消化道SMTs切除并发症发生率。一些文献报道证明了内镜下介入治疗方法可以控制肿瘤实现择期的外科手术治疗[8]。由此可见,STER术切除源于固有肌层的上消化道SMTs与外科手术比较具有明显的优势。采用这一技术可以一次性完整剥离肿瘤,并且创伤小,保持消化道的完整性,避免术后出现消化道瘘和胸腹腔继发感染。术后患者恢复快,住院时间短,医疗费用低,且具有与外科手术相同的治疗效果,特别适用于年龄较大、基础疾病较多、不能耐受手术或不愿手术的患者。
综上所述,STER治疗来源于固有肌层的上消化道SMTs是可行、安全、有效的,可一次性完整切除病变,保持消化道完整性,并能提供完整的病理信息,避免术中、术后出现的出血、穿孔等并发症。术后患者创伤小,恢复快,住院时间短,且具有与外科手术相同的疗效,充分体现了微创治疗的优越性。但由于STER开展时间较短,病例数较少,随访时间短,STER治疗源于固有肌层的上消化道SMTs的远期疗效还有待大宗病例的随机、对照临床试验和循证医学资料。
[1] 徐美东,姚礼庆,周平红,等.经黏膜下隧道内镜肿瘤切除术治疗源于固有肌层的上消化道黏膜下肿瘤初探[J].中华消化内镜杂志,2011,28(11):606 -610.
[2] 徐美东,姚礼庆.隧道内镜技术在食管胃疾病中的应用价值[J].中华胃肠外科杂志,2012,15(7):659 -661.
[3] Xu MD,Cai MY,Zhou PH,et al.Submucosal tunneling endoscopic resection:a new technique for treating upper GI submucosal tumors originating from the muscularis propria layer[J].Gastrointest Endosc,2012,75(1):195 -199.
[4] Inoue H,Minami H,Kobayashi Y,et al.Peroral endoscopic myotomy(POEM)for esophageal achalasia[J].Endoscopy,2010,42(4):265 -271.
[5] Yoshizumi F,Yasuda K,Kawaguchi K,et al.Submucosal tunneling using endoscopic submucosal dissection for peritoneal access and closure in natural orifice transluminal endoscopic surgery:a porcine survival study[J].Endoscopy,2009,41(8):707 -711.
[6] 周平红,姚礼庆主编.消化内镜切除术[M].上海:复旦大学出版社,2012:604.
[7] 周平红,姚礼庆,蔡明琰,等.经口内镜下肌切开术治疗贲门失弛缓症的初探[J].中华消化内镜杂志,2011,28(1):63-66.
[8] Ozdil B,Akkiz H,Kece C,et al.Endoscopic alcohol injection therapy of giant gastric leiomyomas:an alternative method to surgery[J].Can J Gastroenterol,2010,24(9):533-535.
