应用纤维素结合域标签构建谷氨酸棒状杆菌表达系统
2013-09-04赵志敬蒋欢沈文婷宋潋滟胡广
赵志敬,蒋欢,沈文婷,宋潋滟,胡广
北大工学院绍兴技术研究院 生物工程中心,浙江 绍兴 312000
谷氨酸棒状杆菌是非病原性的革兰氏阳性菌,常被用于生产多种氨基酸[1]。经多年改造,有望用于大规模的蛋白生产[2]。以它为表达宿主有以下优势:1) 高效的分泌信号肽及分子伴侣系统使所分泌的重组蛋白大多具有生物活性[3];2) 除常规分泌途径外,还可通过双精氨酸易位途径进行分泌[4];3) 不产生内毒素,安全性好;4) 分泌的蛋白酶少,产物稳定[3];5) 人们积累了丰富的发酵经验,所以这是一种非常优良的工程菌株。
CBD是纤维素酶的一个蛋白域,含若干可吸附至纤维素表面的疏水区,能提高纤维素酶活[5]。亲和标签是纯化重组蛋白的常用方法,而 CBD标签较为独立的空间结构对蛋白性能的干扰小,且它的吸附填料——纤维素成本低廉[6]。近年来已有研究开始应用CBD为纯化标签进行蛋白纯化[7]。
在谷氨酸棒状杆菌的表达系统中,分泌到胞外的蛋白可通过离心、透析、浓缩或亲和层析等方法获得。但它们所使用的缓冲液及亲和树脂的高成本会加大蛋白纯化代价。本研究应用 CBD标签优化谷氨酸棒状杆菌表达系统的纯化工艺,试图降低生产成本。首先,合成里氏木霉的外切葡聚糖纤维二糖水解酶Ⅰ的 CBD基因并插入至谷氨酸棒状杆菌分泌表达载体,获得以 CBD为纯化标签的重组载体;然后,在该载体中插入 GFP基因并转化至谷氨酸棒状杆菌进行融合蛋白GFP-CBD的表达;最后,利用 CBD标签对纤维素柱的可逆性吸附,对发酵液中的目的蛋白进行纯化,实现蛋白生产工艺的优化,为大规模生产奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌种和试剂
谷氨酸棒状杆菌C. glutamicum13032、质粒pXMJ19-sp由天津科技大学的路福平教授提供;质粒 pMXS-IRES-GFP为实验室自有;纤维素填料Avicel PH-102NF购自 FMC Biopolymer。
1.1.2 培养基
LB培养基和MMTG培养基[8]。
1.1.3 序列合成
参考Van等的CBD序列[9],由公司合成并插入至克隆载体pGS3形成pGS3-CBD,序列如图1所示:

图1 经密码子优化后的CBD序列Fig. 1 CBD sequence after code optimization.
1.2 方法
1.2.1 构建CBD标签的谷氨酸棒状杆菌表达载体
试验流程如图2所示:AgeⅠ和PstⅠ双酶切质粒 pGS3-CBD并将目的基因 CBD连接至pXMJ19-sp,构建以CBD为纯化标签的谷氨酸棒状杆菌表达载体pXMJ19-sp-CBD。
1.2.2 GFP表达载体的构建
带CBD标签的GFP表达载体:以pMXS-IRESGFP 为模板,GF (5-CGCTCGAGATGGTGAGCAA GGGCGAGGAG-3),GR1 (5-AAAAACCGGT CTT GTACAGCTCGTCCATG-3) 为引物,PCR 扩增不含终止子的GFP片段,然后用XhoⅠ和AgeⅠ双酶切连接至表达载体pXMJ19-sp-CBD形成以CBD为纯化标签的GFP表达载体pXMJ19-sp-GFP-CBD。
带 polyHis标签的 GFP表达载体:以pMXS-IRES-GFP为模板,上述GF和GR2 (5-TGA CCTGCAGTTAATGGTGATGGTGATGGTGCTTGT ACAGCTCGTCCATG-3) 为 引 物 ,PCR 扩 增GFP-His片段并用XhoⅠ和PstⅠ双酶切连接至pXMJ19-sp,构建以polyHis为纯化标签的GFP表达载体pXMJ19-sp-GFP-His。
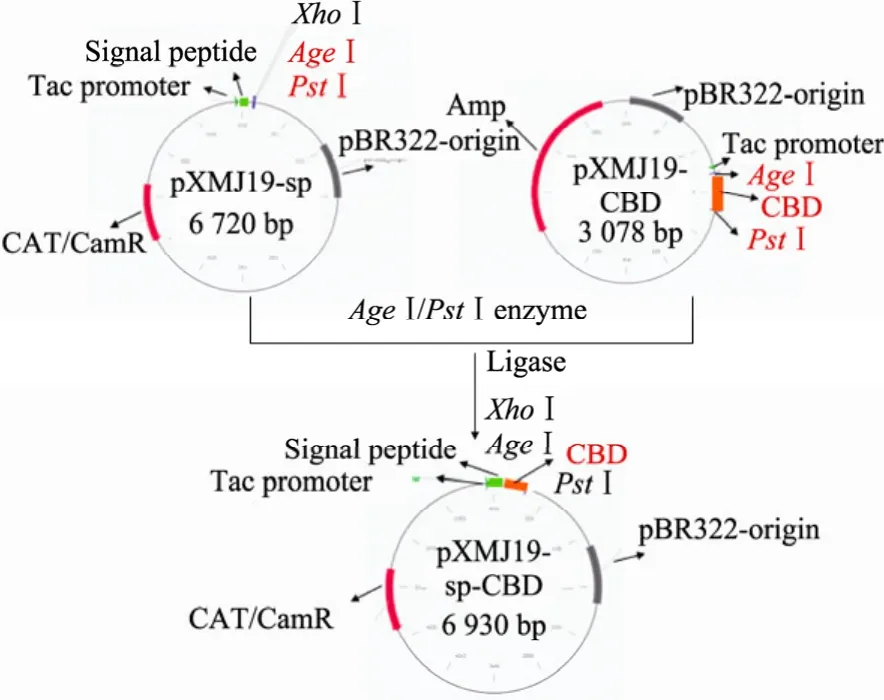
图2 pXMJ19-sp-CBD的构建流程图Fig. 2 Construction of pXMJ19-sp-CBD.
1.2.3 谷氨酸棒状杆菌的转化及表达
参考Van等的方法进行质粒的谷氨酸棒状杆菌电转化[10],并在MMTG培养基中进行分泌表达。
1.2.4 蛋白纯化
粗提取:发酵液离心所得上清即为蛋白粗液。
镍柱纯化:30 mL蛋白粗液添加终浓度400 mmol/L NaCl后上样至经磷酸缓冲液预平衡的0.5 mL镍柱,以含10、20和250 mmol/L咪唑的磷酸缓冲液洗脱10、3和5 mL,收集各步骤液体。
纤维素柱纯化:在蛋白粗液中添加终浓度1 mol/L的硫酸铵后上样至预平衡的0.5 mL纤维素柱,分别用1、0.5和0 mol/L硫酸铵溶液洗脱10、3和5 mL,收集各步骤液体。
2 结果与分析
2.1 CBD标签的谷氨酸棒状杆菌表达载体构建
将质粒 pGS3-CBD的 CBD基因克隆至pXMJ19-sp,如图 3A所示:双酶切的鉴定结果证明已经成功获得以 CBD 为纯化标签的pXMJ19-sp-CBD。
2.2 GFP分泌表达载体的构建
将1.2.2所得GFP-His和GFP基因分别克隆至pXMJ19-sp和pXMJ19-sp-CBD,如图3B所示:双酶切的鉴定结果显示已成功获得 GFP的分泌表达载体pXMJ19-eGFP-His和pXMJ19-eGFP-CBD。
2.3 重组菌的构建与表达
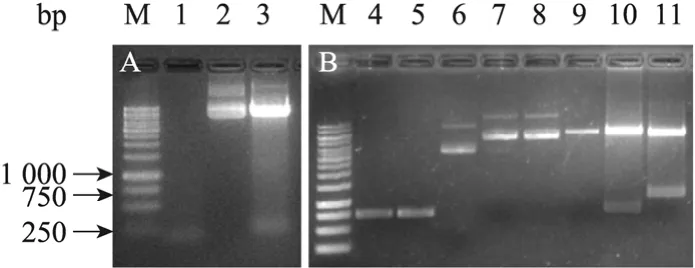
图3 载体的酶切鉴定Fig. 3 Restriction map of recombinant vector. M: DNA marker; 1: CBD gene; 2: pXMJ19-sp-CBD; 3: pXMJ19-sp-CBD-Age I-Pst I; 4: GFP-His; 5: GFP; 6: pXMJ19-sp; 7:pXMJ19-sp-GFP-His; 8: pXMJ19-sp-GFP-CBD; 9:pXMJ19-sp-His-Xho I; 10: pXMJ19-GFP-CBD-Xho I-Pst I;11: pXMJ19-sp-CBD-Age I-Pst I.
将上述载体分别转化至谷氨酸棒状杆菌感受态细胞构建重组菌C. glutamicum-pXMJ19-sp,C. glutamicum-pXMJ19-sp-GFP-His,C. glutamicumpXMJ19-sp-GFP-CBD。在MMTG培养中诱导表达3 d后离心,所得上清如图4B所示:在紫外灯下显示强烈的绿色荧光。蛋白粗液的SDS-PAGE分析如图 4C所示:所诱导表达的 GFP-His和 GFP-CBD约30 kDa,这与理论计算值 (28 kDa和33 kDa) 一致,经 BCA蛋白浓度检测试剂盒检测,可估算该重组蛋白的分泌表达量约200 mg/mL。
2.4 蛋白纯化
蛋白粗液的镍柱纯化结果如图4D所示,通过镍柱纯化可获得纯度达 90%的目的蛋白,经 BCA法检测可知其浓度为1.48 mg/mL,回收率达78%,镍柱对该蛋白的吸附能力达8.8 mg/mL;蛋白粗液的纤维素柱纯化结果如图 4E所示:纤维素柱纯化可获得90%以上纯度的目的蛋白,经BCA法检测可知其浓度为1.40 mg/mL,回收率达60%,纤维素柱对该蛋白的最大吸附能力为8.4 mg/mL。
吸附在纤维素柱上的重组蛋白可被纯水洗脱,如图4F所示:肉眼即可观察到目的蛋白在柱上的移动,而没有CBD标签的蛋白则不会出现这个现象。

图4 重组蛋白eGFP-His,eGFP-CBD的分泌表达纯化Fig. 4 Secretion and purification of recombinant pXMJ19-GFP-His and pXMJ19-GFP-CBD in C.glutamicum. 1: pXMJ19; 2: pXMJ19-GFP; 3: pXMJ19-GFP-CBD. (A, B) Fermentation broth under white/UV light. (C) SDS-PAGE analysis of secretion protein after dialysis. (D, E) Separation on Ni/cellulose matrices. (F)Separation of protein on a cellulose matrices.
3 讨论
由于产内毒素和易形成包涵体,大肠杆菌无法达到食品级用酶的生产要求,而谷氨酸棒状杆菌无此局限。日本味之素公司新开发的谷氨酸棒杆状菌表达系统专门用于表达大肠杆菌难以生产的蛋白[11]。刘凯等通过谷氨酸棒状杆菌分泌谷氨酰胺转胺酶,所得培养基具有交联酪蛋白活性,说明该系统有望实现食用蛋白的大规模生产[12]。
本研究首次以 CBD标签为谷氨酸棒状杆菌表达系统的纯化标签,旨在优化其生产工艺。参考谷氨酸棒状杆菌信号肽筛选的结果,所选用的信号肽为 cgR蛋白信号肽[13]。融合蛋白的分泌量达200 mg/L,而且有研究表明不同的谷氨酸棒状杆菌的分泌表达能力不同。本研究使用的C. glutamicum13032并不是最高效的分泌表达菌株,例如Corynebacterium callunae15991、13870、CC13826的分泌表达能力均在其之上,所以选择合适的菌株将有助于进一步提高分泌表达量[14]。
本研究所分泌表达的GFP-CBD可在1 mol/L的硫酸铵存在下吸附在纤维素柱上,之后在纯水条件下被洗脱,且纯化效果与镍柱纯化相当。其中分泌到培养基中的GFP-CBD为可溶性蛋白,在紫外灯下显示绿色荧光,说明与CBD融合表达并没有影响GFP的正确折叠。Romas等通过融合表达CBD简化抗菌肽LL37的纯化,所得抗菌肽具抗菌活性,说明CBD较为独立的空间结构对蛋白的活性影响较小[15]。
该方法所用填料应选择孔径较小的微晶纤维素。Naohisa等用的80 μm微晶纤维素,其吸附能力达15 mg/mL,而本研究的PH-102NF为150 μm的微晶纤维素有8 mg/mL的吸附能力,均比Whatman公司的大孔径纤维素粉CF1、CC31和CC41 (0.54、0.89和1.4 mg/mL) 要强[16]。但相较于传统的镍柱,在性价比上已经高出很多,且所用缓冲液 (硫酸铵)和洗脱液 (蒸馏水) 相对便宜,操作简便。所以以CBD为纯化标签的谷氨酸棒状杆菌表达系统既解决原核表达中内毒素问题,又降低纯化过程中由于亲和树脂及缓冲液造成的高成本,为实现谷氨酸棒状杆菌在大规模工业化生产奠定坚实的基础。
[1]Huser AT, Chassagnole C, Lindley ND, et al. Rational design of aCorynebacterium glutamicumpantothenate production strain and its characterization by metabolic flux analysis and genome-wide transcriptional profiling. Appl Environ Microbiol, 2005, 71(6): 3255−3268.
[2]Burkovski.Corynebacteria: Genomics and Molecular Biology.Norfolk: Caister Academic Press, 2008: 31−45.
[3]Lothar Eggeling MB. Handbook ofCorynebacterim glutamicum. Boca Rotan: Caister Academic Press, 2005:91−95.
[4]Meissner D, Vollstedt A, van Dijl JM,et al.Comparative analysis of twin-arginine (Tat)-dependent protein secretion of a heterologous model protein (GFP) in three different Gram-positive bacteria. Appl Microbiol Biotechnol, 2007,76(3): 633−642.
[5]Gilkes NR, Warren RA, Miller RC, et al.Precise excision of the cellulose binding domains from twoCellulomonas fimicellulases by a homologous protease and the effect on catalysis. J Biol Chem, 1988, 263(21): 10401−10407.
[6]Shoseyov O, Shani Z, Levy I. Carbohydrate binding modules:biochemical properties applications. Microbiol Mol Biol Rev,2006, 70(2): 283−295.
[7]Hong D, Wan W, Gao XL. Expression and purification of recombinant protein by using Family 3 cellulose-binding domain fusion tag in eukaryotes: CN, 201110035017.2011-01-19 (in Chinese).
洪泂, 宛雯, 高晓连. 家族3纤维素结合域在真核生物中作为重组蛋白质表达和纯化的亲和标签的应用: CN,201110035017. 2011-01-19.
[8]Date M, Yokoyama K, Umezawa Y,et al.High level expression ofStreptomyces mobaraensistransglutaminase inCorynebacterium glutamicumusing a chimeric pro-region fromStreptomycescinnamoneustransglutaminase. J Biotechnol, 2004, 110 (3): 219−226.
[9]Wey TT, Hseu TH, Huang L. Molecular cloning and sequence analysis of the cellobiohydrolase I gene fromTrichoderma koningiiG-39. Curr Microbiol, 1994, 28 (1): 31−39.
[10]van der Rest ME, Lange C, Molenaar D. A heat shock following electroporation induces highly efficient transformation ofCorynebacteriumglutamicumwith xenogeneic plasmid DNA. Appl Microbiol Biotechnol, 1999,52 (4): 541−545.
[11]Oda S. Ajinomoto group useCorynebacterium glutamicumexpression system to do expression business of protein production. Biotechnol Business, 2011, 2: 4−5 (in Chinese).小田修司. 味之素公司利用谷氨酸棒杆菌的表达系进行蛋白表达业务. 生物产业技术, 2011, 2: 4−5.
[12]Liu K, Liu YH, Zhang Y. Heterogeneous expression ofBacillus subtilistransglutaminase. J Tianjin Univer Sci Technol, 2012, 27(3): 1−5 (in Chinese).
刘凯, 刘逸寒, 张艳. 枯草芽孢杆菌谷氨酰胺转氨酶的异源表达. 天津科技大学学报, 2012, 27(3): 1−5.
[13]Watanabe K, Tsuchida Y, Okibe N,et al.Scanning theCorynebacterium glutamicumR genome for high-efficiency secretion signal sequences. Microbiology, 2009, 155 (Pt 3):741−750.
[14]Itaya H, Kikuchi Y. Secretion of pro-transglutaminase byCoryneformbacteria. Appl Microbiol Biotechnol, 2008, 78 (4):621−625.
[15]Ramos R, Domingues L, Gama M.Escherichia coliexpression and purification of LL37 fused to a family III carbohydrate-binding module fromClostridium thermocellum.Protein Expr Purif, 2010, 71 (1): 1−7.
[16]Sugimoto N, Igarashi K, Samejima M. Cellulose affinity purification of fusion proteins tagged with fungal family 1 cellulose-binding domain. Protein Expr Purif, 2012, 82 (2):290−296.
