N-糖基化对KCNE1功能的影响
2013-09-03李小青茅家慧胡亚娥施海燕沈之君
李小青,茅家慧,胡亚娥,施海燕,沈之君
(南通大学医学院病理学与病理生理学系,江苏南通 226001)
N-糖基化是蛋白翻译后修饰的一种,对蛋白功能的正常发挥起重要作用。KCNE1为电压门控性钾离子通道Iks的调控亚基,KCNQ1为功能亚基。KCNE1不存在时,KCNQ1表现出快速激活和快速失活特征;在KCNE1调控下,通道表现为缓慢激活特征,失活速度减慢,并且通道电导率明显增加4~7倍,电压依赖性曲线右移。该通道参与心肌动作电位复极化[1],尤其是在机体受到刺激后交感神经兴奋的情况下发挥重要作用。临床上,KCNQ1和KCNE1的突变可分别导致LQT1和LQT5[2]。因此,研究该通道的功能和调控对临床治疗相关疾病有重要意义。N-糖基化在KCNE1中的作用尚无系统研究。N-糖基化在KCNE1中功能的研究可增进对KCNE1功能调控的认识,并增加对Iks通道调控的理解,也为临床上预防与KCNE1 N-糖基化有关的疾病,并为寻找新的治疗靶点提供理论和实验依据。
1 材料和方法
1.1 材料
人源KCNE1基因表达载体KCNE1-pcDNA 3.1:NIH Mammalian Gene Colletion(MGC);人源KCNQ1基因表达载体KCNQ1-PCI:同济大学陈义汉教授惠赠;质粒体外表达细胞株HEK293B:上海细胞研究所;PNGaseF:New England Biolabs,货号 P0704;点突变试剂盒(QuikChange®Lightning Site-Directed Mutagenesis试剂盒):Stratagene,货号210518;KCNE1抗体:Santa Cruze,货号sc-16796(WB 使用浓度1∶1 000,细胞免疫荧光使用浓度1∶100);KCNQ1抗体:Santa Cruze,货号sc-20186(使用浓度1∶2 000);Goat anti-rabbit IgG(H+L):Thermo,货号 31460(使用浓度 1∶5 000);Rabbit anti-goat IgG(H+L):Thermo,货号31402(使用浓度1∶5 000);Alex Flour®488 donkey anti-goat:Invitrogen,货号A11055(使用浓度1∶500);脂质体FuGENE®HD Transfection Reagent:Roche,货号 04709705001;Dynal beads-ProteinG:Invitrogen,货号 100.04D。
1.2 方法
1.2.1 PNGaseF 消化 KCNE1 实验
PNGaseF(peptide-N-glycosidase F):特异水解N寡糖-肽连接键,去除N-糖基化糖链。KCNE1蛋白裂解液(蛋白20 μg)按照使用说明处理后加入2 μl PNGaseF,37℃孵育2 h。然后将产物加蛋白上样缓冲液处理后经蛋白质印迹法分析。本研究中使用的SDS-PAGE浓度均为:分离胶浓度15%,浓缩胶浓度5%。
1.2.2 KCNE1 N-糖基化位点突变体质粒的构建与表达
1.2.2.1 突变体质粒构建 以野生型KCNE1-pcDNA 3.1为模板,按照点突变试剂盒操作方法构建KCNE1-N5Q、KCNE1-N26Q和 KCNE1-N5,26Q 3个突变体。KCNE1-N5Q上下游引物为:上游引物5'-CCAGGATGA TCCTGTCTCAAACCACAGCGGTGACGC-3',下游引物 5'-GCGTCACCGCTGTGGTTTGAGACAGGATCATCCTGG-3';KCNE1-N26Q上下游引物为:上游引物5'-GTTCAGC AGGGTGGCCAAATGTCGGGCCTGGC-3',下 游 引 物5'-GCCAGGCCCGACATTTGGCCACCCTGCTGAAC-3'。
1.2.2.2 突变体质粒表达 将KCNE1野生型及3个突变体,按照8 μl脂质体/4 μg KCNE1的比例,分别转染至已在60 mm培养皿中培养12~24 h的HEK293B细胞中,培养36 h后提取蛋白,经蛋白质印迹法分析。
1.2.3 KCNE1 N-糖基化突变体亚细胞定位分析实验
细胞免疫荧光实验检测KCNE1 N-糖基化突变体亚细胞定位。方法:将HEK293B提前12 h培养在铺有盖玻片的12孔板上;按2 μl脂质体/1 μg KCNE1的比例,将野生型和突变体分别转染细胞;36 h后进行免疫染色:4%多聚甲醛固定30 min;0.2%Triton-X100的PBT通透细胞膜,15~30 min;KCNE1抗体孵育,4℃过夜;PBST漂洗3次,10 min·次-1;donkey anti-goat荧光Ⅱ抗孵育,室温2 h;PBST漂洗3次,10 min·次-1;在细胞片上滴 80% 甘油约 20 μl,然后其上覆盖盖玻片,室温放置15 min;制好的细胞玻片在荧光显微镜下观察,拍照记录。
1.2.4 KCNE1 N-糖基化突变体与KCNQ1相互作用分析
通过KCNE1 N-糖基化突变体与KCNQ1的免疫共沉淀实验检测KCNE1 N-糖基化突变体与KCNQ1相互作用。HEK293B在60 mm培养皿中培养12~24 h后,细胞密度达到70%~80%,以8 μl脂质体/(2 μg KCNQ1+2 μg KCNE1)的转染比例,将野生型及突变体分别与KCNQ1转染细胞;细胞转染36 h后依次进行以下操作:以200 μl RIPA裂解液提取细胞总蛋白;在200 μl蛋白裂解液中加入20 μl KCNQ1的抗体,4℃缓慢摇动过夜;向上述反应混合物中加入50 μl Dynal beads-ProteinG,4℃缓慢摇动混合物2 h,然后经PBS漂洗3次;利用磁力架收集磁珠-抗原-抗体复合物,PBS漂洗3次,得到沉淀物(磁珠-抗原-抗体);用60 μl上样缓冲液将沉淀悬起,轻轻混匀;将上述样品煮沸10 min,然后以磁力架弃去磁珠,上清经过蛋白质印迹法检测KCNE1。
2 结 果
2.1 KCNE1糖基化位点的鉴定
KCNE1含有129个氨基酸。N-糖基化的氨基酸的序列特征是Asn-X-Ser/Thr(X代表除脯氨酸外的任何一种氨基酸),天冬酰胺作为糖链受体。根据上述条件分析,KCNE1上第5位(N5)和第26位(N26)符合条件(图1,加粗斜体字母显示),说明KCNE1可能存在N-糖基化。为进一步确定KCNE1存在N-糖基化,使用特异的去除 N-糖基的酶 PNGaseF消化KCNE1,蛋白质印迹法检测结果(图2)显示:KCNE1经消化后,3条条带只剩下分子质量最小的一条带,证明KCNE1存在N-糖基化,N5和N26是可能的N-糖基化位点。

图1 KCNE1“Asn-X-Ser/Thr序列”分析图Fig 1 “Asn-X-Ser/Thr”sequencing analysis of KCNE1
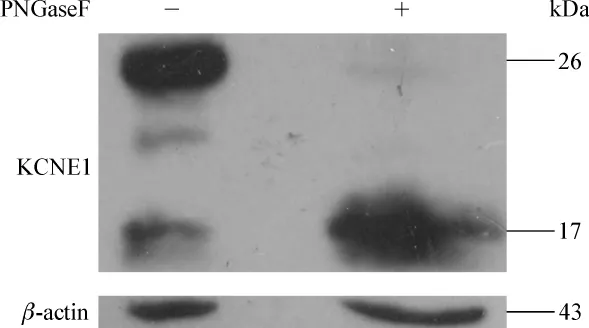
图2 KCNE1经PNGaseF去N-糖基后蛋白免疫印迹图Fig 2 Western blot of KCNE1 de-N-glycosylation treatment using PNGaseF
2.2 KCNE1 N-糖基化突变体的构建及表达分析
将KCNE1 5位和26位的N突变为Q(谷氨酰胺,与天冬酰胺分子结构类似,但不能被N-糖基化修饰),得到KCNE1-N5Q(单点突变)、KCNE1-N26Q(单点突变)和KCNE1-N5,26Q(联合突变)3个突变体。蛋白质印迹法检测结果(图3)显示:野生型KCNE1表现为3条条带,但17kDa及26kDa与17kDa之间的条带因上样量较少,表现不明显(参考图2)。与野生型相比,两个单点突变体均减少1条条带,而联合突则仅保留1条条带,说明N5和N26为KCNE1的两个糖基化位点。同时,图3显示 KCNE1-N5Q和 KCNE1-N5,26Q表达相对减少,而KCNE1-N26Q的表达与野生型表达丰度接近。

图3 KCNE1及其N-糖基化位点突变体蛋白免疫印迹分析图Fig 3 Western blot of KCNE1 and the N-glycosylation mutants
2.3 KCNE1 N-糖基化突变体亚细胞定位分析
细胞免疫荧光结果(图4)表明:野生型KCNE1在细胞质内的分布较为均匀。与野生型相比,KCNE1-N26Q在细胞质内分布较少,主要分布在细胞核周围的内质网区域,表现为显著的蛋白囤积特征(白色↑↑所示),KCNE1-N5Q与KCNE1-N5,26Q则该特征表现不明显(白色↑所示)。突变体不同程度的蛋白囤积现象,可能与突变体表达丰度有关系,如图3所示:KCNE1-N26Q表达量较大,而KCNE1-N5Q和KCNE1-N5,26Q表达减少,因此前者可表现出明显的内质网区域蛋白囤积特征,后两者则不明显。上述结果显示,突变体在细胞内的转运出现障碍,说明N-糖基化参与了蛋白转运过程,其中N26Q的糖基化在蛋白的转运中的作用最为突出。

图4 KCNE1及其N-糖基化突变体细胞免疫荧光图Fig 4 Immunofluorenscent studies of KCNE1 and the N-glycosylation mutants
2.4 KCNE1 N-糖基化突变体与KCNQ1相互作用分析
采用免疫共沉淀的方法探究N-糖基化位点突变体KCNE1与KCNQ1的相互作用是否发生改变。结果(图5)显示:与野生型类似,KCNE1 N-糖基化突变体均能与KCNQ1结合,说明N-糖基化修饰在KCNE1与KCNQ1的相互作用中不起重要作用。但N-糖基化修饰是否影响两者之间的结合能力,尚需进一步蛋白定量分析。

图5 KCNE1及其N-糖基化突变体与KCNQ1免疫共沉淀实验结果图Fig 5 Co-immunoprecipitation of KCNE1 and its N-glycosylation mutants with KCNQ1
3 讨 论
N-糖基化在蛋白的功能中发挥着重要角色。表现在:加强蛋白质稳定性使其能够抵抗消化酶的作用;参与蛋白转运、信号转导[3];帮助蛋白的正确折叠和组装;也参与蛋白的分泌过程,例如促进人类生长因子的分泌[4]。有研究报道糖基化参与了大鼠血管平滑肌细胞骨保护素mRNA表达调节[5]。在离子通道中的作用表现在两方面:调控蛋白的膜表达[6-7];调控离子通道的功能,例如通道激活和门控特性[8];近期有研究发现:N-糖基化依赖性阻断是药物引起心律失常的一种新的机制[9]。本研究探究了其对KCNE1功能的影响。实验结果显示,N-糖基化位点参与了蛋白的转运过程,并且呈现位点功能的差异性,KCNE1-N26Q蛋白在细胞内发生囤积现象明显,说明N26对蛋白的转运起关键作用。免疫共沉淀结果显示突变体仍能与KCNQ1结合,说明KCNE1 N-糖基化修饰对两者的相互作用不起关键作用,但N-糖基化修饰是否影响二者的结合能力尚待进一步蛋白定量分析。以上研究是基于体外实验的结果,N-糖基化对KCNE1功能的影响在生物体内可能更为复杂。有研究报道,KCNE1也参与调控Ikr通道,KCNE1-D85N突变体会导致HERG通道电流减小85%[10],因此其蛋白的N-糖基化功能失调可能影响HERG通道或其他与其相关的通道的功能。KCNE1-T7I是临床上发现的突变位点[11],可导致Jervell and Lange-Nielson Syndrome(耶韦尔和朗格-尼尔森综合征,JLNS)。第7位(T7)是KCNE1蛋白的O-糖基化位点,第5位(N5)的改变可能影响T7正常的O-糖基化,以至影响蛋白的功能。KCNE1在不同物种内的同源性分析表明,N5和N26位两个糖基化位点保守程度极高,说明糖基化位点在KCNE1内的作用不可替代。本研究加深了N-糖基化在KCNE1中作用的认识,增进了对KCNE1与KCNQ1相互作用的了解,增加了对Iks通道调控的认识,为临床上预防和治疗KCNE1 N-糖基化有关的疾病提供理论依据。
[1]JESPERSEN T,GRUNNET M,OLESEN S P.The KCNQ1 potassium channel:from gene to physiological function[J].Physiology(Bethesda),2005,20:408-416.
[2]MARKIEWICZ-LOSKOT G,MORIC-JANISZEWSKA E,MAZUREK U.The risk of cardiac events and genotype-based management of LQTS patients[J].Ann Noninvasive Electrocardiol,2009,14(1):86-92.
[3]FLINTEGAARD T V,THYGESEN P,RAHBEK-NIELSEN H,et al.N-glycosylation increases the circulatory half-life of human growth hormone[J].Endocrinology,2010,151(11):5326-5336.
[4]XU J,KIELISZEWSKI M.Enhanced accumulation of secreted human growth hormone by transgenic tobacco cells correlates with the introduction of an N-glycosylation site[J].J Biotechnol,2011,154(1):54-59.
[5]郭秀芳,任晓妹,魏芹,等.糖基化终产物对大鼠血管平滑肌细胞骨保护素mRNA表达的影响[J].东南大学学报:医学版,2008,27(2):153-156.
[6]PITTET M,ULDRY D,AEBI M,et al.The N-glycosylation defect of cwh8 Delta yeast cells causes a distinct defect in sphingolipid biosynthesis[J].Glycobiology,2006,16(2):155-164.
[7]EGENBERGER B,POLLEICHTNER G,WISCHMEYER E,et al.N-linked glycosylation determines cell surface expression of two-pore-domain K+channel TRESK[J].Biochem Biophys Res Commun,2010,391(2):1262-1267.
[8]JOHNSON D,BENNETT E S.Gating of the shaker potassium channel is modulated differentially by N-glycosylation and sialic acids[J].Pflugers Arch,2008,456(2):393-405.
[9]PARK K H,KWOK S M,SHARON C,et al.N-Glycosylationdependent block is a novel mechanism for drug-induced cardiac arrhythmia[J].FASEB J,2003,17(15):2308-2309.
[10]NOF E,BARAJAS-MARTINEZ H,ELDAR M,et al.LQT5 masquerading as LQT2:a dominant negative effect of KCNE1-D85N rare polymorphism on KCNH2 current[J].Europace,2011,13(10):1478-1483.
[11]SCHULZE-BAHR E,WANG Q,WEDEKIND H,et al.KCNE1 mutations cause jervell and Lange-Nielsen syndrome[J].Nat Genet,1997,17(3):267-268.
