经典H-2分子mRNA探针的制备及在C57小鼠中枢神经系统原位杂交中的应用
2013-09-03刘建娥沈宇清李明莉吴晓箐史茜张建琼
刘建娥,沈宇清,李明莉,吴晓箐,史茜,张建琼
(东南大学医学院病原生物学与免疫学系,发育与疾病相关基因教育部重点实验室,江苏南京 210009)
既往认为脑部是免疫豁免区,MHCⅠ类分子仅在病理条件下被诱导表达[1]。但是随着检测技术的发展,近年的研究发现,MHCⅠ类分子在正常的未受感染的神经元上也有表达,同时具有时空特异性和可调控性,并发挥了非常重要的作用[2]。但在小鼠中枢神经系统中只在某些时期特定部位发现有MHCⅠ类分子的表达[3-6],不同发育阶段不同部位MHCⅠ类分子的表达模式未见系统性报道。MHC分子具有高度多态性,不同物种之间以及相同物种不同品系之间存在着差异[7],小鼠 MHC 分子称为 H-2 复合体[8-9]。H-2复合体是由彼此独立又紧密连锁的基因座位组成,长约1 500 kb。H-2复合体基因分为3类,其中Ⅰ类基因因多态性、产物分布与功能的不同又可分为经典与非经典两类基因。H2-D、H2-K和H2-L为H-2复合体中的经典Ⅰ类基因,在C57小鼠中经典Ⅰ类基因仅包括H2-D和H2-K,并且143~463 bp为其保守序列,此段DNA序列为合成H-2分子特异性mRNA探针提供了依据。
本实验通过合成地高辛标记的经典H-2 mRNA的特异性探针,利用原位杂交方法观察经典H-2 mRNA在正常发育的C57小鼠中枢神经系统中的表达情况,为进一步研究经典H-2分子在小鼠中枢神经系统发育中较为精细的表达模式和作用机制及其与非经典Ⅰ、Ⅱ类分子表达的异同奠定基础。
1 材料与方法
1.1 材料
C57BL/6小鼠购自上海斯莱克实验动物有限责任公司,质粒小量制备采用QIAGEN公司质粒小量提取试剂盒,转录试剂购自Roche公司,PCR扩增试剂购自Invitrogen公司,U47325购自Openbiosystem公司。
1.2 方法
1.2.1 试验小鼠与取材 取性成熟的C57BL/6雌雄鼠于16:00后合笼,次日开始每天12:00前检测雌鼠有无阴道栓,检出阴道栓的当日标记为E 0.5 d,小鼠出生当日记为P 0。
胚胎鼠脑组织获得:断颈处死孕鼠,取出胚胎,在DEPC-PBS中剥除子宫壁和胎膜;将胚胎移入4%DEPC-PFA中,在体视镜下仔细分离脑组织。将脑组织置于4%DEPC-PFA,4℃过夜固定;用30%蔗糖(0.1 mol·L-1DEPC-PBS配)4 ℃浸泡至组织块沉底;用OCT包埋,-70℃保存备用。
1.2.2 质粒的构建 根据小鼠经典H-2 cDNA基因序列(U47325),应用上游引物5'-NNGTN GGCTA YGTKG ACRAC-3'、下 游 引 物 5'-KYRGG TYYTC RTTCA GGG-3'进行PCR产物扩增,目的片段长度为321 bp,对应于小鼠经典H-2核苷酸序列的第143~463位。PCR扩增的条件为:95℃预变性5 min;95℃变性30 s,61℃退火30 s,72℃延伸40 s,循环30次;72℃延伸10 min。1%琼脂糖凝胶电泳鉴定PCR产物(321 bp);PCR纯化试剂盒纯化PCR产物;通过T4连接酶连接反应,将PCR产物与pGEM-T Easy载体连接。1.2.3 正反义探针的制备 将构建的质粒转化到DH5α感受态细菌中,经筛选、提取、纯化,再根据pGEM-T Easy载体的多克隆位点和经典H-2本身的酶切位点,选用限制性内切酶NcoⅠ和PstⅠ酶切鉴定克隆的质粒。经测序,插入序列的方向与pGEM-T Easy载体自身DNA的方向相同(图1)。扩增的质粒分别用限制性内切酶NcoⅠ和PstⅠ酶切,使其线性化,再采用T7和Sp6转录酶,体外转录合成经典H-2 mRNA的正、反义探针。

图1 pGEM-T Easy载体示意图(A)、酶切位点(B)及插入序列H-2的位置和方向(C)Fig 1 The sketch map and restriction enzyme cutting site of pGEM-T Easy Vector correspond to A and B.The location and direction of inserted sequence H-2 are shown in C
1.2.4 原位杂交 将在-70℃保存的切片拿到室温下放置30 min,直至切片回到室温,再放到50℃杂交炉中烤片烤20 min;DEPC-PBS洗片5 min;4%DEPC的多聚甲醛中前固定20 min,洗片;蛋白酶K缓冲液处理组织切片,洗片;后固定30 min;置于新配制的TEA缓冲液洗10 min;将切片浸在预杂交液中放入63~65℃的杂交炉中预杂交3~4 h;制备湿盒(干的杂交盒底部加用过的预杂交液),将含0.008 μg·(100 μl)-1探针的杂交液加在切片上;放入65℃的杂交炉中杂交12~16 h;65℃,在预热的0.2 mol·L-1SSC中洗掉盖玻片(勿摇);用 PBT洗 2次,每次20 min;10%的血清(PBT稀释)封闭30 min;倒去切片上的血清,勿洗,加含1∶2 000的抗地高辛抗体的血清,3 h;PBT洗6次,每次10 min;碱性磷酸酶缓冲液洗2次,每次5 min;加显色液,避光,显色;PBS终止显色反应;4%多聚甲醛后固定1~2 h;PBS漂洗,甘油封片剂封片,室温保存。
2 结 果
2.1 正反义探针的制备
见图2。

图2 经典H-2基因片段PCR电泳图 1、2.PCR扩增的针对经典H-2的特异性片段;3.经典H-2插入pGEM-T Easy载体的目的片段双酶切鉴定图;4.Marker DL 2 000Fig 2 The PCR products of classical H-2 gene were examined by standard agarose gel electrophoresis
通过合成引物,PCR扩增出经典H-2的特异性片段,其产物大小为321 bp。图2中1、2泳道为经典H-2 PCR产物的电泳图。然后将PCR产物纯化后,与pGEM-T Easy载体连接,转化大肠杆菌DH5α中,提取质粒进行双酶切鉴定。3泳道为质粒经内切酶NcoⅠ和PstⅠ双酶切鉴定图,可见目的片段大小为321 bp,即为所需片段的大小。
2.2 测序结果
见图3。
经过测序,目的片段321 bp与经典H-2分子序列(143~463 bp)碱基完全相同,没有突变,即可运用此菌液克隆扩增,提取质粒线性化进行体外转录,采用T7和Sp6转录酶,分别合成经典H-2 mRNA的正、反义探针。
2.3 原位杂交
见图4。
所合成的经典H-2探针运用原位杂交方法鉴定其特异性的可行性。图4反义探针结果显示的是经典H-2在C57小鼠P15小脑中的表达情况。同时运用正义探针对相同部位进行杂交,无杂交信号,作为阴性对照。由此可见,合成的经典的H-2 mRNA探针可以特异性地结合组织中的mRNA,可用于原位杂交检测其在C57小鼠中枢神经系统中的表达模式。
3 讨 论
MHC分子在中枢神经系统是否表达曾有争议,既往没有在中枢神经系统检测到MHCⅠ类分子的表达可能是由于以下原因:首先,脑切片组织的固定方法对抗体识别抗原表位的影响,使得抗体的灵敏度下降[10]。其次可能是因为在小鼠不同发育阶段有不同的MHCⅠ类分子的表达,所以研究不同发育时期MHCⅠ类分子的表达对抗体的需求不同[3-4]。因而免疫组化方法用于检测MHCⅠ类分子蛋白水平的表达受到一定的限制,同时蛋白水平和转录水平也会出现一定的差异表达。因此选用原位杂交的方法来检查MHCⅠ类分子在中枢神经系统中的表达也是十分必要的。
MHC是一组紧密连锁的基因群,经典MHCⅠ类基因区具有高度多态性,这对合成经典Ⅰ类基因的特异性探针提出了很高的要求,所合成的探针必须是针对其碱基序列中的保守片段,这样才能保证合成的探针是特异的而具有探索价值。在合成正反义探针的时候,所选择的转录片段必须是同一段片段,不能是转录的不同的片段,这样就构不成所谓的正反义探针[11]。
已有证据初步推测MHCⅠ类分子不仅发挥免疫功能,它对正常脑的发育、神经元的分化、突触可塑性及记忆行为都具有重要的作用[12-14]。MHCⅠ类分子在中枢神经系统的表达及功能的研究是近年的研究热点,但该高度多态性的分子在小鼠中枢神经系统不同时期的表达模式未见系统性报道,其功能的研究处于起步阶段[15-18]。本实验采用分子生物学技术构建重组质粒合成了地高辛标记的经典H-2 mRNA正、反义原位杂交探针,所得到的反义探针作为杂交检测探针,而正义探针则作为实验的阴性对照。通过原位杂交,结果显示,C57小鼠在P15小脑反义探针呈现阳性结果,即经典H-2 mRNA在P15的小脑有表达,正义探针对相同部位进行杂交则无杂交信号,进一步证实了所合成的经典H-2 mRNA探针的特异性,这为我们研究经典H-2 mRNA在C57小鼠中枢神经系统中的表达谱奠定了基础。同时运用此方法可以进一步合成非经典H-2Ⅰ类和H-2Ⅱ类基因的特异性探针,比较H-2基因在小鼠中枢神经系统的表达模式差异。

图3 经典H-2基因片段测序图——插入的经典H-2 cDNA与C57小鼠经典H-2基因序列测序峰图Fig 3 The sequence of classical H-2:the inserted sequence of classical H-2 cDNA and the sequence of classical H-2 in C57 mice
本研究结果显示,我们已经成功构建了特异性的经典H-2 mRNA正、反义探针,为研究H-2分子其他成员在小鼠中枢神经系统中的表达奠定了技术基础。
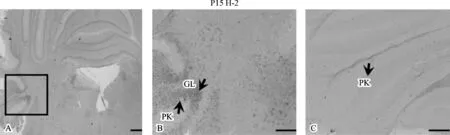
图4 经典H-2在C57小鼠P15小脑的表达 A、B(A图中黑框的放大).经典H-2反义探针杂交信号;C.经典H-2正义探针杂交信号;Bar:A为450 μm,B、C为150 μm;PK为浦肯野细胞层(Purkinje cell layer);GL为颗粒层(granula layer)Fig 4 Expression of classical H-2 in the cerebellum of P15 in C57 mice
[1] LAMPSON L A.Interpreting MHC classⅠ expression and classⅠ/classⅡ reciprocity in the CNS:reconciling divergent findings[J].Microsc Res Techniq,1995,32:267-285.
[2]NEUMANN H,SCHMIDT H,CAVALIE A,et al.Major histocompatibility complex(MHC)classⅠgene expression in single neurons of the central nervous system:differential regulation by interferon(IFN)-γ and tumor necrosis factor(TNF)-α[J].Exp Med,1997,185:305-316.
[3]CORRIVEAU R A,HUH G S,SHATZ C J,et al.Regulation of classⅠMHC gene expression in the developing and mature CNS by neural activity[J].Neuron,1998,21:505-520.
[4]GENE S H,LISA M B,DU H P,et al.Functional requirement for classⅠ MHC in CNS development and plasticity[J].Science,2000,290:2155-2159.
[5]GODDARD C A,BUTTS D A,SHATZ C J,et al.Regulation of CNS synapses by neuronal MHC classⅠ[J].PNAS,2007,104:6828-6833.
[6]MASATO O,HIDETOSHI I,JERZY K K,et al.Major histocompatibility complex(MHC)classⅠb gene duplications,organization and expression patterns in mouse strain C57BL/6[J].BMC Genomics,2008,9:178.
[7]谢维.MHC基因多态性和肿瘤的发生[J].现代免疫学,2004,24(6):441-444.
[8]KLEIN J.Seeds of time:fifty years ago Peter A.Gorer discovered the H-2 complex[J].Immunogenetics,1986,24:331-338.
[9]SNELL G D.Some recollections of Peter Gorer and his work on this fiftieth anniversary of his discovery of H-2[J].Immunogenetics,1986,24:339-340.
[10]RALL G F,MUCKE L,OLDSTONE M B,et al.Consequences of cytotoxic T lymphocyte interaction with major histocompatibility complex class Ⅰ-expressing neurons in vivo[J].Exp Med,1995,182:1201-1212.
[11]顾香芳,甘光明,王芳,等.应用原位杂交技术分析ZNF216基因在成年小鼠各主要组织中的表达模式[J].东南大学学报:医学版,2005,24(1):1-4.
[12]SHATZ C J.MHC classⅠ:an unexpected role in neuronal plasticity[J].Neuron,2009,64:40-45.
[13]MCCONNELL M J,HUANG Y H,DATWANI A,et al.H2-Kb and H2-Db regulate cerebellar long-term depression and limit motor learning[J].Science,2009,106:6784-6789.
[14]BOULANGER L M.Immune proteins in brain development and synaptic plasticity[J].Neuron,2009,64:93-109.
[15]ADELSON J D,BARRETO G E,XU L J,et al.Neuroprotection from stroke in the absence of MHC Ⅰ or Pir B[J].Neuron,2012,73:1100-1107.
[16]ZHONGQI P W,TINA B,NATHALIE E B,et al.Major histocompatibility complex classⅠ-mediated inhibition of neurite outgrowth from peripheral nerves[J].Immunology Letters,2011,135:118-123.
[17]ZHONGQI P W,LORRAINE W,TINA V B,et al.Enhanced neuronal expression of major histocompatibility complex classⅠleads to aberrations in neurodevelopment and neurorepair[J].J Neuroimmunol,2011,232:8-16.
[18]DENG X H,AI W M,LEI D L,et al.Lipopolysaccharide induces paired immunoglobulin-like receptor B(PirB)expression,synaptic alteration,and learning-memory deficit in rats[J].Neuroscience,2012,209:161-170.
