免疫性内耳病模型的建立及其内耳干扰素-γ的表达
2013-09-03马荧雪谭长强曹影王培蓓陈智斌
马荧雪,谭长强,曹影,王培蓓,陈智斌
(1.南京医科大学第一附属医院耳鼻咽喉科,江苏 南京 210029;2.南京大学医学院附属鼓楼医院耳鼻咽喉-头颈外科,江苏南京 210008)
免疫性内耳病(immune-mediated inner ear disease,IMIED)是指由内耳免疫反应造成的内耳组织病理损伤和功能障碍,包括内耳局部的免疫炎性疾病和自身免疫性内耳疾病。由于其可导致极其严重的、反复发作性眩晕、听力障碍等症状,目前临床治疗效果亦不甚满意,给患者的工作乃至生活造成极大的困难和障碍,已有许多耳科学家们对其进行了大量的动物实验和临床观察研究,并取得了不少新发现和成果,但其病因至今尚未完全明确。
干扰素-γ(IFN-γ)是细胞因子超家族中IFN家族的重要成员,具有抗病毒、抗肿瘤及免疫调节等多种生物学功能,在CD4+细胞参与的免疫反应中,IFN-γ是由Ⅰ型辅助细胞T细胞(Th1细胞)产生,并被定义为Th1途径的标志性细胞因子。Solares等[1]研究表明,CD4+T细胞参与IMIED的发生发展,其分化产生的细胞因子与内耳免疫损伤密切相关。作者以往通过淋巴细胞转化试验研究证实IMIED存在T细胞的参与[2]。Fuse等[3]研究表明,在梅尼埃病相关的急性低频感音神经性聋患者血清中,Th1细胞因子IFN-γ水平明显增高,推断IFN-γ在IMIED发生发展中占据重要地位。
基于上述各项研究发现和现状,本实验拟采用钥孔戚血蓝蛋白(keyhole limpet hemocyani,KLH),经圆窗龛局部免疫已被KLH致敏的豚鼠,制作IMIED模型,观察并分析正常豚鼠和IMIED模型豚鼠内耳IFN-γ的表达和变化,为进一步的相关细胞免疫及临床研究等提供依据和参考。
1 材料和方法
1.1 实验动物
健康成熟豚鼠,6~8周龄,白毛红目,雌雄不限,体重250~300 g,耳郭反射正常,耳镜检查排除中耳疾患。所用动物由南京市青龙山实验动物繁殖场提供[实验动物许可证号:SCXK(苏)2007-0008]。
1.2 抗原
KLH为一种深海软体动物体内提取的纯化蛋白,购自美国Sigma公司。
1.3 实验分组及模型制作
1.3.1 实验分组 20只豚鼠按配对设计方法,分为实验组和对照组。实验组动物采用KLH免疫(包括全身致敏和圆窗龛局部免疫),对照组用PBS代替KLH免疫。
1.3.2 免疫方法[4]首次免疫采用500 μg KLH 溶解于 250 μl PBS(0.01 mol·L-1,pH 7.4)中,与等量完全弗氏佐剂混匀、乳化,于豚鼠右后足垫注射。首次免疫 2 周后,采用 500 μg KLH 溶解于 250 μl PBS(0.01 mol·L-1,pH 7.4)中,与等量不完全弗氏佐剂混匀、乳化,于豚鼠背部多点皮下注射加强免疫。加强免疫2周后,采用KLH溶液在已致敏豚鼠圆窗龛局部免疫,具体操作方法:1%的戊巴比妥钠(30 mg·kg-1)腹腔注射麻醉豚鼠,在右侧耳郭后上方备皮、消毒后,做一1.5~2.0 cm弧形切口,分离并暴露听泡,用电钻在听泡上钻一直径约0.5 cm的圆孔,显露圆窗龛。在手术显微镜下将一小片吸附5 mg·ml-1KLH(PBS稀释)的明胶海绵放置于圆窗龛局部,在中耳腔中滴抗生素(0.3%氧氟沙星滴耳液约0.2 ml)后缝合切口,全部过程严格遵守无菌操作。对照组动物用PBS代替KLH免疫,方法相同。
1.3.3 模型判断标准 圆窗龛局部免疫2周后,豚鼠血清中KLH特异性抗体水平升高(酶联免疫吸附试验即ELISA法检测,波长490 nm A值超过免疫前全部实验动物的均值加2倍标准差)和听觉诱发电位Ⅲ波的阈值升高(即Ⅲ波阈值超过免疫前全部实验动物的均值加2倍标准差),判断为IMIED动物模型制作成功。
1.4 观察指标
1.4.1 特异性免疫反应测试 采用ELISA法测定血清中特异性抗KLH抗体水平。2次测试分别于免疫前和圆窗龛局部免疫后2周进行。心脏采血,分离血清,用 100 μg·ml-1的 KLH 溶液包被 96 孔酶联板,于4℃过夜并封闭,加入1∶10稀释的豚鼠血清,37℃孵育2 h,洗板5次,加入1∶2 000稀释的辣根过氧化物酶标记的葡萄球菌蛋白A(horse radish peroxidase marked staphylococal protein A,HRP-SPA),37 ℃下孵育1 h,洗板5 次,加入3,3,5,5-四甲基联苯胺底物溶液,显色10 min后用H2SO4终止显色,在酶标仪下测定波长为490 nm的A值。
1.4.2 听性脑干诱发电位测试 分别于免疫前和末次免疫后2周进行,采用听觉诱发电位测试系统,豚鼠头顶冠状缝与矢状缝交界处插入针形电极作为测试电极,参考电极置于耳郭后方靠近乳突尖部,接地电极置于对测乳突尖部,刺激声信号采用Click,重复频率为11次·s-1,叠加1 024次,记录时程10 ms,测定Ⅲ波的阈值。
1.4.3 石蜡切片制作、HE染色和光镜观察 末次听觉测试后,选取实验组造模成功动物(7只,12耳)及对照组所有动物内耳制作石蜡切片。具体方法:动物麻醉后断头,立即取出颞骨,打开听泡,放置于4%多聚甲醛固定液中,12 h后换EDTA脱钙7~10 d,修剪后流水冲洗1~2 h,常规脱水、透明、浸蜡、定向包埋。耳蜗中轴切片,片厚5 μm,漂片、捞片、粘片,常规HE染色,封片,置于光镜下观察内耳结构病变。
1.4.4 酶免疫组化试验 末次听觉测试后,选取实验组造模成功动物(7只,12耳)及对照组所有动物,麻醉后断头,立即取出颞骨,石蜡切片制作方法同上述。用胰酶(0.2%)修复抗原,正常山羊血清封闭10 min,加PBS稀释的一抗,即大鼠抗小鼠IFN-γ单克隆抗体,4℃过夜,PBS洗5 min 3次,加入HRP标记的兔抗大鼠IgG单克隆抗体作为二抗,37℃孵育30 min,PBS洗5 min 3次,DAB染色,封片,光学显微镜观察摄片。以上试剂均购自武汉博士德生物工程有限公司。
1.5 统计学处理
经正态性检验,各组血清中KLH的特异性抗体水平(A值)、ABRⅢ波阈值的结果符合正态分布,所得数据以±s表示,应用SPSS 13.0软件对数据进行统计分析(配对t检验),P<0.05判断为差异具有统计学意义。
2 结 果
2.1 特异性免疫反应测试结果
见表1。
表1 免疫前后两组血清特异性KLH抗体水平(A值±s)Tab 1 Specific antibody capability of KLH from the blood serum of each group before and after the immunization(A value,x±s)

表1 免疫前后两组血清特异性KLH抗体水平(A值±s)Tab 1 Specific antibody capability of KLH from the blood serum of each group before and after the immunization(A value,x±s)
a与免疫前比较,P<0.05
组 别A 值免疫前 免疫后实验组 0.544±0.111 0.817±0.129a对照组 0.537±0.111 0.526±0.124 P值 >0.05 <0.05
两组比较,免疫前血清中KLH抗体平均水平差异无统计学意义(P>0.05),免疫后则差异具有统计学意义(P<0.05)。组内免疫前后比较,实验组免疫后血清KLH抗体水平明显增高(P<0.05),对照组差异无统计学意义(P>0.05)。
2.2 听性脑干诱发电位测试结果
见表2和图1。

表2 免疫前后各组ABRⅢ波阈值测试结果(x±s)dB,SPLTab 2 Result of threshold of ABRⅢwave from each group before and after the immunization(x±s)dB,SPL
免疫前所有动物ABRⅢ波的阈值:x=30.38,s=5.36,x+2s=41.10 dB。对照组动物在免疫后ABRⅢ波的阈值均小于41.10 dB,免疫前后ABRⅢ波的阈值均值差异无统计学意义。免疫后实验组ABR听阈值大于41.10 dB动物有7只12耳。ABRⅢ波的阈值均值两组间比较,免疫前差异无统计学意义(P>0.05),免疫后则差异有统计学意义(P<0.05)。组内免疫前后比较,实验组免疫后ABRⅢ波的阈值均值明显增高(P<0.05),对照组差异无统计学意义(P>0.05)。

图1 免疫后ABR测试结果 A.对照组1只动物Ⅲ波正常显示,随刺激声强递减,潜伏期逐渐延长;B.实验组1只动物最大声强输出(90 dB,SPL)未诱导出明显的ABR波型Fig 1 The result of ABR test A.Ⅲ wave of one animal in the control group was normal,and the delitescence increasingly delayed with the stimulation sound intensity decreasing;B.ABR wave of one animal was not induced with the highest sound intensity output(90 dB,SPL)in experimental group
2.3 内耳光镜观察结果
见图2、3。免疫后实验组造模成功动物内耳均出现较为显著的炎症反应,主要表现包括Rosenthal's管中和螺旋神经节内出现炎症细胞(单个核细胞为主)浸润,螺旋神经节细胞变性(主要表现为胞体肿胀)和部分耳螺旋神经节细胞数减少,蜗管及鼓阶或前庭阶可见絮状物;部分豚鼠出现不同程度迷路积水;Corti器及毛细胞形态未见明显异常。对照组动物内耳结构未见明显异常。
2.4 酶免疫组化试验
对照组内耳几乎没有IFN-γ阳性免疫反应;实验组造模成功耳观察到明显的IFN-γ阳性免疫反应,主要分布在血管纹、螺旋韧带、螺旋神经节、Corti器及蜗轴小血管周围。见图4。
3 讨 论
1979年McCabe[4]经临床观察研究首先提出了自身免疫性感音神经性聋(autoimmune sensorineural hearing loss,ASNHL)的概念。此后,一类由免疫介导的内耳损害所致的疾病或症状群陆续被报道,统称为IMIED。大量的动物实验和临床观察研究表明,内耳并非免疫豁免部位,它具有不同于一般的免疫机制,呈一独立的免疫状态,内淋巴囊是内耳免疫反应的主要部位。由于不可能直接在人体上获取标本进行观察研究,因此通过免疫动物建立模型是目前研究IMIED的主要方法。用于建立内耳病模型的抗原主要有Ⅱ型胶原、Ⅸ型胶原、P0蛋白、热休克蛋白70、同种纯化内耳抗原、β-微管蛋白、KLH等。本实验采用KLH免疫豚鼠建立IMIED动物模型。

图2 两组螺旋神经节的光镜观察结果 A.对照组,神经节细胞数量和形态正常 HE 40×10;B.实验组,部分神经节细胞肿胀或数量减少 HE 40×10Fig 2 Result of light microscopic A.Showed the spiral ganglion of the control group,the number and morphology of the ganglion cell were normal HE staining 40×10;B.Showed the spiral ganglion of the experimental group ,the number and morphology of the ganglion were normal HE staining 40×10
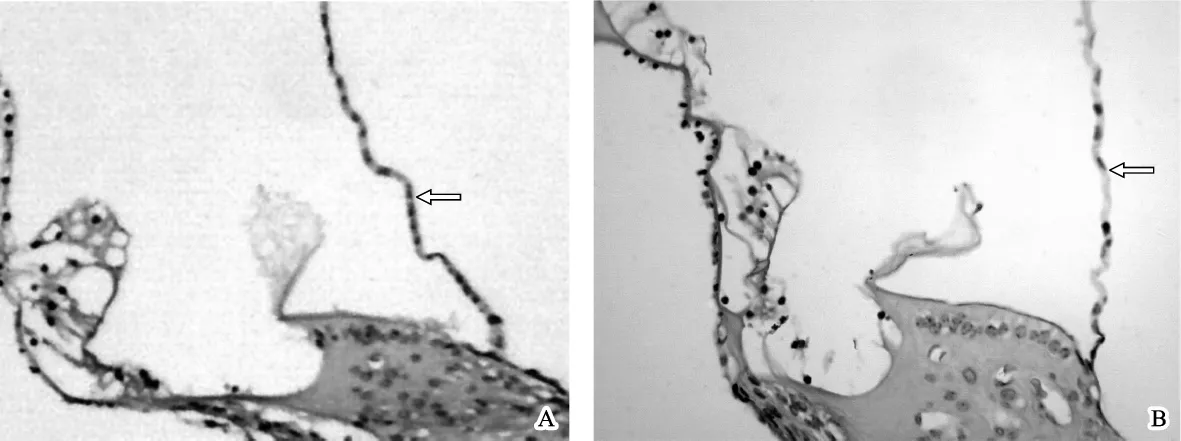
图3 两组蜗管横切面的光镜观察结果 A.对照组,Corti器和前庭膜位置、形态基本正常 HE 40×10;B.实验组,Corti器形态基本正常,但前庭膜呈现隆起状 HE 40×10Fig 3 Result of light microscopic exzamination A.Showed the transverse section of the cochlear duct of the control group ,the position and the morphology of the vestibular membrane and the organ of Corti were normal HE staining 40 ×10;B.Showed the transverse section of the cochlear duct of the experimental group,the morphology of the organ of Corti was normal,however,the vestibular membrane was found eminence HE staining 40×10
KLH提取于软体动物,是一种很强的细胞依赖性大分子抗原,被广泛应用于诱导免疫反应。Woolf和Ma等[5-6]将KLH直接注入已被KLH系统致敏的动物内耳,造成较为严重的听力损失,且听力损伤的发生率非常高,即成功建立了免疫性感音神经性聋动物模型。但由于该法可能会直接破坏内耳结构,且这种模型产生的听力损失也很难治疗。邹静等[7]用KLH在圆窗豚鼠部位免疫,用MRI在活体内观测到KLH免疫诱导的膜迷路积水,并同时检测到听力损失的存在。本实验采用KLH全身致敏豚鼠后,再在圆窗龛局部免疫,经特异性免疫试验和听觉功能测定,成功地建立了免疫性感音神经性聋动物模型,而且造模成功率高达约60%。ELISA法测定显示免疫后实验组豚鼠血清中特异性KLH抗体水平较免疫前明显增高。内耳切片观察显示,模型动物内耳蜗管内有絮状物,蜗轴等部位有炎症细胞浸润,部分动物出现不同程度膜迷路积水等。

图4 两组免疫组化结果 A.对照组,未见明显IFN-γ表达 40×10;B.实验组,可见螺旋神经节、Corti器、血管纹、血管内皮等部位有明显IFN-γ表达 40×10Fig 4 Result of immunohistochemical test A.No IFN-γ expression was detected in the inner ears of the control group 40 ×10;B.The IFN-γ expression was detected in the inner ears of the experimental group as following sections:organ of Corti,spiral ligament,stria vasculais 40×10
目前,根据细胞因子分泌模式,CD4+T细胞可分为Th1和 Th2细胞亚群:Th1主要分泌 IL-2、IFN-γ、TNF-α和TNF-β,统称为Th1型细胞因子;Th2主要分泌 IL-4、IL-5、IL-6、IL-10 和 IL-13,统称为 Th2型细胞因子[8]。Th1主要介导细胞免疫、细胞毒性T淋巴细胞(cytotoxic T lymphocyte,CTL)和巨噬细胞活化以及迟发型超敏反应(delayed type hypersensitivity,DTH);Th2主要介导体液免疫、B细胞和嗜酸粒细胞活化以及IgE的生成。IFN-γ能抑制Th2细胞因子产生,并能上调诱导炎症细胞浸润的黏附分子[9]。在很多自身免疫性疾病如类风湿关节炎(rheumatoid arthritis,RA)、莱姆病(lyme disease,LD)、多发性硬化症(multiple sclerosis,MS)等中存在Th1和Th2细胞因子的不平衡。Pawankar等[10]研究表明,IFN-γ在免疫介导的内耳病发生中发挥重要作用。本实验项目前期试验中,采用IL-10[11-12]、IL-4[13]等 Th2细胞因子基因导入 IMIED动物模型内耳的方法,提高Th2细胞因子优势,发现对IMIED动物模型听力损失的改善有统计学意义,即治疗有效。推测在IMIED发生发展中TH1免疫途径可能占优势。本实验动物模型内耳切片ELISA试验发现在血管纹、螺旋神经节,Corti器、蜗轴小血管内皮及其周围等部位有明显的Th1细胞因子IFN-γ阳性反应,而在对照组的内耳切片中几乎没有IFN-γ免疫反应,从而提示:正常状态下,内耳几乎或极少存在Th1细胞因子IFN-γ,在免疫诱导下,其含量显著增多,在IMIED的发生中可能起着重要作用,即IMIED发病机制中Th1途径占优势。具体的作用机制尚待进一步研究和观察。目前对IMIED主要是由细胞免疫还是体液免疫起主要作用、亦或两者均起作用、或在不同病理情况下两者的作用机制尚无定论。本项研究结果证实,细胞免疫机制在IMIED的发生中肯定起着重要作用。所以我们的结论是:KLH经圆窗诱导的IMIED模型的成功率较高;正常豚鼠内耳中几乎没有IFN-γ表达,IMIED豚鼠内耳中IFN-γ的表达显著,提示IMIED的发生可能与IFN-γ表达有关。
[1]SOLARES C A,EDLING A E,JOHNSON J M,et al.Murine autoimmune hearing loss mediated by CD4+T cells specific for inner ear peptides[J].J Clin Invest,2004,113(8):1210-1217.
[2]谭长强,银华,刘桦.自身免疫性梅尼埃病的体液与细胞转移免疫示踪研究[J].东南大学学报:医学版,2002,21(1):24-27.
[3]FUSE T,HAYASHI T,OOTA N,et al.Immunological responses in acute low-tone sensorineural hearing loss and Ménière's disease[J].Acta Otolaryngol,2003,123(1):26-31.
[4]McCABE B F.Autoimmune sensorineural hearing loss[J].Ann Otol Rhinol Laryngol,1979,88(5 Pt 1):585-589.
[5]WOOLF N K,HARRIS J P.Cochlear pathophysiology associated with inner ear immune responses[J].Acta Otolaryngol,1986,102(5-6):353-364.
[6]MA C,BILLINGS P,HARRIS J P,et al.Characterization of an experimentally induced inner ear immune response[J].Laryngoscope,2000,110(3 pt 1):451-456.
[7]邹静,ILMARI P,BRJE B.用MRI体内观测钥孔嘁血蓝素中耳免疫诱导的内淋巴积水的初步探讨[J].中华耳科学杂志,2005,3(3):200-203.
[8]ABBAS A K,MURPHY K M,SHER A.Functional diversity of helper T lymphocytes[J].Nature,1996,383(6603):787-793.
[9]DUSTIN M L,ROTHLEIN B R,BHAN A K,et al.Induction by IL-1 and interferon-g:tissue distribution,biochemistry,and function of a natural adherence molecule(ICAM-1)[J].J Immunol,1986,137(1):245-254.
[10]PAWANKAR R,TOMIYAMA S,IKEZONO T,et al.Interferon-gamma expression in the inner ear of rats following secondary immune reaction in the endolymphatic sac[J].Acta Otolaryngol Suppl,2004(553):6-12.
[11]蔡文君,谭长强,李玉瑾.自身免疫性感音神经性聋基因治疗的实验研究[J].东南大学学报:医学版,2009,28(2):79-84.
[12]陈文博,谭长强,董伟达,等.IL-10基因内耳局部治疗自身免疫性感音神经性聋的实验研究[J].东南大学学报:医学版,2010,29(3):262-267.
[13]郭浪,谭长强,崔毓桂,等.慢病毒载体介导IL-4基因修饰内耳BMSCs局部应用治疗免疫性感音神经性聋的实验研究[J].东南大学学报:医学版,2011,30(2):298-306.
