流行性乙型脑炎prM蛋白剪切位点突变的prM-E蛋白表达细胞系的建立
2013-08-30李业南陈振师步志高华荣虹
李业南,陈振师,步志高,华荣虹
(中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室,黑龙江哈尔滨 150001)
流行性乙型脑炎病毒(Japanese encephalitis virus,JEV)属于黄病毒科黄病毒属,是一种由蚊子传播的能够引起严重中枢神经系统疾病的虫媒人兽共患病原,主要流行于东亚及东南亚国家和地区[1-2],除严重危害人类健康外[3],还可以引起妊娠母猪流产、死胎或木乃伊胎及公猪的睾丸炎,从而对养殖业造成严重的损失。
JEV基因组为单股正链RNA,全长11 000 nt左右,只含有1个长的开放阅读框(ORF),编码3种结构蛋白和7种非结构蛋白,其中C蛋白是JEV的衣壳蛋白,它与病毒基因组结合,保护病毒RNA,还具有转录调节的作用。E蛋白为乙脑病毒的囊膜蛋白,与细胞表面受体结合而使病毒进入细胞,与血凝反应、组织嗜性、诱导产生保护性中和抗体等密切相关,是重要的抗原成份。prM蛋白是病毒诱导机体产生保护性免疫的重要协同成份,E蛋白需要prM共表达才能正确折叠、在低pH环境下保持稳定和分泌到胞外[4]。
研究表明,在病毒粒子的成熟过程中,前体蛋白prM由能识别病毒prM剪切位点编码氨基酸基序R89XRR92的furin酶水解剪切产生M蛋白和pr短肽[5]。本实验为建立能稳定共表达不发生剪切的prM蛋白和E蛋白的细胞系,采用PCR方法突变prM序列,与E蛋白基因序列串联克隆于真核表达载体中,转染BHK-21细胞,构建稳定表达prM-E的细胞系,表达的prM的前体多肽序列不发生剪切,同时也并不影响E蛋白的表达。该细胞系的建立对进一步研究prM剪切位点突变对病毒粒子的成熟影响以及亚单位疫苗的制备均具有参考价值。
1 材料和方法
1.1 质粒、细胞系及菌种 表达载体质粒pCAG-neo、菌种E.coliDH5α感受态细胞和BHK-21细胞均由哈尔滨兽医研究所兽医生物技术国家重点实验室保存。
1.2 主要试剂和材料 PrimeSTARTMHS DNA Polymerase、T4 DNA连接酶、限制性内切酶购自宝生物工程(大连)有限公司;核酸凝胶回收试剂盒购自OMEGA Bio-Tek公司;G418购自Gibco公司;抗JEV E蛋白与prM蛋白单克隆抗体(MAb)由本实验室制备[6-7];红外荧光染料标记的山羊抗小鼠IgG抗体(DyLight-IgG)购自KPL公司;FITC标记山羊抗小鼠IgG(FITC-IgG)购自北京中杉金桥生物技术有限公司;FuGENERHD Transfection Reagent转染试剂盒购自Roche公司。
1.3 prM剪切位点定点突变 根据JEV序列(D90195)设计引物(表1),以本研究室构建的含编码JEV prM-E蛋白密码子优化基因的重组质粒pCAG-JEV-ME(待发表)为模板,通过PCR方法,将prM剪切位点的第89位氨基酸从精氨酸突变为丙氨酸(R89A);同时将SacⅠ、SapⅠ、XhoⅠ3个新的酶切位点引入到扩增片段中。
表1 PCR扩增引物表Table 1 Primers used formutagenesis and PCR amplification
1.4 重组真核表达质粒的构建 将PCR扩增产物pr基因、M-E基因分别经SacⅠ/SapⅠ、SapⅠ/XhoⅠ双酶切,经过T4连接酶作用克隆到经SacⅠ/XhoⅠ处理的载体pCAG-neo,构建重组质粒命名为pCAG-JEV-prM(R89A)E(图1),重组质粒经SacⅠ单酶切以及SacⅠ与XhoⅠ双酶切鉴定,并进一步进行测序验证。

图1 prM蛋白剪切位点氨基酸突变及引物示意图Fig.1 Schematic diagram of the site-directed mutagenesis and the primer
1.5 细胞系的制备及筛选 利用ScaI线性化重组质粒。回收线性化重组质粒,参照FuGENERHD Transfection Reagent转染试剂盒说明书操作,将线性化质粒转染到24孔板中的单层BHK-21细胞中,转染48 h后更换含G418的选择性培养基进行培养,第4 d后以有限稀释法进行细胞克隆纯化。转染细胞的克隆筛选方法参照文献[8]进行。
1.6 稳定表达prM(R89A)-E蛋白的细胞系的鉴定
1.6.1 间接免疫荧光实验(IFA)鉴定将克隆细胞接种至12孔板中,24 h后弃培养液,用4%多聚甲醛室温固定细胞30 Min,含0.1%的Triton X-100 4℃渗透细胞10m in,4%BSA封闭液37℃封闭30m in,以鼠抗prM蛋白和E蛋白的MAb为一抗(1∶1 000),以FITC标记的山羊抗小鼠IgG(FITC-IgG)为二抗(1∶200),采用 DAPI(1∶500)进行细胞核染色,在荧光显微镜下观察结果。
1.6.2 Western blot鉴定取细胞上清,进行SDS-PAGE凝胶电泳,转印后的硝酸纤维素膜采用5%PBST脱脂乳封闭,一抗为500倍稀释的小鼠抗prM蛋白和E蛋白MAb,二抗为5 000倍稀释的山羊抗小鼠DyLight-IgG,利用Odyssey红外荧光扫描仪检测结果。
2 结 果
2.1 真核表达构建体pCAG-JEV-prM(R89A)E的构建鉴定 将重组真核表达质粒分别用ScaⅠ单酶切以及SacⅠ与XhoⅠ双酶切鉴定,酶切后预期分别得到9 000 bp及7 000 bp,2 100 bp的DNA片段。电泳结果显示与酶切后预期带型分布相符合(图2)。进一步测序证明扩增所得目的片段的核酸序列符合设计要求的突变结果。

图2 重组质粒pCAG-JEV-prM(R89A)E的酶切鉴定Fig.2 Identification of pCAG-JEV-prM(R89A)E by restriction enzyme digestions
2.2 细胞转染与IFA鉴定检测 将线性化的重组质粒pCAG-JEV-prM(R89A)E转染BHK-21细胞。转染48 h后以IFA检测prM与E蛋白的表达,结果表明prM与E蛋白在转染细胞内均能够表达(图3)。
图3 间接免疫荧光检测转染细胞中蛋白的表达Fig.3 Identification of the protein expression by IFA
2.2.1 转染细胞的克隆筛选与IFA鉴定细胞转染后第一代即能呈现较强的绿色荧光信号,通过有限稀释法在96孔板中培养,同时以含G418的选择性培养基因进行选择培养。克隆孔中细胞经IFA检测后挑选阳性的单克隆在24孔板中扩大培养。经过多次筛选,得到一个IFA信号较强的细胞克隆,而且该细胞克隆经传代至第10代时,仍能够稳定表达目的蛋白,而且阳性细胞率在可见范围内为100%(图 4)。
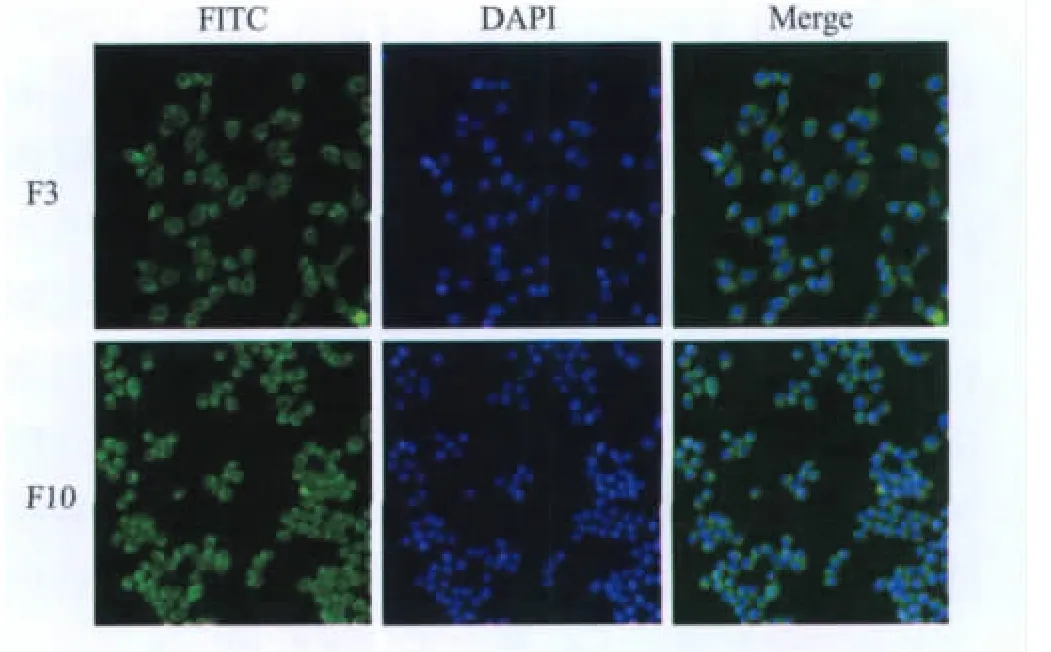
图4 IFA检测不同代次细胞系中蛋白的表达Fig.4 Identification of the protein expression in the cell line BHK-21 of different generations by IFA
2.2.2 表达蛋白的western blot鉴定为了进一步验证候选阳性克隆细胞中prM蛋白和E蛋白的表达,收集所得细胞克隆培养上清液,通过western blot进行检测。其中所有样品在53 ku和20 ku左右分别有一条带,表达未突变的prM-E蛋白的细胞系(未发表资料)在约10 ku处有一条带,为经剪切加工的成熟M蛋白,而表达突变的prM-E蛋白的细胞系中,所选取的3个克隆细胞均只出现prM带,而无成熟的M蛋白条带(图5)。

图5 Western blot检测细胞系中蛋白的表达Fig.5 Identification of the protein expressed in the cell lines by western blot
3 讨 论
研究表明,黄病毒属病毒粒子的成熟过程中prM蛋白在反面高尔基网(TGN)的弱酸性环境下被furin酶剪切为M蛋白和pr短肽[9-12],在此过程中,由E/prM组成的异源二聚体结构发生解离,产生由E蛋白组成的90个同源二聚体组成病毒样颗粒(VLP)[13-14],然后释放到细胞外。
本实验为构建能够稳定表达剪切位点突变的prM蛋白和E蛋白的细胞系,在furin蛋白酶所识别的prM剪切位点上设计了一个突变,将第89位精氨酸突变为丙氨酸,构建了重组真核表达质粒并转染BHK-21细胞,研究结果表明:prM蛋白剪切位点的突变能够造成prM蛋白不发生剪切,而并不会影响E蛋白的表达。将筛选出的阳性细胞建立细胞系后,表明其E蛋白的表达量与未突变株相比亦没有发生太大变化。根据Nakayama等通过共表达总结的规律:以序列P4P3P2P1↓P1'为代表Furin识别序列中,其中P1为Arg至关重要,并且P1'的氨基酸残基不具有疏水性侧链[15],至于单个氨基酸由疏水性变为亲水性,是否改变了蛋白质的理化性质,需要进一步验证,可以确定的是整个蛋白质的理化性质与氢键力、范德华力、静电力、亲疏水基的相互作用等众多因素有关,所以在本文中可初步认为对蛋白质理化性质影响不大。
E蛋白是乙脑病毒的主要结构蛋白,并具有中和活性和血凝活性,能够刺激机体产生中和抗体,保护机体免受病毒攻击,诱导宿主产生免疫应答等功能。E蛋白一般是作为研发JEV亚单位疫苗、DNA疫苗的靶蛋白,应用JEV prM-E基因制备亚单位疫苗的研究已有很多报道[16-17],此外,Konishi等人发现,病毒的E蛋白和剪切后形成的M蛋白在细胞中积累,对宿主细胞造成一定细胞毒性[18]。因此本实验通过针对剪切位点的突变以达到使prM蛋白不发生剪切的目的,以期消除M蛋白积聚所造成的消极影响。这对于乙脑病毒的成熟过程的研究以及亚单位疫苗的制备都有重要的作用,目前我们正在进行该细胞系的稳定培养与表达蛋白纯化,以期进一步研究prM蛋白剪切对JEV病毒样粒子以及病毒样颗粒的形成及其特性的影响。
[1]Dhanda V,Thenmozhi V,Kumar N P,et al.Virusisolation from w ild-caught mosquitoes during a Japanses encephalitis outbreak in Keralain 1996[J].Indian JMed Res,1997,106:4-6.
[2]Schuh A J,Tesh R B.Genetic characterization of early isolates of Japanese encephalitis virus:genotypeⅡhas been circulating since at least 1951[J].JGen Virol,2010,91(1):95-102.
[3]Tsai T F.New initiatives for the control of Japanese encephalitis by vaccination:m inutes of a WHO/CVI meeting,Bangkok,Thailand,13-15 October 1998[J].Vaccine,2000,18(2):1-25.
[4]Mukhopadhyay S,Kuhn R J,Rossmann MG.A structural perspective of the flavivirus life cycle[J].Nat.Rev.M icrobiol,2005,3(1):13-22.
[5]Elshuber S,Allison S L,Heinz F X,et al.Cleavage of protein prM is necessary forinfection of BHK-21 cells by tick-borne encephalitis virus[J].JGen Virol,2003,84:183-191.
[6]赵付荣,华荣虹,王斌,等.流行性乙型脑炎E蛋白单克隆抗体的制备与鉴定[J].中国兽医杂志,2010,46(1):3-5.
[7]Hua Rong-hong,Bu Zhi-gao.A monoclonal antibody against prM/M protein of Japanese encephalitis virus[J].Hybrodoma,2011,30(5):451-456.
[8]陈振师,刘立科,华荣虹,等.乙型脑炎NS1蛋白稳定表达细胞系的建立[J].中国预防兽医学报,2011,33(12):920-923.
[9]Li Long,Lok S M,Yu I M,et al.The flavivirus precursor membrane-envelope protein complex:structure and maturation[J].Science,2008,319:1830-1834.
[10]Mackenzie JM,Westaway E G.Assembly and maturation of the flavivirus Kunjin virus appear to occur in the rough endoplasm ic reticulum and along the secretory pathway,respectively[J].Virol,2001,75:10787-10799.
[11]Theodore C P,M ichael S D.Degrees of maturity:the complex structure and biology of flaviviruses[J].Cur Opini Virol,2012,2:168-175.
[12]Welsch S,M iller S,Romero-Breyi I,et al.Composition and three-dimensional architecture of the dengue virus replication and assembly sites[J].Cell Host Microbe,2009,5:365-375.
[13]Yu IM,Holdaway H A,Chipman P R,et al.Association of the pr peptides w ith dengue virus at acidic pH blocksmembrane fusion[J].JVirol,2009,83:12101-12107.
[14]Heinz F X,Stiasny K,Puschner-Auer G,et al.Structural changes and functional control of the tick-borne encephalitis virus glycoprotein E by the heterodimeric association w ith protein prM[J].Virology,1994,198:109-117.
[15]Nakayama K.Furin:amammalian subtilisin/Kex2p-like endoprotease involved in processing of a wide variety of precursor proteins[J].Biochem J,1997,327(Pt 3):625-635.
[16]Zhang Fu-quan,Ma Wen-yu,Li Zhang,et al.Expression of particulate form of Japanese encephalitis virus envelope protein in a stably transfected Drosophila cell line[J].Virol,2007,4:17-26.
[17]Asato K,Atsushi Y,Hideki A,et al.Stable High-Producer cell clone expressing virus-Like particles of the Japanese encephalitis virus protein for a second-generation subunit vaccine[J].J Virol,2003,77:8745-8755.
[18]Konishi E,Fujii A,Mason PW.Generation and characterization of a mammalian cell line continuously expressing Japanese encephalitis virus subviral particles[J].Virol,2001,75:2204-2212.
