猪流行性腹泻病毒N蛋白核仁定位信号对宿主细胞周期的影响
2013-08-30刘随新陈建飞时洪艳刘孝珍
刘随新,石 达, 陈建飞, 张 鑫,时洪艳,刘孝珍,2,张 莎,2,王 璐,冯 力*
(1.中国农业科学院哈尔滨兽医研究所兽医生物技术国家重点实验室/猪传染病研究室,黑龙江哈尔滨 150001;2.东北农业大学,黑龙江哈尔滨 150030)
猪流行性腹泻(Porcine epidem ic diarrhea,PED)是由PED病毒(PEDV)引起的一种急性高度接触性肠道传染病,以肠炎为主要特征,对仔猪致死率高达90%[1],给养猪业造成了严重的经济损失。
PEDV属于α冠状病毒属,基因组为具有感染性的单股正链RNA,5'端具有帽子结构,3'端具有Poly(A)序列。PEDV主要的结构蛋白包括:纤突蛋白(S)、膜蛋白(M)、核衣壳蛋白(N)和小膜蛋白(E)[2]。其中PEDV N蛋白是一种磷酸化的并富含碱性氨基酸的结构蛋白,可以定位于细胞的核仁中,同时推测N蛋白可能参与细胞核仁的功能调节,干扰宿主细胞的周期,从而为病毒的复制提供条件[3-5]。
本研究根据本实验室前期工作鉴定的核仁定位信号,构建核仁定位信号缺失重组质粒pAc-GFP-dN,转染Vero E6细胞,利用激光共聚焦显微镜和流式细胞术观察核仁定位信号缺失的N蛋白的定位情况和转染细胞的周期变化,进而为N蛋白核仁定位信号对宿主细胞的影响提供了实验依据,为进一步研究PEDV的致病机制奠定了基础。
1 材料和方法
1.1 重组质粒、菌株和细胞 含有编码PEDV N基因的重组质粒pMD-N、真核表达载体pAc-GFP-C1、感受态E.coliDH5α和Vero E6细胞由本实验室保存。
1.2 主要试剂 限制性内切酶、T4DNA连接酶购自美国NEB公司;PrimerSTAR HS DNA聚合酶购自宝生物工程(大连)有限公司;LipofectamineTM2000购自Invitrogen公司;DMEM培养基、OPTI-MEM培养基和胎牛血清均购自Hyclone公司;质粒抽提试剂盒和胶回收试剂盒购自QIAGEN公司;细胞培养板购自Greierbio-one公司。
1.3 重组质粒的构建及鉴定 根据PEDV CV777株 N基因的全序列设计引物 N1U、N1L、N2U、N2L。以N1U和 N2L引物[N1U:5'-CCCAAGCTT ACCATGGCTTCTGTCAGCTTTC-3'(HindⅢ),N2L:5'-GGGCGGGATCCTTAATTTCCTGTGTCGGAG-3'(BamHⅠ)],扩增N基因,大小为1 326 bp。
核仁定位信号序列编码区位于N基因的211 bp~270 bp,共60 bp,N基因中核仁定位信号上游序列命名为N1,大小为210 bp,PCR扩增引物为N1U和N1L(5'-CAGAAAACACCCTCAGTACGAGGTTGT TCAATTCGCTCAC-3');核仁定位信号下游序列命名为N2,大小为1 056 bp,PCR扩增引物为N2U(5'-GTGAGCGAATTGAACAACCTCGTACTGAGGG TGTTTTCTGG-3')和N2L。将分别扩增的N1和N2按照凝胶回收试剂盒说明书进行凝胶回收,并以其为模板,以N1U和N2L为引物利用SOE-PCR的方法扩增核仁定位信号序列缺失基因dN。。
将PCR扩增产物dN和N基因采用凝胶回收,将两种回收产物和pAC-GFP-C1载体分别进行HindⅢ和BamHⅠ双酶切,回收酶切产物,按照5∶1的分子比例16℃连接过夜,转化感受态E.coliDH5α,培养后,提取重组质粒,由上海英俊生物技术有限公司测序。
1.4 转染Vero E6细胞 将重组质粒转染于60%~80%融合度的无抗生素培养的Vero E6细胞中。按LipofectamineTM2000说明书进行细胞转染。
1.5 共聚焦显微镜分析 重组质粒转染48 h后,弃培养液,细胞用冰预冷的50%甲醇和50%丙酮的固定液室温固定15 min,用PBS漂洗3次,每次5min,自然干燥,加入DAPI(100μg/mL),于4℃避光染核15 min,PBS漂洗3次,利用激光共聚焦显微镜分析核仁定位信号缺失后N蛋白在细胞内的定位情况。
1.6 流式细胞术检测宿主细胞周期的变化 重组质粒转染48 h后,弃培养液,用胰酶消化于1.5 ML离心管中,2 000 r/min 4℃离心5 min,PBS漂洗3次。按照说明书进行细胞的染核,利用流式细胞仪(FASCAria)检测细胞周期的变化。
2 结 果
2.1 N基因和dN基因的扩增 以pMD-N为模板,利用设计的特异引物扩增得到与预期大小相符的dN和N基因(图1)。
2.2 激光共聚焦显微镜分析dN蛋白在细胞中的定位情况 将pAc-GFP、pAc-GFP-N及pAc-GFP-dN分别转染于Vero E6细胞中,48 h后,利用激光共聚焦显微镜分析。激光共聚焦显微镜图片显示,在转染空载体pAc-GFP细胞中可以在细胞核质和细胞质中观察到绿色荧光,在转染pAc-GFP-N的细胞中,可以在细胞核仁及细胞质中观察到绿色荧光,而在转染pAc-GFP-dN的细胞中,则只能在细胞质中发现绿色荧光(图2),结果表明核仁定位信号的缺失导致dN蛋白丧失了在细胞核仁中定位的能力。
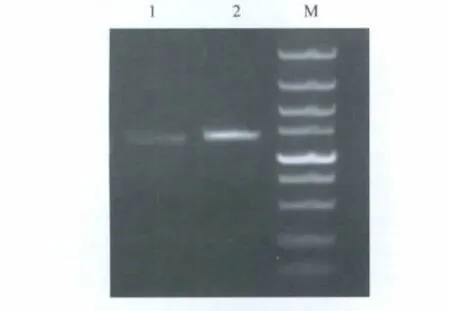
图1 dN和N基因扩增结果Fig.1 Amplification of N and dN genes by PCR
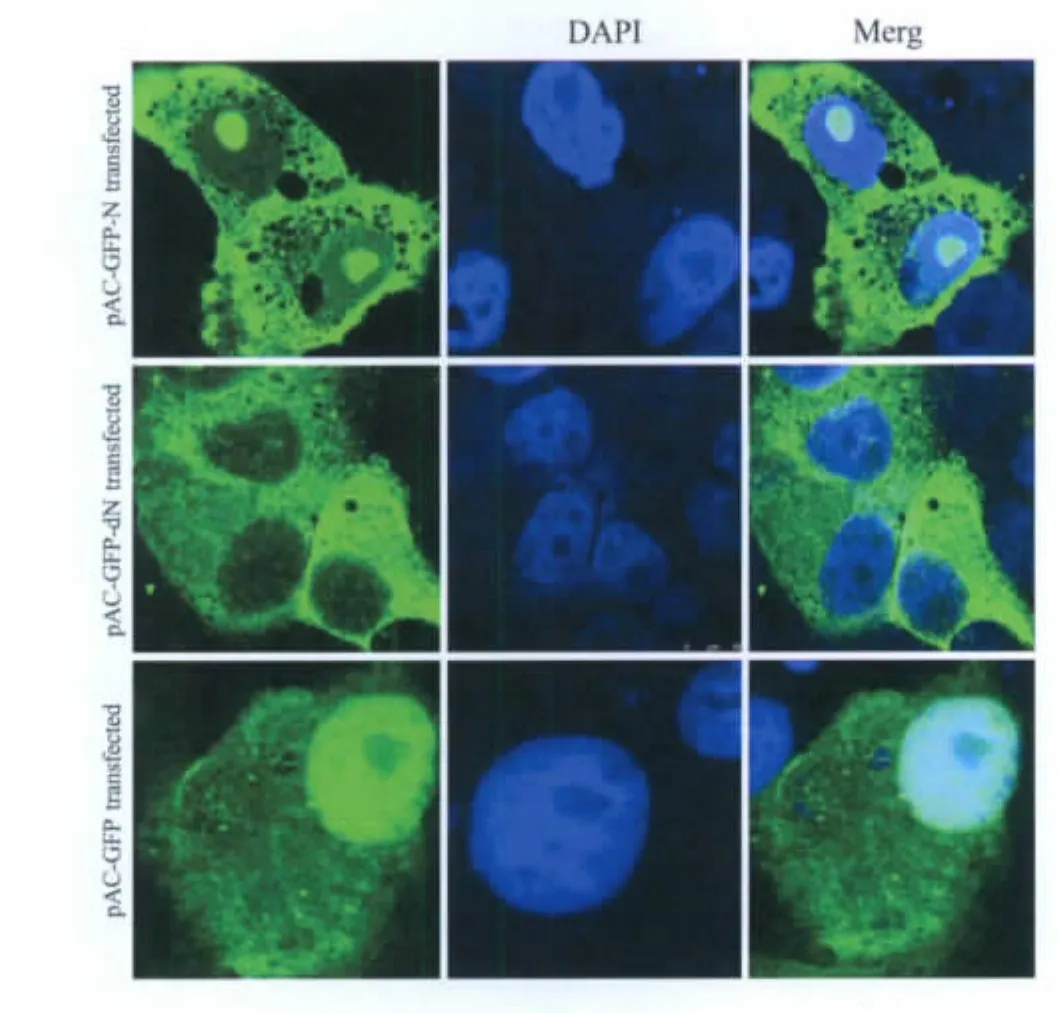
图2 激光共聚焦分析dN蛋白在细胞浆中的定位结果Fig.2 The subcellular localization of the expressed dN protein in cytoplasm of the transfected Vero E6 cells by confocal Microscope observation
2.3 细胞流式仪检测dN蛋白对细胞的周期变化影响 将pAc-GFP、pAc-GFP-N及pAc-GFP-dN分别转染于Vero E6细胞中,48 h后,利用流式细胞仪检测。结果表明,空白细胞对照组G0/G1期、S期及G2/M期细胞分别为60.4%、15.9%和10.1%;空载体对照组G0/G1期、S期及G2/M期细胞分别为58.1%、13.9%,13.4%;在转染pAc-GFP-N细胞中G0/G1期、S期及G2/M期分别为57.9%、13.5%和20.5%,与空白细胞对照组,空载体对照组相比较显示:G2/M期明显增多。而转染pAc-GFP-dN细胞中G2/M期细胞则与正常对照组细胞相似,G0/G1期为61.9%,S期为12.0%,G2M期为11.9%(图3)。结果表明N蛋白可以调节细胞周期,使其在G2M期出现停滞现象,而核仁定位信号缺失之后,N蛋白丧失了使宿主细胞周期在G2/M期停滞的能力,表明N蛋白核仁定位信号在宿主细胞周期调节中起到重要作用。

图3 流式细胞仪检测dN蛋白对细胞周期影响结果Fig.3 Effection of the expressed dN protein on cell cycle by Flow Cytometry
3 讨 论
N蛋白为冠状病毒的主要结构蛋白之一,由377个至455个氨基酸组成,以具有高等电点、高丝氨酸含量为特征,是一种多功能的磷酸化蛋白,与病毒基因组RNA相互缠绕形成核衣壳,有6个~7个潜在的磷酸化位点,3个相对保守的结构域,位于中间的一个结构域能够与病毒的RNA前导序列结合,在病毒RNA合成过程中发挥着重要的作用。在感染病毒细胞中,N蛋白是表达量最高的病毒蛋白之一[6-8]。
作为单股正链RNA病毒,PEDV可以在宿主细胞的细胞质中完成所有的复制过程,但研究表明,在宿主细胞的细胞核中也可以发现病毒的N蛋白,这表明N蛋白中存在引导蛋白到细胞核中定位的信号,N蛋白借助这些信号和载体蛋白相互作用从而进入细胞核。大量的研究表明N蛋白借助核(核仁)定位信号转移到细胞核仁中参与细胞分离期的调节,从而有利于病毒的复制。Chen等研究推断人呼吸系统冠状病毒(SARS-CoV)N蛋白与核仁蛋白和纤维蛋白相互作用,使其重新分布,并抑制细胞的分裂[9],Wurm等推定鼠肝炎病毒和猪传染性胃肠炎病毒N蛋白可能延迟细胞周期来创造有利病毒复制的适宜条件[10-13]。
本研究根据本实验室前期鉴定的核仁定位信号,即位于N基因的核苷酸序列的第211位~270位,共60个核苷酸,利用激光共聚焦显微镜观察,确定缺失核仁定位信号的N蛋白丧失了在细胞核仁中定位的功能;并进行流式细胞仪的检测,可观察到转染含有完整核仁定位信号的N蛋白后,宿主细胞在G2/M期明显增加,而转染缺失核仁定位信号的dN蛋白的细胞,与正常细胞相似,在G2/M期无明显增加的现象。这与其他冠状病毒N蛋白对宿主细胞周期的影响相似,表明N蛋白通过在核仁中定位来调节宿主细胞的周期变化,从而有利于病毒在其体内的复制。同时对核仁定位信号的初步分析为进一步研究PEDV致病机制的阐明和基因疫苗的研制提供了新的依据。
[1]Pensaert MB,Debouck P.A new coronavirus-like particle associated w ith diarrhea in sw ine[J].Arch Virol,1987,58(3):243-247.
[2]陈建飞,冯力,时红艳,等.猪流行性腹泻病毒株蛋白基因的遗传变异及其原核表达[J].中国预防兽医学报,2007,29(11):856-861.
[3]Surjit M,Lal S K.The SARS-CoV nucleocapside protein:a protein w ith multifarious activities[J].Infect Genet Evol,2008,8(4):397-405.
[4]Dove B K,You J H,Reed ML,et al.Changes in nucleolar morphology and protein during infection with the coronavirus infectious bronchitis virus[J].Cell Microbiol,2006,8(7):1447-1157.
[5]Reed Ml,Dove B K,Jackson R M,et al.Delineation and modelling of a nucleolar retention signal in the coronavirus nucleocapside protein[J].Traffic,2006,7:833-848.
[6]Calvo E,Escors D,Lopez J A,et al.Phosphorylation and subcellular localization of transm issible gastroenteritis virus nucleocapside protein in infected cell[J].J Gen Virol,2005,86:2255-2267.
[7]Chen Hong-ying,Gill A,Dove B K,et al.Mass spectroscopic characterization of the coronavirus infectious bronchitis virus nucleoprotein and elucidation of the role of phosphorylation in RNA binding by using surfaceplasmon resonance[J].J Virol,2005,79(2):1164-1179.
[8]Jayaram J,Youn S,Collission E W.The virion Nprotein of infectious bronchitis virus ismore phosphorylatde than the N protein from infected cell lysates[J].Virology,2005,339:127-135.
[9]Chen Hong-ying,Wurm T,Britton P,et al.Interaction of the coronavirus nucleoprotein w ith nucleolar antigens and the host cell[J].JVirol,2002,76:5233-5250.
[10]Singh M.A novel internal open reading frame product expressed from a polycistronic of porcine epidem ic diarrhea virusmay not contribute to virus attenuation[J].J Gen Virol,1999,80:1959-1963.
[11]Wurm T,Chen Hong-ying,Hodgson T,et al.Localization to the nucleolus is a common feature of coronavirus nucleoproteins and the protein may disrupt host cell division[J].JVirol,2001,75:9345-9356.
[12]Hiscox J A,Wurm T,W ilson L,et al.The coronavirus infectious bronchitis virus nucleoprotein localizes to the nucleolus[J].JVirol,2001,75:506-512.
[13]Yoo D,Wootton S K,Gang Li,et al.Colocalization and interaction of the porcine arterivirus nucleocapsid protein w ith the small nucleolar RNA associated protein fibrillarin[J].J Virol,2003,77(22):12173-12183.
