吞噬凋亡淋巴细胞的未成熟树突细胞对脂多糖介导激活的抑制作用研究
2013-08-28魏玉香周文强肖漓郑德华齐帜蔡明钱叶勇于涛廖珂石炳毅
魏玉香,周文强,肖漓,郑德华,齐帜,蔡明,钱叶勇,于涛,廖珂,石炳毅
树突细胞(DC)作为体内最有效的抗原呈递细胞(APC),不但具有免疫激活作用,而且在一定的成熟状态下可诱导免疫耐受。DC的免疫调节作用与其发育成熟状态密切相关[1-3],未成熟DC(imDC)具有免疫负向调控作用,但在直接用于诱导移植免疫耐受的过程中,imDC易被刺激成熟,尤其是在体内存在炎症的情况下(包括移植手术损伤)更是如此,因而不适用于体内诱导免疫耐受。笔者在前期研究中应用了一种吞噬了凋亡淋巴细胞的imDC,称之为负载凋亡淋巴细胞的DCs(PUVA-SP DCs),此种DC表达不成熟表型[4]。本研究比较脂多糖(LPS)刺激后,PUVA-SP DCs和imDC的表型及细胞因子分泌的变化,以探明PUVA-SP DCs对炎症刺激的抑制作用。
1 材料与方法
1.1 实验动物及主要试剂 BALB/c(H-2d)﹑C57BL/6(H-2Kb)近交系小鼠,4~6周龄,雄性,SPF级,由北京维通利华实验动物有限公司提供。小鼠重组白细胞介素4(rmIL-4)﹑重组粒-巨噬细胞集落刺激因子(rmGM-CSF)购自Peprotech公司;胎牛血清﹑RPMI 1640培养基购自PAA Laboratories;LPS﹑光敏剂8-甲氧基补骨脂素(8-m ethoxypsoralen,8-MOP)购于Sigma公司;抗CD11c磁珠购自Miltenyi Biotec公司;各种荧光素标记的单抗CD80﹑CD86﹑CD40﹑MHC-Ⅱ以及同型对照抗体购自BD PharMingen或eBioscience公司;细胞因子IL-10﹑IL-12p70﹑IL-12p40的ELISA检测试剂盒购自R&D公司。小鼠淋巴细胞分离液为天津市TBD生物技术发展中心产品;FACS Calibur流式细胞仪为美国Bacton Dickinson公司产品。
1.2 imDC的培养 小鼠骨髓来源DC的培养参考Inaba等[5]的方法并稍作改进:颈椎脱位法处死C57BL/6小鼠,无菌取股骨和胫骨,注射器反复冲洗,收集得到骨髓细胞悬液,1000×g离心5min;弃上清,加入2ml无菌Tris-NH4Cl溶液裂解红细胞,1000×g离心5min,弃上清;洗涤后的细胞用含10%胎牛血清(FCS)﹑20ng/ml rmGM-CSF﹑10ng/ml rmIL-4的RPMI 1640培养基悬浮,并分至6孔培养板中,每孔加入约4ml培养基,调整细胞密度为2×106/ml,置37℃﹑5%CO2孵箱中培养48h;轻轻吹洗除去悬浮细胞,保留疏松贴壁细胞,加入新鲜的含有相同浓度rmGM-CSF﹑rmIL-4及10%FCS的RPMI 1640培养基,培养5~6d,用吸管轻轻吹打,收集所有悬浮细胞,无菌条件下用抗CD11c磁珠进行分选,获得实验所需骨髓来源的小鼠imDC。
1.3 脾淋巴细胞悬液(SP)的制备及PUVA处理 颈椎脱位法处死C57BL/6小鼠,无菌切取脾脏,移入4℃ PBS中;剪碎后经100目筛网充分研磨,200目筛网过滤去除残渣,获得单细胞悬液;以淋巴细胞分离液Ficoll密度梯度法,1600r/min离心20min;取单个核细胞层,加入RPMI 1640液,重复洗涤2次;用RPMI 1640液重悬细胞,置于塑料平皿中,在37℃﹑5% CO2孵箱中孵育30min;除去贴壁单核细胞,获得悬浮的脾淋巴细胞。采用台盼蓝染色法计算活细胞百分率,活细胞>90%时用于实验。采用8-MOP联合A波段长波紫外线(UVA)照射的体外光化学方法(简称PUVA)处理鼠脾淋巴细胞。上述脾淋巴细胞中加入200ng/ml 8-MOP,在37℃﹑5%CO2﹑饱和湿度孵箱中孵育20min后,置于距离UVA光源20cm处,直接照射9min,照射强度为2J/cm2。照射结束后,用RPMI 1640重复洗涤2次,用含10% FCS的RPMI 1640完全培养液悬浮细胞,在37℃﹑5%CO2﹑饱和湿度孵箱中继续培养过夜,得到PUVA处理后的供者小鼠脾淋巴细胞(PUVA-SP)。
1.4 吞噬经PUVA处理淋巴细胞的树突细胞(PUVA-SP DCs)的制备 在DC培养的第6天,按5:1比例加入经PUVA处理的小鼠脾淋巴细胞,共培养16h,去除悬浮细胞,得到吞噬PUVA-SP的imDC(即PUVA-SP DCs)。
1.5 LPS刺激对imDC和PUVA-SP DCs的影响 将上述imDC和PUVA-SP DCs调整密度至1×106/ml,分别加入10ng/ml LPS刺激24h,得到LPS DCs。24h后,获取上清,采用ELISA法检测上清中不同细胞因子的浓度。收集上述各种DCs,用PBS洗涤2次,调整细胞密度至1×106/ml,每管加入100μl,分别加入FITC-MHC Ⅱ﹑APC-CD 40﹑PerCP-Cy-CD80或PE-CD86单克隆抗体,用相同荧光素标记的同型非特异性抗体作为同型对照。细胞于4℃避光孵育30min,再用PBS洗涤2次,采用流式细胞仪检测细胞表面MHC-Ⅱ﹑CD40﹑CD86和CD80表达水平。
2 结 果
2.1 负载PUVA-SP对imDC免疫表型的影响 FCM检测结果显示,imDC与PUVA-SP混合培养后,其表面分子表达仍保持较低水平,CD80﹑CD86﹑CD40﹑MHC-Ⅱ的表达分别为22.72%﹑23.61%﹑21.81%﹑38.68%,与未经任何处理的imDC相比,差异无统计学意义(P>0.05),表明PUVA-SP并不刺激DC表型成熟。imDC以及PUVA-SP DCs分别与LPS混合培养后,imDC的表面分子CD80﹑CD86﹑CD40及MHC-Ⅱ的表达分别为50.58%﹑66.29%﹑71.20%及68.64%,而PUVA-SP DCs的表达分别为21.26%﹑38.50%﹑39.78%及67.29%,除MHC-Ⅱ外,两者相比差异有统计学意义(P<0.05,图1),表明吞噬了PUVA处理的脾淋巴细胞的imDC可以抵制LPS刺激导致的自身成熟。
2.2 PUVA-SP DCs对LPS刺激分泌细胞因子的影响 LPS刺激后,PUVA-SPDCs和imDCs分泌IL-10的水平分别为435.6±13.9pg/ml和132.6±2.8pg/ml,与未经刺激前相比均增高,且前者增高的水平显著高于后者,差异有统计学意义(P<0.01)。LPS刺激后,imDCs分泌高水平IL-12,其中p70为192.1±5.9pg/ml,p40为999.8±26.9pg/ml,而PUVA-SP DCs IL-12的分泌水平为p70 18.56±1.3pg/ml,p40 15.22±1.2pg/ml,显著低于imDCs,差异有统计学意义(P<0.01,图2)。

图1 PUVA-SP DCs和imDC在LPS刺激前后的表型变化Fig.1 Phenotype changes of PUVA-SP DCs and imDC in terms of LPS responsiveness
3 讨 论
DC是目前已知的体内最重要的专职性抗原呈递细胞,能摄取﹑加工及呈递抗原。一方面,DC可作为专职抗原呈递细胞触发和调节固有性及获得性免疫反应,启动免疫应答,介导移植免疫排斥反应;另一方面,DC通过多种机制诱导抗原特异性T细胞无能,且在免疫耐受中展示出极强的可塑性[6]。成熟的DC高表达共刺激分子﹑MHC-Ⅱ类分子和细胞间黏附分子(ICAM)等黏附分子,提呈抗原引发移植排斥反应;未成熟的DC低水平表达MHC-Ⅱ﹑MHC-Ⅰ﹑协同刺激分子(CD80﹑CD86)﹑黏附分子(CD40﹑CD44)等,虽具有极强的抗原摄取﹑加工处理能力,但激发免疫应答的能力较弱,通常介导致耐受作用[7-8]。如果直接将未成熟的DC用于移植受者作为诱导耐受方案应用,那么这些DC有可能在受者体内被激活,发挥提呈抗原﹑启动免疫应答的作用,尤其是在潜在炎症(包括移植手术损伤)的情况下[2-3]。危险信号理论认为,决定DC成熟与否的关键是在其荷载抗原的同时是否存在危险信号,有危险信号﹑荷载抗原的DC则趋于成熟;缺乏危险信号﹑荷载抗原的DC则趋于形成调节性DC,负向调节免疫反应。细胞凋亡系生理性细胞死亡,缺乏危险信号;而非凋亡性死亡(如坏死)是内源性的危险信号,将激发免疫炎症反应。我们前期研究应用了一种吞噬了凋亡淋巴细胞的imDC,称之为PUVA-SP DCs,表达不成熟表型,给移植受者输注这些DC后,能够诱导受者T细胞的免疫低反应性,可使移植受者CD4+CD25+Foxp3+Treg明显增加,移植物存活时间明显延长[2],提示PUVA-SP DCs具有负向免疫调节功能。
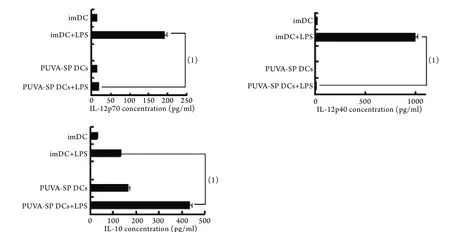
图2 PUVA-SP DCs和imDCs在LPS刺激前后IL-10和IL-12表达水平的变化Fig.2 Changes of IL-10 and IL-12 levels secreted by PUVA-SP DCs and imDC in terms of LPS responsiveness
未成熟DC用于诱导耐受的最大缺陷是有可能在受者体内被激活,从而发挥抗原呈递作用,PUVA-SP DCs在炎症情况下是否会被激活非常重要。为此我们比较了PUVA-SP DCs和imDC在LPS刺激前后表型和细胞因子分泌的变化,结果发现,与imDC相比,LPS刺激后,PUVA-SP DCs表面分子CD80﹑CD86﹑CD40并未显著升高,说明其功能分子是相对稳定的,可以抵制LPS刺激所致的成熟。PUVA-SP DCs可以自发分泌IL-10,且LPS刺激后,其分泌的IL-10水平要显著高于imDCs,而受LPS刺激后,PUVA-SP DCs却分泌低水平的IL-12,远远低于imDCs受刺激后的分泌量,提示其具有下调免疫应答的能力。由此我们认为,PUVA-SP DCs虽然表达不成熟表型,但其功能却不同于imDC,对LPS的刺激呈耐受状态,从而适用于体内诱导免疫耐受。
[1] Beriou G, Moreau A, Cuturi MC. Tolerogenic dendritic cells:applications for solid organ transplantation[J]. Curr Opin Organ Transplant, 2012, 17(1): 42-47.
[2] Zhao YW, Shi ZW, Liu QY. Immunomodulatory effect and its mechanism of triepoxide on regulatory dendritic cells[J]. Med J Chin PLA, 2012, 37(10): 962-965. [赵轶雯, 史振伟, 刘庆阳.雷公藤甲素对调节性树突细胞的免疫效应及其机制研究[J]. 解放军医学杂志, 2012, 37(10): 962-965.]
[3] Li F, Lu JY, Liu Q. Effect of MARCH1 on MHC-Ⅱubiquitination of splenic dendritic cells during multiple organ dysfunction syndrome in mice[J]. Med J Chin PLA, 2012, 37(5): 455-458. [李菲, 陆江阳, 刘茜. MHC-Ⅱ类分子泛素化作用的MARCH1在多器官功能障碍综合征病程中对脾脏树突细胞研究[J]. 解放军医学杂志, 2012, 37(5): 455-458.]
[4] Zheng DH, Dou LP, Wei YX, et al. Uptake of donor lymphocytes treated with 8-methoxypsoralen and ultraviolet A light by recipient dendritic cells induces CD4+CD25+Foxp3+regulatory T cells and down-regulates cardiac allograft rejection[J].Biochem Biophys Res Commun, 2010, 395(4): 540-546.
[5] Inaba K, Inaba M, Romani N, et al. Generation of large numbers of dendritic cells from mouse bone marrow cultures supplemented with granulocyte/macrophage colony-stimulating factor[J]. J Exp Med, 1992, 176(6): 1693-1702.
[6] Reichardt W, Durr C, von Elverfeldt D, et al. Impact of mammalian target of rapamycin inhibition on lymphoid homing and tolerogenic function of nanoparticle-labeled dendritic cells following allogeneic hematopoietic cell transplantation[J]. J Immunol, 2008, 181(7): 4770-4779.
[7] Lan YY, Wang Z, Raimoni G, et al. "A lternatively activated "dendritic cells preferentially secrete IL-10, expand Foxp3+CD4+T cells, and induce long-term organ allograft survival in combination with CTLA4-Ig[J]. J Immunol, 2006, 177(9): 5868-5877.
[8] Peche H, Trinite B, Martinet B, et al. Prolongation of heart allograft survival by immature dendritic cells generated from recipient type bone marrow progenitors[J]. Am J Transplant,2005, 5(5): 255- 267.
