慢病毒介导的siRNA靶向CD47基因对人喉癌细胞Hep-2增殖、凋亡的影响
2013-08-28高树峰张少容徐莲李黎万俊杨春平刘建国汪美群刘月辉
高树峰,张少容,徐莲,李黎,万俊,杨春平,刘建国,汪美群,刘月辉
喉癌是耳鼻咽喉头颈外科常见的恶性肿瘤之一,发病率高,占专科恶性肿瘤的11%~22%,现手术后复发和转移仍是患者的主要死因[1],因此寻找新的有效﹑简便﹑毒副作用小的治疗方法成为耳鼻咽喉科工作者关注的焦点。CD47是细胞表面的重要标记物;研究证实,在许多恶性肿瘤中均呈现过表达,而且其表达水平与疾病的预后呈明显负相关[2-3]。本研究运用慢病毒载体介导的RNAi干扰技术(RNA interference,RNAi)将针对CD47的特异性siRNA靶向慢病毒转染喉癌Hep-2细胞,沉默CD47基因,检测Hep-2细胞中CD47表达下调情况及其对喉癌细胞增殖﹑凋亡的影响,明确CD47基因表达水平与肿瘤生长特性的关系。探讨将CD47作为喉癌基因治疗靶点的价值,为以后的临床治疗提供一定的实验参考依据。
1 材料与方法
1.1 材料 主要试剂:胎牛血清﹑1640培养液购自Hyclone公司(美国);LymphoprepTM分离液购自Nyco-Prep公司(挪威);LipofectamineTMRNAiMAX转染试剂购自Invitrogen公司(美国);CD47抗体购自Abcam公司(英国);山羊抗兔IgG购自Southern Biotech公司(美国);兔抗鼠IgG购自武汉博士德生物工程有限公司(中国);RIPA裂解液购自北京碧云天公司(中国);HRP标记的优质内参购自上海康成生物公司(中国)。主要仪器:细胞恒温培养箱购自Thermo Scientific公司(英国);流式细胞仪购自BD FACSAria公司(美国);倒置荧光显微镜购自Leica公司(德国);定量PCR用SYBR Green qPCR SuperMix购自Invitrogen公司(美国)。细胞系:人喉癌上皮细胞Hep-2购自中国科学院上海生化与细胞研究所;CD47siRNA慢病毒载体由Sigma公司(美国)设计合成包装。
1.2 细胞培养 Hep-2细胞在10%的胎牛血清(含100U/ml青霉素,100μg/ml链霉素)的1640培养液中生长,并置于37℃,5%CO2的条件下培养,隔天换液1次,每4d传代1次,一般传代3~5次,当细胞处于对数生长期进行转染。
1.3 siRNA慢病毒转染 取状态良好的Hep-2细胞,用绿色荧光染料标记后按5×104个/孔接种于6孔板,用无抗生素培养液培养24h,转染组:待细胞融合度达底面积的40%~50%开始转染,操作按照LipofectamineTMRNAiMAX转染试剂盒说明书要求进行。将标记后未转染的Hep-2细胞作为空白对照组。将含有siRNA慢病毒的转染试剂与细胞共孵育5h后加入新鲜培养液孵育,转染后48h,弃培养基,每孔加入1μl Trizol,用定量PCR方法检测siRNA慢病毒的干扰效率,并在倒置荧光显微镜下观察两组细胞的形态学变化。
1.4 RT-PCR 以β-actin作为内参照,设计引物序列为:CD47,正义5'-CTTTGAAGAGATGAGCAGT G-3';反义5'-CGATGTGGGATCTAATTCTC-3',扩增片段265bp;β-actin,正义5'-TGGATCAGCAAGC AGGAGTA-3';反义5'-TCGGCCACATTGTGAACTT T-3',扩增片段275bp。设25﹑50﹑100nmol/L梯度转染组﹑对照组,分别标记为:HEP2-01-25-CD47﹑HEP2-01-50-CD47﹑HEP2-01-100-CD47和HEP2-00-25-CD47(空白对照组)。样品经琼脂糖凝胶电泳,行纯度检测无污染﹑完整性检测总RNA抽提完整后,取总RNA 1.0μg于RNase free的PCR管中,加H2O至12μl,吹打均匀,置85℃保温5min使RNA变性,置冰上防止RNA复性;续加Oligo(dT)0.5μl,反应引物0.5μl,10mmol/L dNTP 2.0μl,RNase抑制剂0.5μl,5×buffer 4.0μl,M-MLV 0.5μl,将上述20μl反应溶液30℃保温10min;42℃保温60min;85℃保温10min。以(Oligo)dT为引物反转录合成cRNA第一链后,取5μl cRNA为模板,加入上下游引物各0.5μl,2×SYBR Green qPCR Super Mix 10μl,dH2O 4.0μl加至20μl后在实时荧光定量PCR仪上扩增。反应条件:50℃ 2min,95℃2min,95℃ 15s,60℃ 32s,共40个循环。然后采用凝胶成像分析仪摄像,并分析计算siRNA的抑制效率。ΔCT=(Target gene CT-Reference CT)±SD;ΔΔCT=(Target gene ΔCT-Reference ΔCT)±SD;IE=(NX2–ΔΔCT-N2–ΔΔCT)/NX2–ΔΔCT×100%。NX为目的基因,N为参照基因。
1.5 Western blotting检测 根据细胞量加入相应RIPA裂解液,常规提取细胞蛋白,BCA法行蛋白初步定量。实验设HEP2组﹑NC组﹑CD47siRNAHEP2组。取样品50μg,与上样缓冲液按2:1混合,沸水浴5min,经SDS-PAGE 电泳(80V恒压50min,120V恒压出现溴酚蓝刚出胶底部止)﹑转至PVDF膜,5%脱脂奶粉TBST溶液封闭1h,一抗(兔抗鼠CD47稀释倍数为1:4000)4℃过夜﹑二抗(兔抗鼠IgG稀释倍数为1:2000)37℃孵育1h,TBST液洗涤5min×3次,在湿润的杂交膜表面上均匀加入发光液,反应5min,滤纸吸净多余底物溶液后暗盒曝光﹑显影﹑定影。同时设置梯度实验,以β-actin为内参照,应用图像分析软件进行图像扫描分析蛋白表达情况,计算表达抑制率等。
1.6 细胞增殖测定 细胞转染慢病毒48h后,均匀接种于96孔培养板中,加入MTT 10μl(5mg/ml),恒温培养箱孵育4h后,弃上清,每孔加入100μl DMSO溶解结晶30min,酶联仪580nmol/L处测定吸光度(A)值,以正常细胞组存活率为100%,计算实验组细胞存活率;同样,转染组设浓度(25﹑50﹑100nmol/L)梯度对比,最佳浓度设时间梯度(24﹑48﹑72h)进行对比。
1.7 统计学处理 采用SPSS 13.0统计学软件进行处理,数据以±s表示,两组间比较采用t检验,多组间比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结 果
2.1 慢病毒转染的Hep-2细胞形态学观察 转染后用荧光显微镜观察细胞形态:空白对照组喉癌细胞株Hep-2生长良好,细胞形态未见明显的改变,绿色荧光均匀分布。转染组的细胞密度相对减低,并可见细胞变形﹑皱缩,见贴壁数量相对减少,并见有圆而小的凋亡细胞,绿色荧光分布不均匀(图1)。
2.2 RT-PCR检测结果 HEP2-01-25-CD47﹑HEP2-01-50-CD47和HEP2-01-100-CD47的mRNA表达抑制率分别为0.82﹑0.73﹑0.76。结果表明:CD47-siRNA慢病毒转染对Hep-2细胞mRNA表达有明显抑制作用,抑制率明显高于HEP2-00-25-CD47(空白对照组)(t=5.28,P<0.05),且HEP2-01-25-CD47﹑HEP2-01-50-CD47和HEP2-01-100-CD47组间CD47-mRNA表达差异有统计学意义(F=79.26,P<0.05),其中HEP2-01-25-CD47组CD47基因有较高的抑制率,沉默效果较好(表1)。
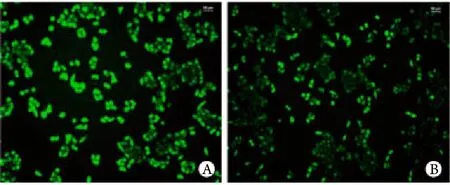
图1 慢病毒转染的Hep-2细胞形态学观察Fig.1 Morphology of Hep 2 cells transfected by lentivirus
2.3 Western blotting检测结果 Hep-2细胞转染CD47-siRNA慢病毒48h后,分别提取HEP2组﹑NC组﹑CD47-siRNA-HEP2组细胞蛋白并检测细胞CD47蛋白表达水平。结果显示:与HEP组相比较,CD47-siRNA慢病毒对目的基因有显著的沉默效应(图2)。转染组CD47蛋白表达明显下降。对其灰度分析显示,对目的基因进行干扰后CD47的表达可下调77%。HEP2-01-25-CD47﹑HEP2-01-50-CD47和HEP2-01-100-CD47蛋白表达抑制率分别为78.19±3.31﹑76.95±2.68及69.76±2.12。其中25nmol/L浓度转染组最明显。不同浓度siRNA慢病毒实验组,CD47蛋白表达抑制率与对照组比较差异有统计学意义(P<0.05)。
2.4 MTT实验结果 测定样品细胞的增殖率显示,转染细胞在48h后细胞增殖下降明显,为对照组的69%左右。NC组细胞存活率98%;G1期细胞存活率81%,S期细胞存活率74%;G2期细胞存活率69%,其中NC组与对照组之间比较差异无统计学意义(P>0.05)。A值在NC组与对照组之间比较差异有统计学意义(P<0.01)。另外,对Hep-2细胞转染不同浓度(25﹑50﹑100nmol/L)CD47-siRNA慢病毒,观察结果显示随着转染浓度的增加,并不存在抑制效率随浓度增加而增强的效应。而转染CD47-siRNA慢病毒(25nmol/L)24﹑48﹑72h后观察Hep-2细胞增殖情况,结果显示抑制效率随时间的延长而增强,与对照组比较差异有统计学意义(P<0.05)。
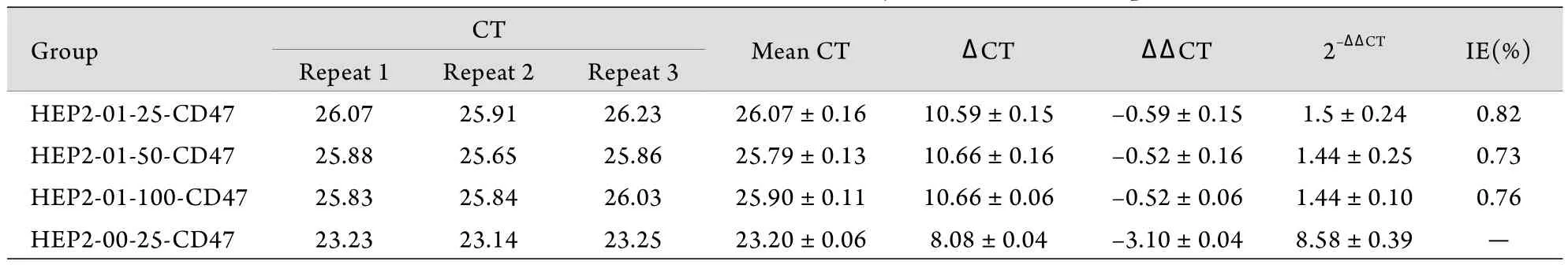
表1 各样品的CT值及抑制效率Tab.1 CT value and inhibition efficiency about different samples
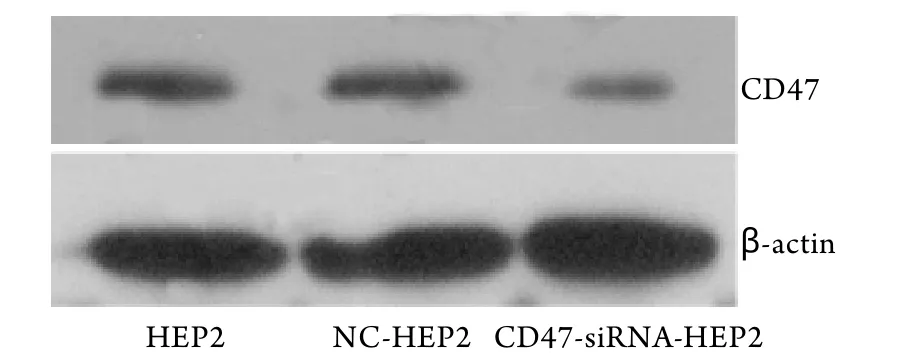
图2 Western blotting检测各组中CD47蛋白的表达Fig.2 CD47 protein expression in each group detected by Western blotting
3 讨 论
CD47最初是在人胎盘与整合素αVβ3共纯化及从血小板与β3整合素免疫共沉淀过程中被人们所认识,是一种广泛分布于多种细胞表面上高度糖化的跨膜蛋白,属于免疫球蛋白超家族的一员;CD47是细胞表面至关重要的标记物,由特定的整联蛋白﹑G蛋白及胆固醇组成的超分子复合物,其功能与整合素相关。与其互为受体配体的抑制性受体信号调节蛋白α(signal regulatory protein-α,SIRPα)可形成CD47-SIRPα信号复合体,共同调节效应细胞的功能及其所分泌的细胞因子,在诱导T细胞免疫耐受﹑活化﹑细胞凋亡﹑巨噬细胞吞噬和肿瘤免疫治疗等方面发挥多种调节作用[4]。有研究发现,机体存在两套信号系统调控细胞,一套产生“别吃我”的信号,另一套产生“来吃我”的信号。CD47-SIRPα产生的抑制性作用就是“别吃我”类型的信号,而Fcγ受体或者其他促吞噬基因产生的促吞噬作用就是“来吃我”的信号,最终结果由两种信号的相对强度所决定;大部分细胞凋亡时CD47表达量降低并被重新分配,凋亡细胞不再将SIRPα或下游的SHP-1激活[5]。近年来,斯坦福大学的研究者通过体外实验将单核巨噬细胞与用单克隆抗体封闭CD47的肿瘤细胞共培养,结果发现肿瘤细胞凋亡被吞噬,为探究靶向治疗恶性肿瘤奠定了基础[6-8]。在自身免疫性溶血性贫血(AIHA)研究中发现CD47-的非肥胖糖尿病(NOD)大鼠发生轻度溶血,而CD47+的NOD大鼠在短时间内均发生了致死性AIHA,表明CD47在AIHA发病中起到很大作用[9]。Olsson等[10]通过利用CD47缺乏的红细胞(CD47-RBC)与CD47表达正常的红细胞(CD47+RBC)比较,发现主要由脾髓巨噬细胞参与的对CD47-RBC的清除率远高于CD47+RBC,同时检测到有大量SIRPα蛋白表达,表明CD47和SIRPα均参与了红细胞吞噬过程的调节。深入研究发现,宿主靶细胞(如RBC)接受CD47呈递来的信号,介导抑制性信号从而实现其对吞噬作用的调节[4]。Majeti等[11]发现在人类急性髓系白血病干细胞(AML LSC)上过表达的CD47通过与吞噬细胞上抑制性受体的相互作用来抑制它们的吞噬作用。此外,他们还发现实验组较正常对照组CD47在AML LSC上有更高的表达,这种CD47的过表达在3个独立的不同实验组AML患者中预示着更差的总体生存率;应用单克隆抗体封闭CD47后可优先启用AML LSC吞噬功能并抑制它们的体内定植,同时治愈了大部分的非霍奇金淋巴瘤(NHL)小鼠,展示了CD47在疾病治疗方面的前景。
近年来,慢病毒在医学基础研究领域中已作为一个有效的基因转移工具得以运用,与其他载体相比,慢病毒更具优势[12-14]:首先,它既可转染有丝分裂期的细胞,又可转染分裂缓慢及处于分裂终末期的细胞;其次,载体稳定﹑持久﹑高效,发生突变和畸形的概率小,可使转基因细胞保持一个持久﹑稳定的表达,更适合长期诱导转移目的基因序列的需要,且被拆分为三或四质粒系统可大大提高其生物安全性;再次,慢病毒具有能够容纳相对大的转移基因序列,并且具有免疫反应小等优点。因此,其应用范围越来越广泛。
本研究针对CD47的RNA干扰片段及其慢病毒表达的载体,植入Hep-2后持续表达siRNA特异高效地靶向封闭目的基因,转染72h后,从形态学上发现转染后细胞荧光分布不均﹑贴壁数量相对减少,细胞变形,并可见凋亡等。RT-PCR和Western blotting检测显示,CD47-mRNA和蛋白的表达水平显著降低,且有明显的浓度依赖性,而非靶向的β-actin表达无影响,这说明了CD47 siRNA基因靶点筛选的有效性和干扰作用的特异高效性;MTT结果表明转染CD47-siRNA慢病毒组Hep-2细胞的增殖能力受到明显抑制,细胞存活率呈下降趋势,说明通过下调CD47基因的表达,Hep-2细胞出现明显凋亡,这进一步证实下调CD47基因的表达可抑制细胞增殖﹑诱导凋亡;同时,时间梯度实验中显示抑制效率与时间呈正相关;转染靶向CD47 siRNA慢病毒的浓度梯度实验中,在mRNA和蛋白水平上出现了抑制的差异性,说明存在着一个最佳转染浓度,该浓度在本实验为25nmol/L。总之,本实验通过使用转染靶向CD47基因的siRNA慢病毒,不仅有效下调了Hep-2中CD47基因的表达,同时初步证实转染后的Hep-2具有明显抑瘤活性,细胞存活率下降。但因肿瘤发病及发展的相关因素较多,CD47能否真正成为喉癌临床治疗的有效靶点,还需进一步的深入研究。
[1] Lu X, Zhang SX, Yuan HY, et al. Expression and clinical significance of FADD in carcinoma of larynx[J]. Acta Acad Med CPAPF, 2010, 19(10): 761-763. [卢曦, 张淑香, 原红艳, 等.FADD在喉癌的表达及临床意义[J]. 武警医学院学报, 2010,19(10): 761-763.]
[2] Jaiswal S, Jamieson CH, Pang WW, et al. CD47 is upregulated on circulating hematopoietic stem cells and leukemia cells to avoid phagocytosis[J]. Cell, 2009, 138(2): 271-285.
[3] Pettersen RD, Hestdal K, Olafsen MK, et al. CD47 signals T cell death[J]. J Immunol, 1999, 162(12): 7031-7040.
[4] Carani L, Sollazzo D, Ricci F, et al. The CD47 pathway is deregulated in human immune thrombocytopenia[J]. Exp Hematol, 2011, 39(4): 486-494.
[5] Olsson M, Nilsson A, Oldenborg PA. Target cell CD47 regulates macrophage activation and erythrophagocytosis[J]. Transfus Clin Biol, 2006, 13(1-2): 39-43.
[6] Chan KS, Volkmer JP, Weissman I. Cancer stem cells in bladder cancer: a revisited and evolving concept[J]. Curr Opin Urol,2010, 20(5): 393-397.
[7] Chao MP, Alizadeh AA, Tang C, et al. Anti-CD47 antibody synergizes with rituximab to promote phagocytosis and eradicate non-Hodgkin lymphoma[J]. Cell, 2010, 142(5): 699-713.
[8] Willingham SB, Volkmer JP, Gentles AJ, et al. The CD47-signal regulatory protein alpha (SIRPα) interaction is a therapeutic target for human solid tumors[J]. Proc Natl Acad Sci USA, 2012,109(17): 6662-6667.
[9] Oldenborg PA, Gresham HD, Chen Y, et al. Lethal autoimmune hemolytic anemia in CD47-deficient nonobese diabetic (NOD)mice[J]. Blood, 2009, 99(12): 3500-3504.
[10] Olsson M, Oldenborg PA. CD47 on experimentally senescent murine RBCs inhibits phagocytosis following Fcgamma receptormediated but not scavenger receptor-mediated recognition by macrophages[J]. Blood, 2008, 112(10): 4259-4267.
[11] Majeti R, Chao MP, Alizadeh AA, et al. CD47 is an adverse prognostic factor and therapeutic antibody target on human acute myeloid leukemia stem cells[J]. Cell, 2009, 138(2): 286-299.
[12] Wen KM, Fu ZX, Zhang GH, et al. Apoptosis induced by Octamer 4 gene silencing and its potential mechanism in colorectal cancer[J]. Med J Chin PLA, 2012, 37(10): 947-950.[文坤明, 傅仲学, 张贵海, 等. Oct4基因沉默对结直肠癌细胞凋亡的诱导作用及机制研究[J]. 解放军医学杂志, 2012,37(10): 947-950.]
[13] Pfeifer A, Hofmann A. Lentiviral transgenesis[J].MethodsMol Biol, 2009, 530(1): 391-405.
[14] Zhu XX, Li XN, Guo Y, et al. Silencing effect of lentivirusmediated RNA interference on metastasis-associated gene 1(MTA1) in human nasopharyngeal carcinoma cell line[J]. Med J Chin PLA, 2010, 35(7): 853-856. [朱晓霞, 李学农, 郭煜, 等.慢病毒介导的RNA干扰对鼻咽癌细胞株中转移相关基因1的沉默效应[J]. 解放军医学杂志, 2010, 35(7): 853-856.]
