生后发育期外周组织损伤对大鼠成年后痛行为的影响
2013-08-28李萌萌唐家广刘瑛辉解葵郝建华陈军
李萌萌,唐家广,刘瑛辉,解葵,郝建华,陈军
近年来临床研究显示,胎儿和新生儿期中枢神经系统发育尚未成熟,任何外来伤害性刺激均可影响神经系统的正常发育,并对该个体成年后的痛行为产生不可忽视的影响[1-3]。动物实验显示,新生大鼠外周组织遭受持续伤害性刺激对其成年后中枢神经系统的结构和功能有较大影响[4-5],但生后不同发育时期的持续伤害性刺激对其成年后基础痛阈及痛行为的影响目前尚未见系统报道。本研究应用具有多样临床病理性痛特征的蜜蜂毒动物致痛模型对此问题进行初步探讨。
1 材料与方法
1.1 实验动物及主要仪器 SD大鼠由第四军医大学实验动物中心提供,根据实验进程取仔鼠,每窝8~12只,共使用24窝。新生大鼠和母鼠单笼饲养,出生3周后按雌雄分开饲养。实验严格按照IASP关于应用清醒动物进行疼痛实验研究纲要的要求实施并完成[6]。实验用蜜蜂毒(bee venom,BV)购自Sigma公司。RTY-3型自动热刺激仪,von-Frey纤毛机械刺激仪(刺激强度由大到小依次为150﹑120﹑90﹑60﹑45﹑35﹑30﹑20﹑15﹑10﹑8﹑4﹑2﹑1﹑0.7﹑0.4﹑0.2g)购自西安峰岚仪器厂。
1.2 动物分组及处理 取生后第1﹑4﹑7﹑14﹑21﹑28天(即P1﹑P4﹑P7﹑P14﹑P21﹑P28)大鼠,每时间点取4窝,每窝随机分为损伤组和对照组(n=20),分别给予外周化学组织损伤(后肢足底皮下注射BV 20μl)或生理盐水(normal saline,NS)20μl处理,仔鼠被饲养至成年(2个月龄),测量每只成年大鼠的基础痛阈值(热刺激缩足反射潜伏期和机械刺激缩足反射阈值),然后两组大鼠均在左侧后肢足底给予第二次外周化学组织损伤(0.4% BV 50μl),测定持续自发痛(注射后1h内)及注射后2﹑4﹑8﹑24﹑48﹑72﹑96h的原发性热或机械痛敏,以评价生后发育期伤害性刺激对其成年后痛行为的影响。
1.3 蜜蜂毒动物痛模型的建立[7-8]采用粗制冻干蜜蜂毒素,用生理盐水配制成不同浓度(0.025%﹑0.0375%﹑0.05%﹑0.1%﹑0.4%),各年龄段大鼠给予最大剂量-反应浓度[9]的蜜蜂毒溶液。实验者轻轻固定仔鼠,用50μl微量注射器分别抽取上述浓度蜜蜂毒20μl,将毒素液体注入大鼠左侧后肢足底皮下,随后将仔鼠放回长方形塑料饲养盒内,继续饲养至2个月龄后用于实验。
1.4 痛定量测定方法[7-8]
1.4.1 持续自发痛 观察记录大鼠注射蜜蜂毒或生理盐水后1h内注射侧每5min自发缩足反射的次数。
1.4.2 热刺激缩足反射潜伏期(paw withdrawl thermal latency,PWTL) 将大鼠置于底部为2mm厚玻璃板的透明有机玻璃箱(20cm×20cm×25cm)中,并放置在高出实验台30cm处以便观察。应用RTY-3型热刺激仪,选择100W卤素投射灯,调节电压至10V,调节灯源与玻璃板之间的距离,使落在足底的照射光圈直径为5mm,记录从开始照射至出现缩足逃避反射的时间(s),重复测量3~5次,同一部位间隔10min,不同部位间隔5min,取平均值为热刺激缩足反射潜伏期。大于40s无反应则停止照射,以避免足底组织过度热损伤。以组织损伤处理前的测定结果作为基础PWTL。
1.4.3 机械刺激缩足反射阈值(paw withdrawl mechanical threshold,PWMT) 以不同粗细和长度的尼龙丝制成17个刺激强度不同(0.2~150g)的von-Frey机械刺激器纤维。将20cm×20cm×25cm的透明有机玻璃箱放置于顶部为铁丝网的30cm高的架子上,将待测大鼠置于箱中,适应30min以上,使之从不安到逐渐安静。实验者手持von-Frey纤维穿过铁丝网格分别刺激大鼠两侧足底中心部位,刺激由小到大,每个强度反复刺激10次(间隔3~5s),将出现缩足反射5次以上的强度作为大鼠的PWMT。
1.5 统计学处理 采用SPSS 13.0软件进行统计分析,计量资料以±s表示,损伤组和对照组之间比较采用非参数Mann-Whitney U检验,不同年龄组间的比较采用ANOVA的Post hoc Fisher's检验,P<0.05为差异有统计学意义。
2 结 果
2.1 对成年大鼠基础痛阈的影响 P1﹑P4﹑P7﹑P14﹑P21﹑P28大鼠经蜜蜂毒或生理盐水处理,成年后基础PWTL组间差异无统计学意义,两侧足底比较差异亦无统计学意义(P>0.05,图1A),但P1﹑P4﹑P7﹑P14大鼠给予蜜蜂毒处理后,成年后双侧PWMT均明显降低,与对照组比较差异有统计学意义显著(P<0.01,图1B)。
2.2 对蜜蜂毒诱致的持续自发痛的影响 P1﹑P4﹑P7﹑P14大鼠经蜜蜂毒处理,成年后蜜蜂毒诱致的持续自发痛显著增强,从时程看,增强作用只发生在成年大鼠注射蜜蜂毒后0~25min或0~30min以内(P<0.05,图2A﹑B),而对30~60min时程内的自发缩足反射次数无显著影响(P>0.05)。P21﹑P28大鼠经蜜蜂毒处理,成年后蜜蜂毒诱致的持续性自发痛在前10~15min无显著变化,但在15~60min时程内的自发缩足反射次数明显增多(P<0.01,图2C﹑D)。
2.3 对蜜蜂毒诱致的痛阈的影响 P1﹑P4﹑P7﹑P14﹑P21大鼠经蜜蜂毒或生理盐水处理后,至成年期热痛敏感性无显著差异(图3)。P1大鼠经蜜蜂毒或生理盐水处理后成年期蜜蜂毒诱致的机械痛敏无明显差异(图4A);P4﹑P7﹑P14大鼠经蜜蜂毒处理后,至成年期蜜蜂毒诱致的机械痛敏或触诱发痛完全消失,经生理盐水处理后,成年期仍可引起机械性痛敏(图4B﹑C﹑D);P21大鼠经蜜蜂毒处理后,至成年期蜜蜂毒诱致的机械痛敏或触诱发痛明显增强,与对照组比较差异显著(图4E)。
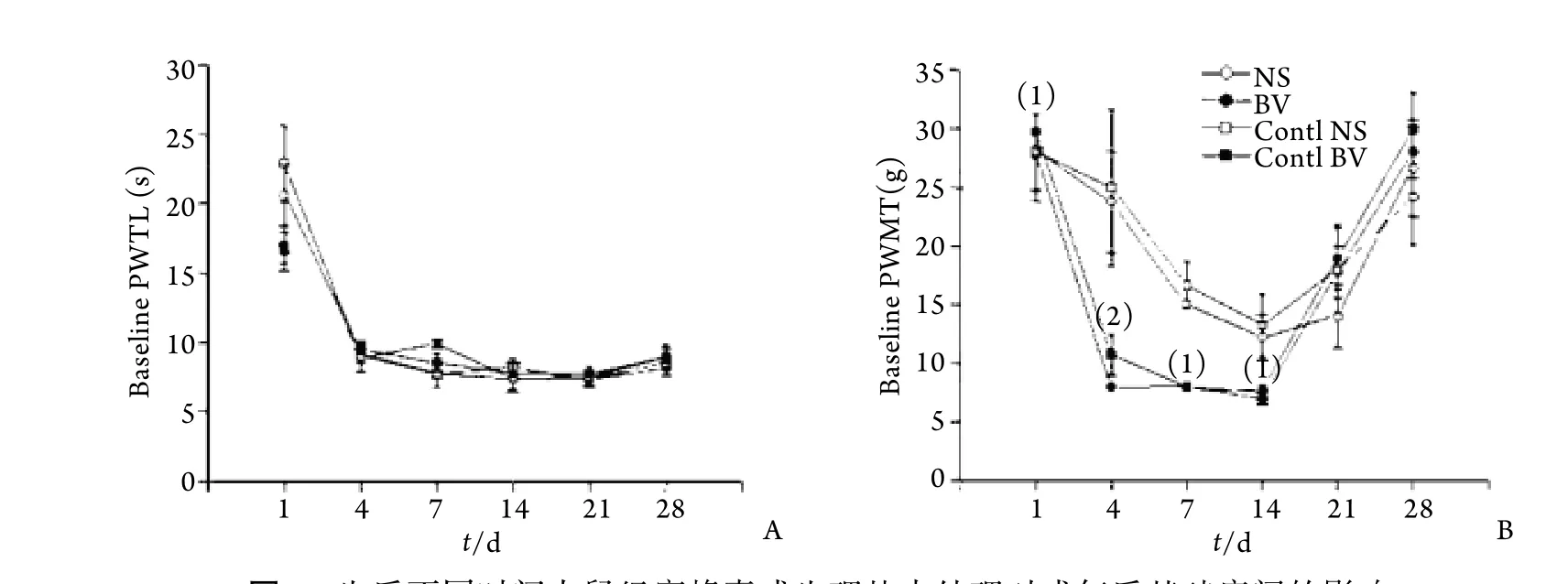
图1 生后不同时间大鼠经蜜蜂毒或生理盐水处理对成年后基础痛阈的影响Fig. 1 Effect of postnatal inflammation on baseline pain threshold in adult rats

图2 生后不同时间大鼠外周蜜蜂毒处理对其成熟后持续自发痛反应的影响(n=20)Fig. 2 Effects of postnatal inflammation on the continuous spontaneous pain in adult rats (n=20)(1)P<0.05, (2)P<0.01 compared with control group
3 讨 论
本研究对大鼠生后不同发育期遭受持续伤害性刺激对成年后痛行为的影响进行了较为系统的行为学观察,结果显示,生后不同发育阶段受到持续伤害性刺激对大鼠成年后的热痛潜伏期及热痛敏感性无显著影响,但对机械痛反射阈值及机械痛敏感性有较为明显的影响,且不同发育阶段受到伤害性刺激对成年后的影响也有所不同。
本研究结果提示,不同发育期伤害性刺激的经历均可增强成年后的持续自发痛反应,但生后21d前与21d后处理对蜜蜂毒反应时程的增强效果不尽相同。生后21d前处理主要增强成年大鼠持续自发缩足反射的早反应相(0~25或0~30min),而对晚反应相无明显影响;但出生21d之后处理却只增强晚反应相(10~60或15~60min),而对即时反应相无明显影响。分析其原因可能是由于:①脊髓背角浅层在生后21d才完全由无髓C纤维占据,而在21d之前由A和C纤维共同支配[4,10],脊髓背角浅层成熟前后给予伤害性刺激可能导致初级传入终末及脊髓背角浅层神经元突触结构和功能发育异常[5];②出生21d前后持续伤害性处理对不同初级传入纤维结构和功能的影响可能不同,导致成熟大鼠初级传入纤维发育异常[11]。此外,本研究结果进一步证实生后21d是新生大鼠伤害性感觉功能从非成熟发育到成熟的关键时点,21d前的伤害性处理既影响了非伤害性躯体感觉传导通路,也影响了伤害性躯体感觉传导通路和功能的发育,而21d之后的持续伤害性处理可能只影响伤害性躯体感觉传导通路和功能,即出生后发育期的伤害性处理对外周及脊髓的结构和功能具有双重影响[5,11]。

图3 生后不同时间大鼠外周蜜蜂毒处理对其成熟后原发性热痛敏的影响Fig. 3 Effects of postnatal bee venom-induced inflammation on the primary thermalgesia in adult rats
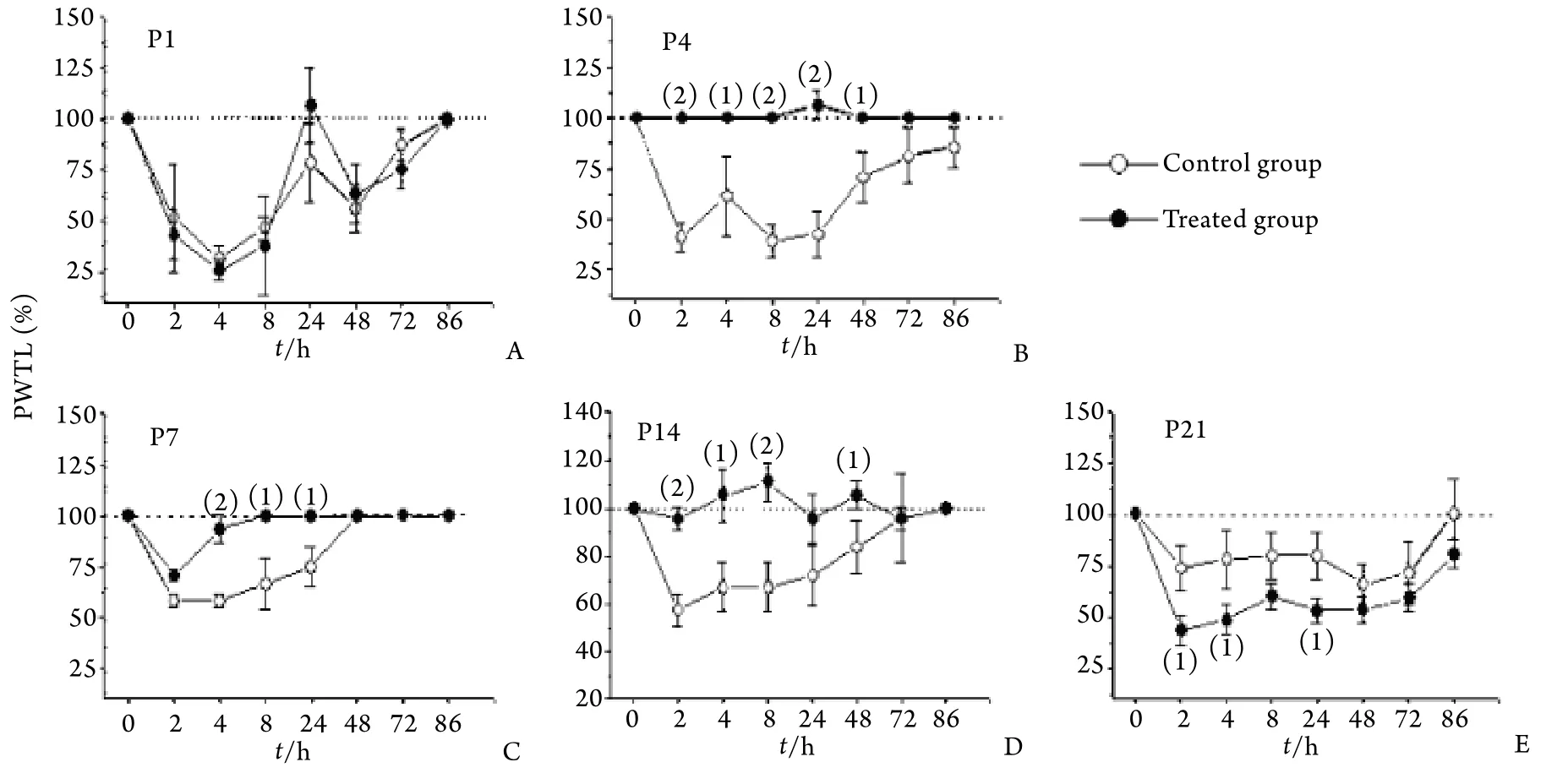
图4 生后不同时间大鼠外周蜜蜂毒处理对其成熟后机械痛敏或触诱发痛的影响Fig. 4 Effects of postnatal bee venom-induced inflammation on mechanical threshold and haphalgsia in adult rats
本实验还发现,成年大鼠热痛潜伏期和热痛敏感性不受新生期伤害性刺激的影响。大鼠出生后外周伤害性热痛感受器如辣椒素受体1(vanilloid receptor-1,VR1)对化学性伤害刺激不敏感,不易引起外周伤害性热痛感受器结构和功能发生改变,但目前其机制尚不清楚[12-13]。最近已克隆出外周伤害性热痛感受器VR-1或辣椒素样受体1(vanilloid receptor like-1,VRL-1)[11],VR-1和VRL-1在脊髓背角和脊髓的生后发育特点及其与痛敏感性的关系值得深入研究。另外,成年大鼠机械痛反射阈值和机械痛敏感性因在发育期受到伤害性刺激的时期不同而有显著差别,与对照组相比,P4-P14大鼠给予蜜蜂毒处理可消除成年后的机械痛敏或触诱发痛,而P21大鼠给予同样处理却可增强成年后的机械痛敏强度。在新生大鼠特异伤害性感觉通路成熟之前皮下注射蜜蜂毒可严重影响机械痛敏的发生及持续慢性化关键因素(神经或非神经因素)的成熟,从而使其成年后不发生机械痛敏或触痛;但在大鼠特异伤害性感觉通路成熟之后,同样的处理不仅不能消除成年期的机械痛敏或触诱发痛,反而对其有显著增强效果,其机制目前尚不明了。近年来有研究报道成年大鼠穴位注射蜜蜂毒素可产生镇痛效应[14],临床研究发现新生儿接受纯化的蜜蜂毒素接种可获得成年后对毒素引起的过敏反应的免疫效应[15]。有关新生大鼠皮下蜜蜂毒注射对成年机械痛敏作用影响的机制有待进一步研究。
本研究采用的蜜蜂毒试验模型是陈军研究组近十年来开发的具有多样临床病理痛特点的动物行为模型,大鼠一侧后肢皮下注射蜜蜂毒液可立即引起一个持续1h左右的持续自发痛行为反应(表现为持续自发缩足反射﹑抬足舔足),2h后可鉴定出发生在注射部位的原发性热﹑机械性痛敏,以及远离损伤部位的继发性热痛敏和发生在非注射侧后肢的“镜像”热痛敏[11-13,16]。该模型能较好地模拟临床病理性痛的发生和持续慢性化机制,并能较客观地记录疼痛的强度及定量测定痛敏情况。Ruda等[1]报道新生动物给予完全弗氏佐剂处理可以使皮下注射福尔马林诱导的第二相反应时程曲线左移,而第一相无明显变化,但没有观察到福尔马林反应强度有任何改变。与福尔马林实验模型相比,成熟大鼠蜜蜂毒反应强度(即每5min持续自发反射次数或1h总次数)在生后发育期接受伤害性刺激后显著增强。本实验结果更能反映新生期持续炎症伤害处理对成熟大鼠持续自发痛反应程度的影响。
综上所述,结合以往临床观察和本研究结果,生后不同时期经历伤害性刺激或痛体验可导致成年后痛感觉和相关生理功能异常,伴随的应激状态还可能引起神经和(或)精神系统发育不良。这些痛行为的异常表现与中枢神经系统在生后发育阶段遭受持续伤害刺激而产生的结构和功能的不可逆改变具有密切关系,但其发生机制与形态学证据尚需进一步深入研究。
[1] Ruda MA, Ling QD, Hohmann AG, et al. Altered nociceptive neuronal circuits after neonatal peripheral inflammation[J].Science, 2000, 289(5749): 628-631.
[2] Fitzgerald M, Beggs S. The neurobiology of pain: developmental aspects[J]. Neuroscientist, 2001, 7(3): 246-257.
[3] Hohmann AG, Neely MH, Pina J, et al. Neonatal chronic hind paw inflammation alters sensitization to intradermal capsaicin in adult rats: a behavioral and immunocytochemical study[J]. J Pain, 2005, 6(12): 798-808.
[4] Back SK, Kim MA, Kim HJ, et al. Developmental characteristics of neuropathic pain induced by peripheral nerve injury of rats during neonatal period[J]. Neurosci Res, 2008, 61(4): 412-419.[5] Fitzgerald M. The development of nociceptive circuits[J]. Nat Rev Neurosci, 2005, 6(7): 507-520.
[6] Zimmerman M. Ethical guidelines for investigation of experimental pain in concious animals[J]. Pain, 1983, 16(2):109-110.
[7] Chen J, Luo C, Li H, et al, Primary hyperalgesia to mechanical and heat stimuli following subcutaneous bee venom injection into the plantar surface of hindpaw in the conscious rat: a comparative study with the formalin test[J]. Pain, 1999, 83(1): 67-76.
[8] Lariviere WR, Melzack R. The bee venom test: a new tonic-pain test[J]. Pain, 1996, 66(2-3): 271-277.
[9] Li MM, Chen HS, Tang J, et al. Characterization of nociceptive responses to bee venom-induced inflammation in neonatal rats[J]. Brain Research, 2012, 1472: 54-62
[10] Walker SM, Meredith-Middleton J, Cooke-Yarborough C, et al.Neonatal inflammation and primary afferent terminal plasticity in the rat dorsal horn[J]. Pain, 2003, 105(1-2): 185-195.
[11] Chen J. Spinal processing of bee venom-induced pain and hyperalgesia[J]. Sheng Li Xue Bao, 2008, 60(5): 645-652.
[12] Chen J, Li HL, Luo C, et al. Involvement of peripheral NMDA and non-NMDA receptors in development of persistent firing of spinal wide-dynamic-range neurons induced by subcutaneous bee vonem injection in the cat[J]. Brain Res,1999, 844(1-2): 98-105.[13] Chen HS, Chen J, Guo WG, et al. Establishment of bee venominduced contralateral heat hyperalgesia in the rat is dependent upon central temporal summation of afferent input from the site of injury[J]. Neurosci Lett, 2001, 298(1): 57-60.
[14] Muller UR. New development in the diagnosis and treatment of hymenoptera venom allergy[J]. Int Arch Allergy Immunol, 2001,124: 447-453.
[15] Akdis CA, Blaser K. Mechanisms of allergen-specific immunotherapy[J]. Allergy, 2000, 55(6): 522-530.
[16] Chen HS, Chen J, Sun YY. Contralateral heat hyperalgesia induced by unilaterally intraplantar bee venom injection is produced by central changes: a behavioral study in the conscious rat[J]. Neurosci Lett, 2000, 284(1-2): 45-48.
