钩藤碱对肾性高血压大鼠心肌中叶素及其受体表达的影响
2013-08-28汪江涛丁伯平黄帧桧
汪江涛, 丁伯平, 柏 松, 陈 莉, 黄帧桧
(皖南医学院药理学教研室及中药药理国家三级实验室,安徽芜湖 241002)
中叶素是美国斯坦福大学Roh等[1]运用生物信息学理论所发现的一个降钙素基因相关肽 (calcitonin gene-related peptide,CGRP)家族的新的血管活性肽,与日本学者2004年发现的肾上腺家族的新肽肾上腺髓质素2(adrenomedullin2,ADM2)在核苷酸和氨基酸序列上完全相同,认为两者是同一物质[2],具有舒张血管、降低血压、保护心功能等生物学效应[3-4],中叶素可与任意一种 CGRP家族特异性受体复合物结合,该受体复合物由降钙素受 体 样 受 体 (calcitonin receptor-like receptor,CRLR)和受体活性修饰蛋白 (receptor activity modifying proteins,RAMPs)构成,包括 CRLR/RAMP1、CRLR/RAMP2、CRLR/RAMP3,是重要的心血管保护因子之一。钩藤为茜草科植物钩藤或华钩藤及其同属的多种植物的带钩枝条,钩藤碱为其主要有效活性成分[5],具有降压、镇静等作用[6-7]。但钩藤碱对肾性高血压心肌保护报道较少,本实验在两肾一夹肾性高血压大鼠模型的基础上,初步探讨钩藤碱心肌保护是否与内皮素 (ET-1)和中叶素及其受体表达有关,为钩藤碱临床使用提供理论依据。
1 材料与方法
1.1 动物 雄性清洁级SD大鼠60只,体质量160~180 g,购自南京青龙山实验动物中心,许可证号:SCXK(沪)2008-0016,分笼饲养,每笼一只,保持温度 (25±2)℃,相对湿度60% ±10%,自由进食饮水。
1.2 药品与试剂 98%钩藤碱 (南京泽郎医药科技有限公司,批号:ZL110715);尼卡地平 (安斯泰来制药 (中国)有限公司,批号:B027Y01)。羟脯氨酸 (Hyp)检测盒 (南京建成生物工程研究所,批号:20111120);内皮素 (ET-1)放射免疫药盒,北京北方生物技术研究所 (批号:20111120);大鼠降钙素受体样蛋白 (CRLR)ELISA检测试剂盒 (苏州卡尔文生物工程有限公司,批号:CK-E91835R)。兔抗中叶素多克隆抗体(编号:bs-2985R,批号:990292),SP免疫组化检测试剂盒 (兔)(编号:SP-0023),DAB试剂盒均购于北京博奥森生物技术有限公司。TRNzol-A+,RNase-free ddH2O,超纯 dNTP,Oligo dt15均购于天根生化科技 (北京)有限公司 (批号分别为#J9117;#L0517;#L0314;#L0301);PCR引物由南京金斯瑞生物工程科技有限公司合成。
1.3 仪器 GC—1200型γ放射免疫计数器 (科大股份公司);KDC—2042恒温高速离心机 (科大股份公司);EG1160组织包埋机 (德国LEICA);RM2245组织切片机 (德国LEICA);Elx 800全自动酶标仪 (美国宝特仪器有限公司);匀浆仪(PRO 250);JD801凝胶电泳图像分析系统 (江苏省捷达科技发展有限公司);高速冷冻离心机(Heraeus);基因扩增仪EDC—810(东胜国际贸易有限公司);瑞士产微量加样仪;瑞士产连续加样仪。
1.4 两肾一夹高血压模型的复制及处理 60只雄性清洁级SD大鼠,观察适应性喂养一周后,随机抽取8只作为假手术组,52只为造模组,对造模组大鼠进行两肾一夹手术,大鼠术前禁食过夜,自由饮水。以25%乌拉坦 (4 mL/kg)腹腔注射麻醉大鼠,玻璃分针分离左肾动脉,放置内径为0.20 mm的银夹打结并固定。假手术组同样分离肾动脉,但不放置银夹,依次缝合肌肉和皮肤。手术后4 h内肌肉注射40万单位的青霉素,连续注射3 d以预防感染,术后正常进食与喂水。无创尾动脉血压测量仪测定正常大鼠清醒手术前、手术后及用药后尾动脉压。手术后4周收缩后达160 mmHg(1 mmHg=0.133 kPa)为造模成功[8],入选给药组。将造模成功的大鼠随机分为5组 (见表1):模型组 (n=8)、钩藤碱高剂量组 [10.0 mg/(kg·d),n=8]、钩藤碱中剂量组 [5.0 mg/(kg·d),n=8]、钩藤碱低剂量组 [2.5 mg/(kg·d),n=8]、尼卡地平组 [0.1 mg/(kg·d),n=8]。手术后5周开始给药,钩藤碱高、中、低剂量组和尼卡地平组腹腔注射给药连续8周;模型组和假手术组腹腔注射等量的生理盐水。
表1 大鼠造模后的收缩压、舒张压变化 (mmHg,±s,n=8)Tab.1 Changes of systolic pressure and diastolic pressure(mmHg,±s,n=8)
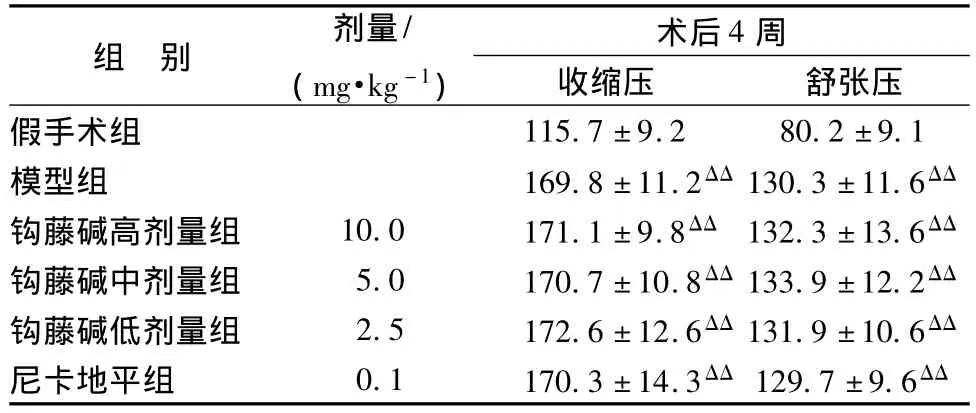
表1 大鼠造模后的收缩压、舒张压变化 (mmHg,±s,n=8)Tab.1 Changes of systolic pressure and diastolic pressure(mmHg,±s,n=8)
注:与假手术组相比,ΔΔP<0.01。
组 别 剂量/(mg·kg -1)术后4周收缩压 舒张压假手术组115.7±9.2 80.2±9.1模型组 169.8±11.2ΔΔ130.3±11.6ΔΔ钩藤碱高剂量组 10.0 171.1 ±9.8ΔΔ 132.3±13.6ΔΔ钩藤碱中剂量组 5.0 170.7±10.8ΔΔ133.9±12.2ΔΔ钩藤碱低剂量组 2.5 172.6±12.6ΔΔ131.9±10.6ΔΔ尼卡地平组 0.1 170.3±14.3ΔΔ 129.7±9.6ΔΔ
1.5 全心质量指数 (HM/BM)的测定和心肌Hyp、ET-1、CRLR的测定 给药8周后称定质量处死,迅速开胸取出心脏,用预冷的生理盐水漂洗后滤纸吸干,称量全心质量 (mg)和大鼠体质量(g),计算全心质量指数;准确称取心肌组织,按质量体积比1∶9加0.86%冷生理盐水,制成10%的组织匀浆,4℃,3 000 r/min离心10 min,分离上清液后用碱水解法测定Hyp的水平,放射免疫法测定ET-1水平,ELISA法测定 CRLR水平,匀浆制备过程在4℃条件下进行,并在15 min内完成。
1.6 免疫组织化学法检测中叶素在心肌组织中蛋白的表达 心肌组织置入10%中性甲醛中固定,常规石蜡包埋切片,脱蜡入水,30%H2O21份和蒸馏水10份混合,室温10 min以灭活内源性酶,蒸馏水洗3次;将切片浸入0.01 mol/L枸橼酸盐缓冲液 (pH 6.0),高压锅加热至沸腾后断电,间隔10 min,反复2次,冷却后用PBS(pH 7.2)洗涤2次;滴加5%BSA封闭液,室温20 min,甩去多余液体,不洗;滴加兔抗中叶素单克隆抗体(1∶150),4℃孵育过夜;PBS(pH7.2)洗5 min 3次;滴加二抗37℃放置30 min,PBS(pH7.2)洗5 min 3次;滴加试剂SABC,37℃ 30 min,PBS(pH 7.2)洗5 min 4次;使用DAB显示试剂盒,室温显色,显微镜下观察染色程度,蒸馏水洗涤终止反应;苏木素轻度复染,脱水,透明,封片,镜检。结果判定:低倍镜和高倍镜观察切片,组织细胞结构清晰的为阳性细胞,胞浆染成棕黄色。应用IPP 6.0对结果进行半定量分析,以累计光密度值(IOD)进行比较。
1.7 半定量逆转录聚合酶链反应 (RT-PCR)分析RAMPs mRNA表达 大鼠处死后迅速去心肌组织100 mg,用 Trizol一步提取法提取组织的总RNA。在逆转录反应体系中加入RNA 2 μg,10×RT Mix 2 μL,dNTP 混合液 2 μL,Oligo-dT152 μL,Quant Reverse Transcriptase 1 μL,最后加入 RNasefree水,使反应总体积达到20 μL。逆转录反应体系在37℃下反应60 min,在70℃下15 min使产物变性。引物序列见表2。PCR反应体系如下[9]:1 μL 模板 cDNA,1 μL 上游引物,1 μL 下游引物,2×Taq PCR Master Mix 12.5 μL,加入双蒸水使反应总体积达到25 μL。RAMP1和 RAMP2反应条件:变性94℃4 min;扩增 (31个循环):94℃30 s,60℃ 45 s,72℃ 35 s;末次循环后,72℃再延伸5 min;RAMP3反应条件:变性94℃4 min;扩增 (33个循环):94℃ 30 s,58℃ 45 s,72℃ 35 s;末次循环后,72℃再延伸5 min;ßactin反应条件:变性94℃4 min;扩增 (25个循环):94℃ 30 s,58℃ 45 s,72℃ 35 s;末次循环后,72℃再延伸5 min。取PCR产物8 μL加5×Loading Buffer 2 μL于2%琼脂糖凝胶电泳和溴化乙啶染色,应用凝胶成像系统分析心肌组织中RAMP1、RAMP2和RAMP3 mRNA的表达,结果以目的条带的光密度与相关β-actin mRNA光密度的比值表示。

表2 RT-PCR扩增的寡核苷酸引物及反应条件Tab.2 Oligonucleotides used for the amplification and reaction conditions
1.8 统计学处理 采用SPSS 18.0软件分析,结果以±s表示,两组间比较采用t检验,多组间采用方差分析。
2 结果
2.1 大鼠 HM/BM、Hyp、ET-1、CRLR的变化给药8周后,与假手术组相比,模型组HM/BM、Hyp、ET-1、CRLR均有显著提高 (P<0.01);与模型组相比,钩藤碱高、中剂量组及尼卡地平组HM/BM、Hyp、ET-1下降,CRLR上升,差异有显著性 (P<0.01),低剂量组能一定程度的降低HM/BM,升高CRLR(P<0.05),见表3。
2.2 心肌组织中中叶素的蛋白表达 通过免疫组化染色可以看出,中叶素主要表达在心肌组织的胞浆中,与假手术组相比,中叶素在模型组大鼠心肌组织的中表达升高58.65%(P<0.01);与模型组相比,钩藤碱高、中、低剂量组和尼卡地平组在心肌组织中中叶素蛋白水平的表达分别升高1.95倍、97.07%、27.92%和1.91倍,差异有统计学意义(P<0.05或P<0.01),见图1,表4。
表3 各组HM/BM、Hyp、ET-1、CRLR的变化 (±s,n=8)Tab.3 Changes of HM/BM,Hyp,ET-1,CRLR in all groups(±s,n=8)

表3 各组HM/BM、Hyp、ET-1、CRLR的变化 (±s,n=8)Tab.3 Changes of HM/BM,Hyp,ET-1,CRLR in all groups(±s,n=8)
注:与假手术组相比,ΔP<0.05,ΔΔP<0.01;与模型组相比,★P<0.05,★★P<0.01。
组 别 全心质量指数/(mg·g-1) 羟脯氨酸/(mg·g-1) 内皮素/(pg·mL-1) 降钙素受体样蛋白(pg·mL-1)假手术组2.77±0.19 0.44±0.08 3.17±0.46 210.8±17.1模型组 3.61±0.22ΔΔ 0.87±0.11ΔΔ 6.25±0.72ΔΔ 275.5±19.9ΔΔ钩藤碱高剂量组 2.92±0.23★★ 0.47±0.09★★ 3.37±1.02★★ 452.5±20.5ΔΔ★★钩藤碱中剂量组 3.05±0.24Δ★★ 0.68±0.11ΔΔ★★ 4.54±1.31Δ★★ 389.5±23.2ΔΔ★★钩藤碱低剂量组 3.32±0.21ΔΔ★ 0.81±0.08ΔΔ 5.63±0.98ΔΔ 300.3±20.8ΔΔ★尼卡地平组 2.87±0.24★★ 0.46±0.09★★ 3.32±0.85★★ 453.9±21.1ΔΔ★★

图1 各组大鼠心肌组织中中叶素的蛋白表达 (×400)Fig.1 Intermedin level in myocardium protein expression in all groups
表4 各组大鼠心肌组织中叶素的蛋白表达(以累积光密度进行比较)(±s,n=8)Tab.4 Intermedin level in myocardium protein expressionin all groups(compared with IOD)(±s,n=8)
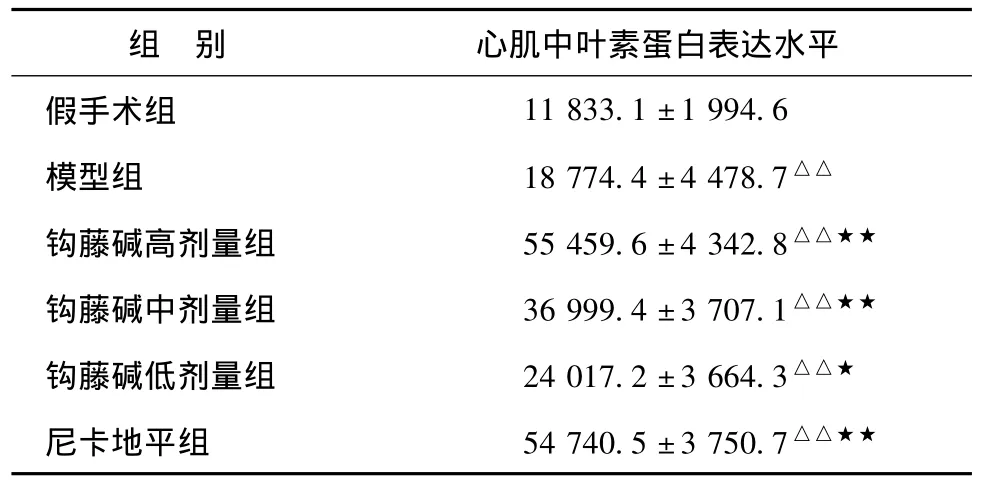
表4 各组大鼠心肌组织中叶素的蛋白表达(以累积光密度进行比较)(±s,n=8)Tab.4 Intermedin level in myocardium protein expressionin all groups(compared with IOD)(±s,n=8)
注:与假手术组相比,△P<0.05,△△P<0.01;与模型组相比,★P<0.05,★★P<0.01。
组 别 心肌中叶素蛋白表达水平假手术组11 833.1±1 994.6模型组 18 774.4±4 478.7△△钩藤碱高剂量组 55 459.6±4 342.8△△★★钩藤碱中剂量组 36 999.4±3 707.1△△★★钩藤碱低剂量组 24 017.2±3 664.3△△★尼卡地平组 54 740.5±3 750.7△△★★
2.3 心肌组织中RAMPs mRNA表达的变化 与假手术组相比,模型组大鼠心肌组织的 RAMP1、RAMP2、RAMP3 mRNA的表达显著提高 (P<0.01);给药后,与模型组相比,钩藤碱高、中、低剂量组和尼卡地平组均能不同程度的提高RAMPs mRNA的表达,差异有显著性 (P<0.01或P<0.05),钩藤碱给药组对RAMP2、RAMP3 mRNA表达的上调更显著,见图2。
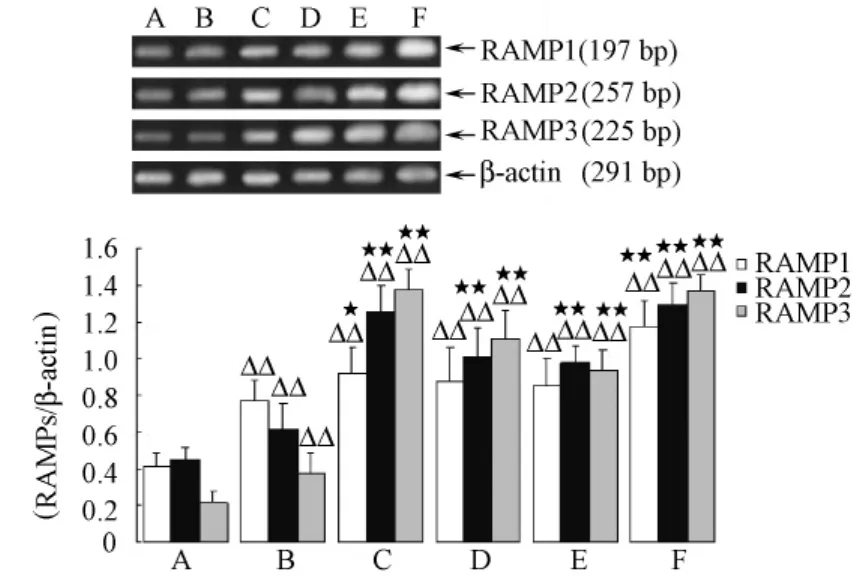
图2 各组大鼠心肌组织RAMPs mRNA的表达 (±s,n=8)Fig.2 Expression of RAMPs mRNA in myocardium in all groups(±s,n=8)
3 讨论
近些年来研究表明血管活性肽在高血压病的发生、发展及转归中起着极其重要的作用;中叶素是2004年新发现的一种血管活性肽,在心血管系统具有降低大鼠外周阻力[10],舒张大鼠血管[11],并且在减少心肌梗死面积、改善心功能[3-4]以及心肌纤维化和心肌缺血损伤和中发挥着重要的作用[12-14]。肾性高血压是一种由于肾动脉狭窄而造成肾血流量减少而激活肾素-血管紧长素系统(RAS)造成的一种常见的继发性高血压,存在明显的心肌肥厚和纤维化,本实验采用两肾一夹方法复制继发性高血压模型,采用钩藤碱和尼卡地平进行干预。结果显示:造模后,HM/BM、Hyp均有显著提高,反映了心肌细胞的增生与肥厚及纤维化程度;心肌组织中ET-1、CRLR、中叶素及RAMPs mRNA的表达升高,提示在肾性高血压时机体代偿性增加中叶素的水平,其与贾月霞等[15]报道基本一致;给药后,钩藤碱各剂量均能不同程度的降低HM/BM、Hyp,显示其具有心肌保护的作用。而ET-1水平降低,CRLR、中叶素及 RAMPs mRNA的表达升高,提示给药钩藤碱后机体可能通过上调心肌中叶素及其受体的表达和降低ET-1的水平来对抗高肾素和AngⅡ引起心脏负荷增加等效应,产生心肌保护作用。
[1]Roh J,Chang C L,Bhalla A,et al.Intermedin is a calcitonin/calcitonin gene-related peptide family acting through the calcitonin receptor-like receptor/receptor activity-modifying protein receptor complexes[J].J Biol Chem,2004,279(8):7264-7274.
[2]Takei Y,Inoue K,Ogoshi M,et al.Identification of nover adrenomedullin in mammals:a potent cardiovascular and renal regulator[J].Febs Lett,2004,556(1-3):53-58.
[3]Grossini E,Molinari C,Mary D A,et al.Intracoronary intermedin1~47augments cardiac perfusion and function in anesthetized pigs:role of calcitonin receptors and beta-adrenoreceptormediated nitric oxide release[J].Appl Physiol,2009,107(4):1037.
[4]Song J Q,Teng X,Cai Y,et al.Activation of Akt/GSK-3 beta signaling pathway is involved in intermedin 1 ~53 protection against myocardial apoptosis induced by ischemia/reperfusion[J].Apoptosis,2009,14(11):1299-1307.
[5]Phillipson J D ,Hemingway S R.Chromatographic and spectroscopic methods for the identification of alkaloids from herbarium samples of the genusUncaria[J].Chromatogr,1975,105:163-178.
[6]周凤梧.实用中药学[M].济南:山东科学技术出版社,1985:385.
[7]张丽心,孙 涛,曹永孝.钩藤碱的降压及舒张血管作用[J]. 中药药理与临床,2010,26(5):39-41.
[8]Duke L M,Widdop R E,Kett M M,et al.AT2 receptors mediate tonic renal medullary vasoconstriction in renovascular hypertension[J].Br J Pharmacol,2005,144(4):486-492.
[9]Zhang N B,Huang Z G,Cui W D,et al.Effects of puerarin on expression of cardiac Smad3 and Smad7 mRNA in spontaneously hypertensive rat[J].J Ethnopharmacol,2011,138(3):737-740.
[10]Ren Y S,Yang J H,Zhang J,et al.Intermedin 1 ~53 in central nervous system elevates arterial blood pressure in rats[J].Peptides,2006,27(1):74-79.
[11]Abdelrahman A M,Pang C C.Effect of intermedin/adrenomedullin-2 on venous tonein conscious rats[J].Naunyn Schmiedeberg's Arch Pharmacol,2006,373(5):376-380.
[12]Yang J H,Cai Y,Duan X H,et al.Intermedin 1~53 inhibits rat cardiac fibroblast activation induced by angiotensinⅡ[J].Regul Pept,2009,27,158(1-3):19-25.
[13]Zhang H Y,Jiang W,Liu J Y,et al.Intermedin is upregulated and has protective roles in a mouse ischemia/reperfusion model[J].Hypertens Res,2009,32(10):861-868.
[14]贾月霞,潘春水,耿 彬,等.Intermedin1~53保护异丙基肾上腺素诱导的心肌损伤[J].中国药理学通报,2005,21(12):1454-1459.
[15]贾月霞,梁 颖,薛立华,等.Intermedin1~53对两肾一夹高血压大鼠的影响及其机制[J].中国药理学通报,2011,27(1):46-49.
