黄芪甲苷抑制心肌肥厚的机制与TLR-4/NF-κB信号通路相关
2013-08-28何海洋王洪新喻晓春
何海洋, 王洪新*, 张 晶, 喻晓春
(1.辽宁省心脑血管药物基础研究重点实验室,辽宁锦州 121001;2.中国中医科学院医学实验中心,北京 100700)
心肌肥厚是心脏对急、慢性血流动力学超负荷的一种基本的适应性反应,长期的心肌肥厚可引起心血管疾病发生率及死亡率增高[1]。由于心肌组织长期受到压力负荷的刺激,机体通过多种调节方式使心脏产生各种分泌因子,使心脏能够适应这种刺激。Toll样受体-4(TLR-4)是连接先天免疫和特异性免疫的跨膜信号转导受体,在心脏中也有较高水平的表达,可以介导多种内源性的刺激反应。例如大分子的降解产物、蛋白水解产物、细胞破裂后释放的细胞内成分以及炎症活化的基因产物等[2],细菌脂多糖 (LPS)就是其内源性配体之一[3]。NF-κB是许多促炎因子黏附分子的转录调节因子,参与许多炎症等病理过程。在心肌组织中,NF-κB可被多种引起心肌肥厚的刺激因子活化引起心肌细胞肥大,它的过表达还可启动心房利钠肽 (ANP)、脑钠肽 (BNP)的表达[4]。NF-κB 还可以与MAPK等其他导致肥厚的信号转导通路之间交互作用,共同促进肥厚的发生发展[5]。研究证实 TLR-4的活化可以激活 NF-κB,相反 NF-κB基础水平的表达也是维持 TLR-4的表达所必须的[6]。因此认为 TLR-4/NF-κB信号通路是引起心肌肥厚的重要通路之一。本实验室前期研究证实黄芪甲苷具有抑制大鼠心肌肥厚的作用[7],体外实验也证实黄芪甲苷可以抑制由LPS诱导的心肌细胞肥大[8],因此本研究着重探讨在体条件下,黄芪甲苷是否通过TLR-4/NF-κB信号通路来抑制心肌肥厚,进一步阐述黄芪甲苷抑制心肌肥厚的作用机制。
1 材料与方法
1.1 动物 Spargue-Dawley(SD)大鼠,雌雄不限,2月龄,体质量220~250 g,由辽宁医学院动物实验中心提供,动物合格证号:SCXK(辽)20030007。
1.2 药品、试剂和仪器 黄芪甲苷原料药 (纯度大于98%,成都曼斯特生物科技有限公司),辛伐他丁原料药 (SIGMA),TNF-α和 IL-1β ELISA试剂盒 (R&D公司),Trizol、ANP mRNA试剂盒、(大连宝生物 Takara公司)、p2I κ B2 α多克隆抗体 (Santa Cruz公司)、1∶100、I κ B2 α 多克隆抗体及1∶100、GAPDH多克隆抗体 (武汉博士德公司),HRP标记羊抗兔IgG(武汉博士德公司),细胞核蛋白与细胞浆蛋白抽提试剂盒 (碧云天公司),其它试剂均为国产分析纯。Carl Zeiss生物显微镜 (德国)。TGL—16G低温高速离心机 (日本日立公司),梯度PCR分析仪 (英国TECHNE公司,型号:TC—512),改良的Langendorff心脏灌流装置 (国产)。
1.3 动物模型制备和分组给药 分组方法:SD大鼠220~250 g(由辽宁医学院实验动物中心提供)40只,随机分为5组,每组8只。分别是假手术组、心肌肥厚模型组 (模型组)、黄芪甲苷低剂量组[40 mg/(kg·d)]、黄芪甲苷高剂量组[80 mg/(kg·d)]、辛伐他丁组[40 mg/(kg·d)]。术后1周灌喂给药,假手术组、心肌肥厚模型组给予蒸馏水,至12周麻醉处死,进行指标检测。
所有心肌肥厚模型均采用腹主动脉缩窄术造模。手术方法参见已有文献 [7]。假手术组处理同上,但不进行结扎。
1.4 HMI和LVMI测定 全心质量指数 (heart mass index,HMI)=全心质量 (mg)/体质量(g)、左心室质量指数 (leftventricular mass index,LVMI)=左心室质量 (mg)/体质量 (g),以此反映心肌肥厚的程度。麻醉后开胸取心,将取出心脏立即置入4℃的KB液漂洗 (95%O2~5%CO2饱和),清洗后于冰浴培养皿中,剔除非心肌组织,用滤纸吸干多余水分,置分析天平上称全心质量,再迅速剪去右心室游离壁,取左室及室间隔称左心质量,进行计算。
1.5 组织学观察 横向截取心尖部位 (包括室间隔)约0.5 cm,置10%中性甲醛缓冲液固定,24 h后行石蜡包埋、切片 (5 μm)、常规HE染色后置显微镜下,测量心肌细胞横径,计算平均值,测量时采用单盲法进行,每组选取20个细胞。参照已有文献进行[9]。
1.6 ELISA法检测血清中TNF-α和 IL-1β水平 按照说明书操作,取出96孔反应板,分别加入50 μL标本 (或对照液或标准品)于反应孔里,吸取10 μL(TNF-α或IL-1β)抗体至反应孔里,室温下孵育1 h,吸出液体,洗板3次,加50 μL显色液,室温孵育15 min,每孔加入50 μL终止液。全自动酶标仪在450 nm波长读取吸光度值,绘制标准曲线,根据各标本吸光度值在标准曲线上查得相应的浓度。
1.7 RT-PCR法测量左心室心肌 ANP mRNA及TLR-4 mRNA的表达 根据已有文献进行操作[7]。取约100 mg鼠心脏组织放于玻璃研磨器内。取约1 μg总RNA,进行反转录。反转录条件为42℃60 min,99℃ 2 min,4℃保存。ANP的引物序列(5'-3')为GGC TCC TTC TCC ATC ACC AA TGT TAT CTT CGG TAC CG[8],内参 GAPDH的引物序列(5'-3')为CAA AGT TGT CAT GGA TGA CCA TGG AGA AGG CTG GG。上述引物由北京奥科生物有限公司合成,灭菌水溶解并配制成100 μmol/L的上下游引物混合液,使用浓度为 20 μmol/L。PCR反应条件为预变性94℃ 4 min,变性94℃ 45 s,退火60℃ 45 s,延伸72℃ 45 s,终末延伸72℃ 5 min,4℃终止,20循环。TLR-4引物序列为5'-GGGTGAGAAACGAGCT-3';内参GAPDH的引物序列为5'-CATCACCATCTTCCAGGAGC-3';反转录5'-GGATGATGTTCTGGGCTGCC-3'。反应条件为94℃ 2 min,然后进行30个循环,94℃ 30 s,60℃ 60 s,72℃ 1.5 min,最后72℃10 min。循环扩增结束后,取6 μL产物进行2%琼脂糖凝胶电泳。电泳结束后,置于凝胶成像系统进行观察和分析。
1.8 Western bolotting检测大鼠左心室组织中NF-κB蛋白的表达 匀浆左心室心肌组织100 mg,按照细胞核蛋白与细胞浆蛋白抽提试剂盒的操作说明提取蛋白,BCA法进行蛋白定量,将各组蛋白浓度调成一致,沸水煮5 min待用。各组取样品30 μg,以样品中的GAPDH为内参,经SDS2PA GE凝胶电泳,转膜,然后用含5%脱脂奶粉PBS封闭2 h,分别加入适量含2%脱脂奶粉PBS稀释的兔抗大鼠 p2I κ B2 α 多克隆抗体 1 ∶100、I κ B2 α多克隆抗体1∶100、GAPDH多克隆抗体1∶200、4℃孵育过夜 ,PBS洗膜3次 ,10 min/次,再分别加入适量含2%脱脂奶粉,PBS稀释的HRP标记羊抗兔IgG 1∶5 000室温下作用2 h,PBS洗膜3次,10 min/次ECL化学发光显色、压片、显影、定影、胶片扫描保存用 Gel2Pro Analyzer(Ver 1 310)软件测定蛋白条带灰度值,以 p2I κ B2 α与 I κ B2 α条带灰度值与内参β-action条带灰度值的比值将p2I κ B2 α 与 I κ B2 α 表达量化。利用图像分析软件读取各组NF-κB和的蛋白印迹密度值,用各组NF-κB/β-action 的值来比较 NF-κB 表达的强弱。
1.9 统计学分析 应用SPSS13.0统计分析软件,所有数据均以均数±标准差 (±s)表示。统计学处理采用单因素方差One-Way ANOVA分析,方差齐采用LSD进行多重比较。方差不齐采用Dunnett'sT3法进行多重比较。P<0.05认为有差异有统计学意义,P<0.01认为有显著性差异,P>0.05差异无统计学意义。
2 结果
2.1HMI和LVMI测定结果 模型组的HMI和LVMI值显著高于假手术组 (P<0.01),表明该组大鼠已经出现以左心室肥厚为特征的心肌肥厚。黄芪甲苷高剂量组与辛伐他丁组的HMI和LVMI值低于模型组(P<0.05);黄芪甲苷低剂量组的HMI和LVMI值虽低于模型组,但无统计学意义 (P>0.05),说明高剂量黄芪甲苷有抑制心肌肥厚的作用,低剂量黄芪甲苷的治疗作用不如高剂量组显著。详见表1。
表1 黄芪甲苷对心肌肥厚大鼠HMI和LVMI的影响(±s)Tab.1 Influence of astragaloside IV on HMI and LVMI in rats model of myocardial hypertrophy(±s)

表1 黄芪甲苷对心肌肥厚大鼠HMI和LVMI的影响(±s)Tab.1 Influence of astragaloside IV on HMI and LVMI in rats model of myocardial hypertrophy(±s)
注:与假手术组比较,*P<0.05,**P<0.01;与模型组比较,#P <0.05,##P <0.01。
分 组 HMI/(mg·g-1) LVMI/(mg·g-1)假手术组2.83±0.16 1.62±0.10模型组 3.42±0.21** 2.41±0.17**黄芪甲苷低剂量组 3.31±0.28** 2.31±0.15**黄芪甲苷高剂量组 3.08±0.31*# 2.17±0.19*#辛伐他丁组 2.96±0.29## 2.19±0.16##
2.2 组织学观察 假手术组大鼠心肌细胞横径均值为 (26.45±2.27)μm,模型组大鼠心肌细胞横径增加至 (34.15±2.17)μm,增加了29.11%(P<0.01),说明模型组大鼠心肌细胞发生明显肥大。黄芪甲苷低剂量组大鼠心肌细胞横径为(32.58±2.09)μm,黄芪甲苷高剂量组细胞横径为 (28.32±2.56)μm,与模型组相比减小了17.07% (P<0.05)。辛伐他丁组细胞横径为(29.67±2.87)μm。见图1,图2。
2.3 血清中TNF-α和IL-1β的水平检测结果 通过表2可以看出,发生心肌肥厚的大鼠 (模型组)血清中的TNF-α和IL-1β的水平明显高于假手术组(P<0.01),说明心肌肥厚的形成伴有炎症因子的激活。高剂量黄芪甲苷和辛伐他丁具有降低心肌肥厚的大鼠血清中的 TNF-α和 IL-1β水平作用(P<0.05),低剂量黄芪甲苷有一定的治疗作用,但没有高剂量组显著。

图1 心肌肥厚大鼠左心室细胞冠状面HE染色切片Fig.1 Coronal plane from left ventricular tissue in rats model of myocardial hypertrophy(HE×200)
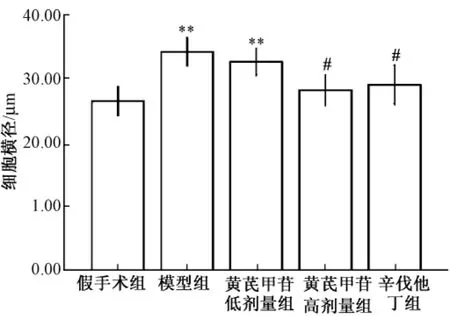
图2 各组心肌细胞横径柱状图 (±s)Fig.2 Bar graph of the trans diameter of left ventricular cells diameter in rats model of myocardial hypertrophy
表2 心肌肥厚大鼠血清中TNF-α和IL-1β的水平Tab.2 Content of TNF-α and IL-1β in serum of myocardial hypertrophy of rats(±s)

表2 心肌肥厚大鼠血清中TNF-α和IL-1β的水平Tab.2 Content of TNF-α and IL-1β in serum of myocardial hypertrophy of rats(±s)
注:与假手术组比较,*P<0.05,**P<0.01;与模型组比较,#P <0.05,##P <0.01。
分 组 TNF-ɑ/(ng·L-1) IL-1β/(pg·L-1)假手术组45.72±19.43 78.26±13.95模型组 108.85±31.64** 469.31±45.73**黄芪甲苷低剂量组 98.90±26.17** 425.19±61.80**黄芪甲苷高剂量组 71.94±18.28*# 115.07±26.46*#辛伐他丁组 64.33±27.54*# 106.28±17.52*#
2.4 左心室组织中ANP mRNA及TLR-4 mRNA的表达 通过计算机凝胶成像系统可以看出,模型组的ANP mRNA反转录后表达的量明显高于假手术组 (P<0.01),黄芪甲苷高剂量组和辛伐他丁组的ANP mRNA表达的量小于模型组 (图3A)。观察各组TLR-4 mRNA的表达,模型组的TLR-4 mRNA反转录后表达的量同样明显高于假手术组,黄芪甲苷高剂量组和辛伐他丁组的TLR-4 mRNA表达的量明显小于模型组 (图3B),各组TLR-4 mRNA表达该组ANP mRNA的表达趋势一致 (表3)。
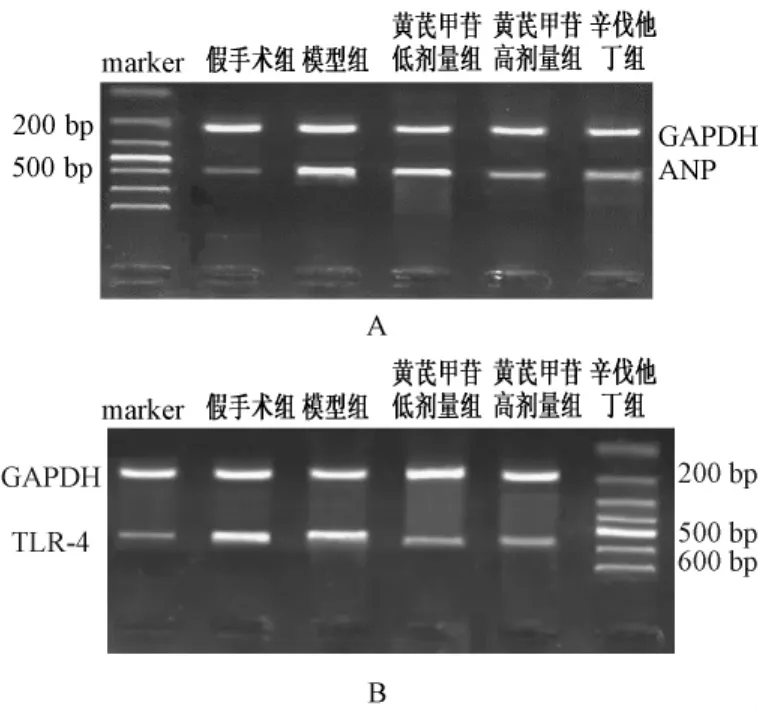
图3RT-PCR法检测大鼠左心室组织ANP(A)与TLR-4(B)mRNA表达的图像Fig.3 mRNA levels of ANP(A)and TLR-4(B)from left ventricular tissue in rats by RT-PCR
表3 左心室组织中ANP mRNA及TLR-4 mRNA的表达Tab.3 mRNA levels of ANP and TLR-4 from left ventricular tissue in rats by RT-PCR(±s)
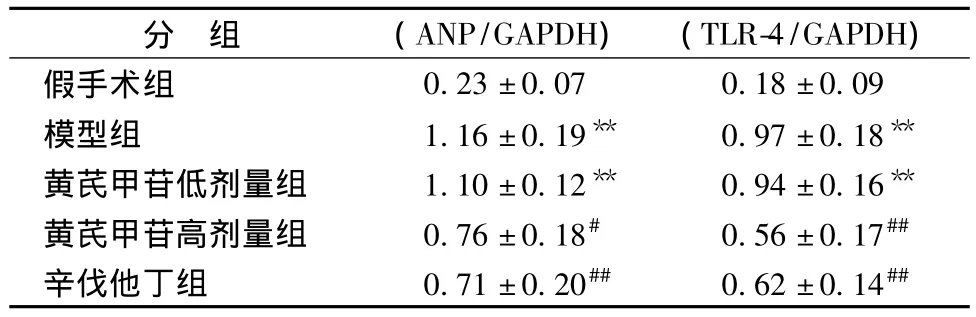
表3 左心室组织中ANP mRNA及TLR-4 mRNA的表达Tab.3 mRNA levels of ANP and TLR-4 from left ventricular tissue in rats by RT-PCR(±s)
注:与假手术组比较,*P<0.05,**P<0.01;与模型组相比较,#P <0.05,##P <0.01。
分 组 (ANP/GAPDH) (TLR-4/GAPDH)假手术组0.23±0.07 0.18±0.09模型组 1.16±0.19** 0.97±0.18**黄芪甲苷低剂量组 1.10±0.12** 0.94±0.16**黄芪甲苷高剂量组 0.76±0.18# 0.56±0.17##辛伐他丁组 0.71±0.20## 0.62±0.14##
2.5 大鼠左心室组织中NF-κB蛋白的表达 由图4、图5可以看出,模型组的IκBα蛋白的表达最高,而假手术组最低,两组蛋白印迹相对密度分别为 (1.05±0.12)和 (0.32±0.09),模型组的IκBα蛋白表达远高于假手术组 (P<0.01)。高剂量黄芪甲苷和辛伐他丁能够降低肥厚心肌组织中IκBα蛋白的表达,其蛋白印迹的相对密度分别为(0.77±0.15)和 (0.81±0.17)。黄芪甲苷低剂量组IκBα蛋白印迹相对密度为 (0.98±0.19),与模型组比较无差异 (P>0.05),并且各组的IκBα蛋白表达的高低与该组ANP mRNA及TLR-4 mRNA表达的高低一致。
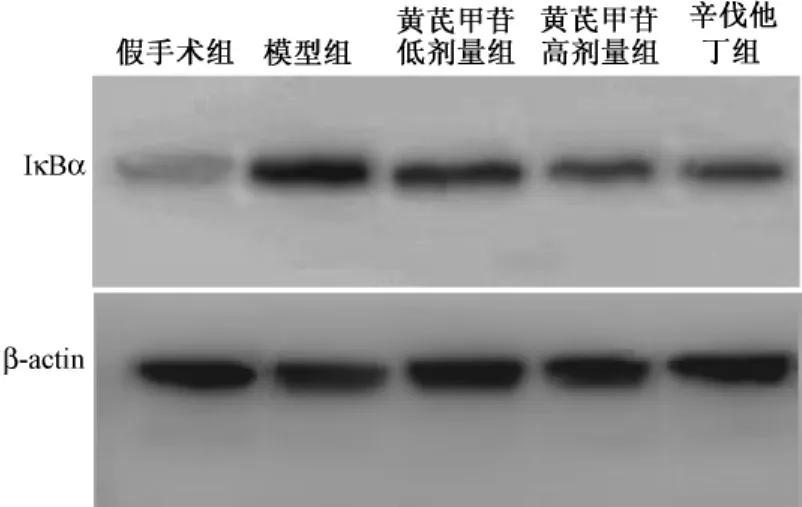
图4 Western bolotting检测大鼠左心室组织中NF-κB的蛋白表达的图像Fig.4 Protein expression of NF-κB from left ventricular tissue in rats by Western bolotting
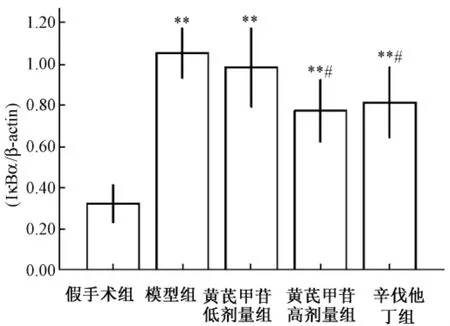
图5 比较大鼠左心室组织中NF-κB的蛋白表达的柱状图 (±s,n=3)Fig.5 Bar graph of the protein expression of NF-κB from left ventricular tissue in rats
3 讨论
从全心质量指数、左心室质量指数和细胞横径这些形态学指标可以看出黄芪甲苷具有抑制心肌肥厚的作用,并且高剂量组的抑制效果更为明显。ANP是心肌肥大的标志性基因之一,ANP mRNA表达量的大小可以从基因层面准确的反映心室肥厚的程度[9]。从图3A可以看出黄芪甲苷组的ANP mRNA表达低于模型组,且高剂量组更为显著与辛伐他丁组的表达无差异 (表3),因此可以认为黄芪甲苷具有抑制大鼠心肌肥厚的作用,高剂量的效果与辛伐他丁相当。
TLRs普遍存在于多种类型细胞的胞膜上或胞浆中,可启动宿主防卫反应,引发组织损伤感染以及组织重构等生理或病理过程。它在胞浆内的结构域与IL-1受体相似,能够启动IRAK-TRAF6信号途径,最终活化核转录因子NF-κB[10]。在机体受到感染或长期处于应激状态下,原本在细胞内的一些物质会被释放到细胞外,并且作为危险信号刺激TLR-4。比如存在于线粒体中的HSP60(热休克蛋白60)释出细胞后可激活 TLR-4,导致黏附因子的表达和炎症介质的释放,如IL-1和TNF-α,另外还可以激活 IL-12和 IL-15[11]。在心肌细胞中,TNF-α和Ang II能增加TLR-4的表达,而在肥厚心肌中TNF-α和Ang II的水平是明显高于正常心肌组织的[12]。本研究中模型组大鼠血清中TNF-α和IL-1β的水平显著升高,左心室组织TLR-4 mRNA高表达,说明机械牵张力对心脏的长期刺激,引起了炎症因子的释放,活化了TLR-4,并最终引起NF-κB的表达显著升高。NF-κB作为心肌肥厚刺激因子的下游靶点,通过诱导炎症、免疫活性分子的表达,发挥防御和免疫调节作用,参与心肌肥厚的形成;此外,NF-κB本身的过度表达也可以造成胚胎基因的表达和心肌细胞肥大[13-14]。本研究中,模型组大鼠血清中TNF-α和IL-1β的水平显著升高(表2),左心组织中TLR-4 mRNA的表达 (图3B)和NF-κB蛋白的表达 (图4)也显著升高,当给予黄芪甲苷干预后,上述指标均有下降。表明由炎性因子 (TNF-α 和IL-1β)/TLR-4/NF-κB介导的信号通路参与心肌肥厚的形成,黄芪甲苷的作用机制与该通路有关。
需要指出的是,TLR-4的内源性配体较多,如黏多糖,GAGs、纤维连接蛋白中的 EDA片段、HSP家族等[15]。经TLR-4介导后,活化单核巨噬细胞和内皮细胞分泌的TNF-α、IL-1、IL-6等促炎因子,这些因子可通过MyD88依赖性和非MyD88依赖性两种途径激活下游的 NF-κB信号。另外TNF-α还会以旁分泌方式再次作用与TLR-4,形成正反馈[16]。因此,黄芪甲苷是否参与TLR-4上游或NF-κB上游其它的转导信号的调解还有待深入研究。
[1]Shimizu J,Yamashita D,Misawa H,et al.Increased O2consumption in excitation-contraction coupling in hypertrophied rat heart slices related to increased Na+-Ca2+exchange activity[J].J Physiol Sci,2009,59(1):63-74.
[2]Johnson G B,Brunn G J,Platt J L.Activation of mammalian Toll-like receptors by endogenous agonists[J].Crit Rev Immu-nol,2003,23(1-2):15-44.
[3]Frantz S,Kobzik L,Kim Y,et al.TLR-4 expression in cardiac myocytes in normaland failing myocardium[J].J Clin Invest,1999,104(3):271-280.
[4]Chandrasekar B,Mummidi S,Claycomb W C,et al.Interleukin-18 is a pro-hypertrophic cytokine that acts through a phosphatidylinositol 3-kinase-phosphoinositide-dependent kinase-1-Akt-GATA4 signaling pathway in cardiomyocytes[J].J Biol Chem,2005,280(6):4553-4567.
[5]Rauvala H,Rouhiainen A.RAGE as a receptor of HMGBI(Amphoterin):Roles in health and disease[J].Curr Mol Med,2007,7(8):725-734
[6]Akira S,Hemmi H.Recognition of pathogen-associated molecular patterns by TLR family[J].Immunol Lett,2003,85(2):85-95.
[7]张 晶,王洪新,宋 莹,等.黄芪甲苷抑制大鼠心肌肥厚及改善心肌能量代谢的作用观察[J],中成药,2012,34(5):924-928.
[8]周振华,王洪新,赵素玲,等.黄芪多糖对脂多糖诱导心肌细胞肥大的保护作用[J].中草药,2012,43(3):524-528.
[9]Takemori E,Hasegava Y,Kalahira J,et al.Effects of benazepril hydrochloride on cardiac hypertrophy in spontaneously hypertensive rats[J].Arzneimittelforschung,1991,41(6):612-615.
[10]符民桂,唐朝枢.心肌细胞肥大的信号转导通路[J].生理科学进展,2000,31(1):19-24.
[11]Ulloa L,Messmer D.High-mobility group box l(HMGB 1)protein:Friend and foe[J].Cytokine Growth Factor Rev,2006,17(3):189-201.
[12]Ohashi K,Burkart V,Flohé S,et al.Cutting Edge:Heat shock protein 60 is a putative endogenous ligand of the toll-like receptor 4 complex[J].J Immunol,2000,164(2):558-561.
[13]Zeuke S,Ulmer A J,Kusumoto S,et al.TLR4-mediated inflammatory activation of human coronary artery endothelial cells by LPS[J].Cardiovasc Res,2002,56(1):126-134.
[14]Van-der-Kaaij N P,Bogers A J.Cytokines link Toll-like receptor 4 signaling to cardiac dysfunction after global myocardial ischemia[J].Ann Thorac Sung,2008,85(5):1678-1685.
[15]Hollestelle S C,De-Vries M R,Van-Keulen J K,et al.Tolllike receptor 4 is involved in outward arterial remodeling[J].Circulation,2004,109(3):393-398.
[16]Kalinina N,Agrotis A,Antropova Y,et al.Increased expression of the DNA-binding cytokine HMGB1 in human atherosclerotic lesions:role of activated macrophages and cytokines[J].Arterioseler Thromb Vasc Biol,2004,24(12):2320-2325.
