SRH蛋白抑制SHR大鼠动脉粥样硬化发展
2013-08-16龙民慧朱泽轶王园园武立昌白喜龙刁爱坡王嘉玺邹民吉徐东刚
龙民慧,朱泽轶,王园园,武立昌,白喜龙,刁爱坡*,王嘉玺,邹民吉,徐东刚*
(1.华南师范大学生命科学学院,广东广州510631;2.军事医学科学院基础医学研究所,北京100850;3.天津科技大学生物工程学院,天津300457)
高血压是动脉粥样硬化发生的主要风险因素之一,大多数与高血压相关的心血管病是动脉粥样硬化并发症.因此,高血压动脉粥样硬化防治的研究是热点问题.SRH系是军事医科院研制的一种重组多功能融合蛋白[1],与现有的葡激酶相比,除了有溶栓作用、抗凝等特点.炎症在动脉粥样硬化发生、发展过程中起着重要作用.已有研究证实SRH能够通过减弱炎症从而干预动脉粥样硬化的发展并且具备安全性高等特点[2-3],是良好的抗动脉硬化药物,但是对其是否抑制高血压症并发动脉粥样硬化的作用及机制研究尚未开展.
SHR大鼠(Spontaneously hypertensive rat,SHR)能自发形成高血压,血管易发生损伤,自发改变血液状态和引起血管重构,形成斑块,最后导致血管狭窄和斑块不稳,血栓形成.该大鼠模型除了用于抗高血压药物研发,也经常用于研究抗动脉粥样硬化药物的动物模型,研究表明在饮食中添加脂类物质就能迅速提高SHR血脂水平,容易引起脂肪沉着,形成斑块.目前,用SHR模型评价抗动脉粥样硬化药物研究集中在干预血管重构、改变血液粘稠度和凝血指标变化以及炎症指标变化上,有部分研究也开始观察SHR的血脂变化和动脉粥样斑块关系.本文旨在通过高血压大鼠动脉粥样硬化模型,观察葡激酶突变体SRH对自发性高血压症大鼠动脉粥样硬化发展的保护作用,为探讨其抗动脉粥样硬化提供依据.
1 材料和方法
1.1 材料
重组SRH蛋白由军事医学科学院基因组工程研究室所提供;血液生化指标检测所用仪器及相关试剂由北京中同蓝博临床检验所提供;卵清白蛋白干粉和牛血清白蛋白干粉购自Sigma公司;牛脱氧胆酸钠、胆固醇干粉购自北京普博欣生物科技有限公司;蛋黄粉、猪大油和白糖由军事医学科学院实验动物中心提供;丙基硫氧嘧啶购自北京红惠生物制药股份有限公司.
1.2 试验方法
1.2.1 大鼠模型筛选和动脉粥样硬化模型建立正常大鼠WKY(Wistar Kyoto)大鼠20只,购自北京维通利华,动物编号为:SCXK(京)2006-0009,入选标准为:①180~200 g;②9周龄雄性大鼠;③试验前经全面观察无异常表现.在恒温(20℃ ±2℃)恒湿(50% ±5%)条件下饲养,自由饮水,每天人工照明12 h,正常饲料喂养5周,作为正常对照.20只雄性SHR大鼠,购自北京维通利华,动物编号为:SCXK(京)2006-0009,入选标准同WKY大鼠入选标准,用于建立大鼠的动脉粥样硬化模型.SHR大鼠适应性喂养1周后,给予高脂饲料(20%猪大油、5%白糖、3%胆固醇、0.5%胆酸钠、0.2%丙基硫氧嘧啶、1%的蛋氨酸、1%维生素D,2%蛋黄粉,68%的基础饲料)喂养4周并在高脂饲料开始喂养时进行免疫刺激,通过尾静脉注射牛血清白蛋白,浓度按照32 mg/kg体重,频次为每周3次,共3周;在牛血清白蛋白刺激的过程中同时用卵清白蛋白进行腹腔免疫,2.5 mg/kg,每3日1次,共3次.高脂饲料喂养1周后给大鼠一次性灌注维生素D3(25万U/kg).在恒温(20℃ ±2℃)恒湿(50% ±5%)条件下饲养,自由饮水,每天人工照明12 h,高脂饲料喂养4周.
1.2.2 试验分组及给药方法 饲养5周后,20只WKY大鼠体重为205~221 g,平均为 (209±6.18)g;20只SHR大鼠体重225~247 g,平均体重为 (236±6.94)g.2种大鼠分别随机分为生理盐水组和SRH组,每组10只,生理盐水组大鼠注射0.4 mL生理盐水;SRH组大鼠按0.5 mg/kg体重给药.SRH经生理盐水稀释后2 min内完成尾静脉注射,每2天1次,共10次.
1.2.3 观察指标
(1)临床表现 观察实验动物出血情况,观察部位有牙龈、脚趾、嘴、眼、耳、鼻、肛门、阴茎等尤其是注射部位及皮肤粘膜、内脏和颅内等,并监测活动、饮食和外观等生命体征.
(2)生理生化指标检测 在给药前和最后1次给药后24 h后,通过静脉采血采取所有大鼠血液,血液与枸椽酸钠(0.13 mol/L)按9∶1 抗凝,3 000 r/min离心10 min,分离血浆.并监测心电、血压生理指标.Beckman CXⅣ全自动生化分析仪分析生化指标,包括部分凝血酶时间(APTT)、凝血酶原时间(PT)、凝血酶时间(TT)、纤维蛋白原(FG)、纤溶酶原(PLG)、D二聚体(D-D)、总甘油三脂(TG)、总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)、肌酸激酶(CK)、肌酸激酶同工酶(CK-MB)、乳酸脱氢酶(LDH)、C反应蛋白(CRP),其操作按照相关的说明书进行.
1.3 统计学处理
实验结果的数据均表达为均数±标准差.各组数据之间显著性检验用多个样本均数比较及两两比较的ANOVA方差分析检验.
2 结果与分析
2.1 SRH对大鼠血脂水平的影响
生理盐水组大鼠和SRH组大鼠均无出血现象.注射SRH和生理盐水大鼠活动、饮食正常.注射SRH与注射生理盐水的WKY大鼠的TG、TC、LDL、HDL无显著性差异(P>0.05);但注射SRH与注射生理盐水的 SHR大鼠有显著性差异(P<0.05),SRH能降低高脂喂养SHR大鼠的血脂水平(表1).
2.2 SRH对大鼠凝血系统的影响
注射SRH与注射生理盐水的WKY大鼠的FG、APTT、TT、PT 无显著性差异(P >0.05);但注射SRH与注射生理盐水的SHR大鼠的FG、TT、PT有显著性差异,SRH能够降低高脂喂养大鼠的FG水平(P<0.05),延长高脂喂养大鼠的 TT、PT(P <0.05),对 APTT无任何影响(表2).
2.3 SRH对大鼠纤溶系统的影响
纤溶指标PIG、PAI、D-D在WKY大鼠及高血脂的SHR大鼠中,生理盐水组和SRH组均无显著性差异(P>0.05)(表3),表明SRH对纤溶系统无影响.
2.4 SRH对大鼠血清心肌酶谱变化的影响
注射SRH与注射生理盐水的WKY大鼠的CK、CK-MB、ASL、LDH 无显著性差异(P > 0.05)(表4);但注射SRH与注射生理盐水的SHR大鼠的CK-MB、ASL、LDH 有显著性差异(P < 0.05),SRH能够减弱SHR大鼠心血管系统损伤.
2.5 SRH对大鼠血压和心率变化的影响
注射SRH与注射生理盐水的WKY大鼠在处理前后的血压和心率无显著性差异(P>0.05)(表5);注射生理盐水的高血脂SHR大鼠在处理前后血压和心率有显著性差异(P<0.05),有明显的升高趋势,但注射SRH的高血脂SHR大鼠在处理前后血压和心率没有显著差异(P>0.05),比较注射生理盐水和SRH后的高血脂SHR大鼠的血压和心率有显著下降(P<0.05),表明SRH能有效降低高血脂SRH大鼠的血脂水平.
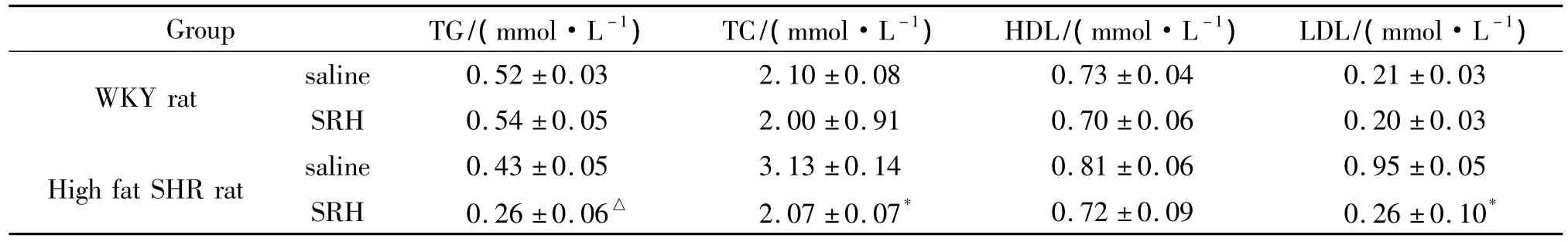
表1 SRH对大鼠血脂水平的影响Table 1 Effect of SRH on blood fat in rats

表2 SRH对大鼠凝血指标的影响Table 2 Effect of SRH on blood coagulation in SHR rats

表3 SRH对大鼠纤溶系统的影响Table 3 Effect of SRH on blood fibrinolysis in SHR rats
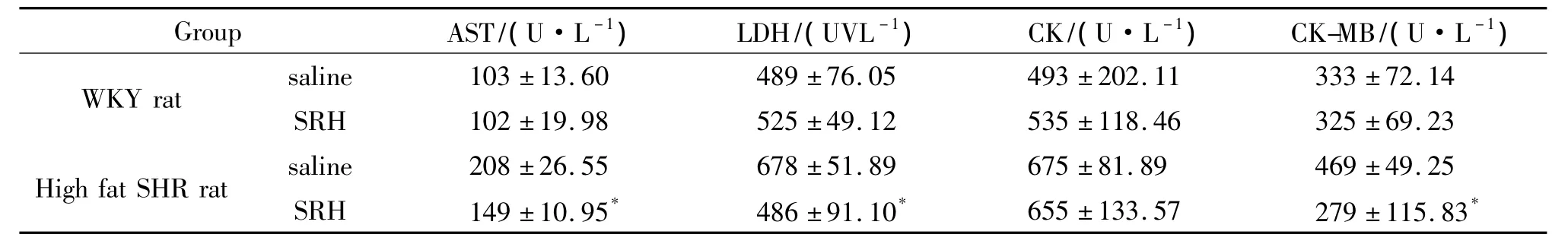
表4 SRH对大鼠血清损伤的影响Table 4 Effect of SRH on blood damage in SHR rat
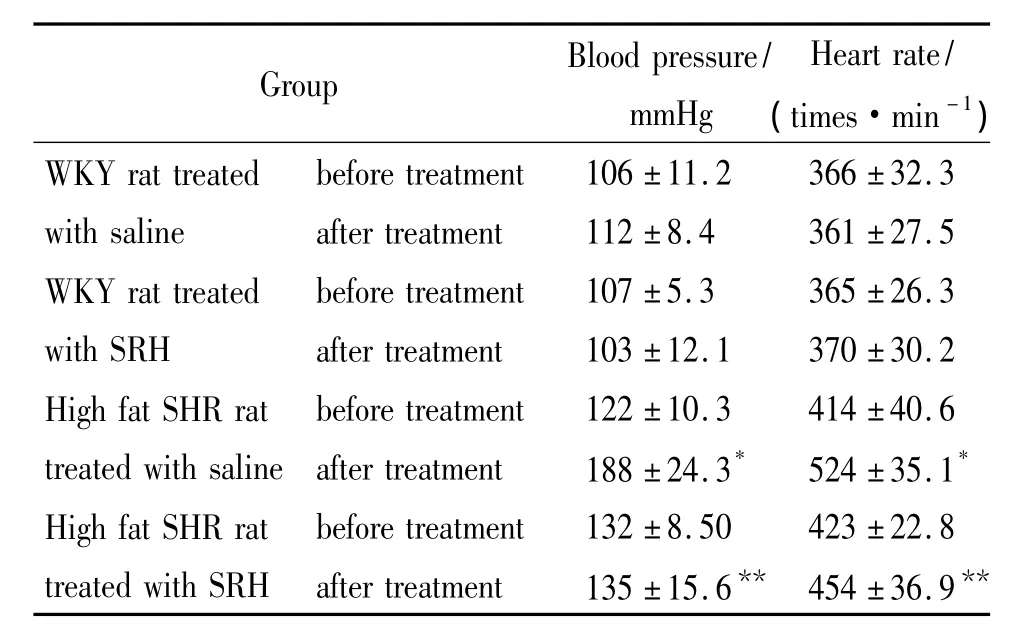
表5 SRH对大鼠心率和血压的影响Table 5 Effect of SRH on BP and BR in WKY rat
3 讨论
SHR大鼠易发生高血压症,高血压容易造成血栓或动脉斑块形成[4].本研究通过高脂饲料喂养14周龄SHR大鼠5周,SHR大鼠血浆TC、LDL水平升高,而与注射生理盐水的高血脂SHR大鼠相比,注射SRH的SHR大鼠血浆中的TG、TC、LHL的水平有明显降低(P<0.05).本实验发现:SRH能够明显改善SHR血液的高凝状态,高脂给药组FG明显低于高脂生理盐水组,PT、TT能得到明显延长(P<0.05);而高脂给药组与WKY给药组相比各项指标均无明显差异.本实验的一个重要发现:PIG、PAI和D-dimer未见明显变化,说明SRH对纤溶系统的功能不会造成影响,提示SRH溶栓后不会引起持续的系统纤溶亢进状态.
当血管堵塞时,心肌细胞容易缺血缺氧或坏死,多种心肌酶可进入血液循环,引起血清心肌酶学升高[5].鉴于各种心肌酶在机体组织中分布的非特异性,本实验采用多项酶的联合检测来提高检测的敏感性和特异性.结果发现:SRH处理的SHR大鼠组的AST、CK-MB、LDH水平明显低于生理盐水处理的SHR大鼠(P<0.05);说明SRH能够降低高脂饲料喂养的SHR心肌酶学水平,减少循环系统的损伤程度.
心肌自主节律功能通过血压、心率的变化来体现[6].本次实验结果证实SRH能够降低SHR血压水平,降低SHR大鼠的心率(P<0.05).这可能由于SRH减少SHR体内炎症反应,降低血液粘稠度和血管病变程度,从而降低了血压,减少心脏负担,使心律接近正常水平.
对正常喂养的WKY大鼠注射SRH,其血脂水平和生理盐水组相比无显著变化,可见使用SRH对正常大鼠脂肪代谢无显著影响.正常大鼠注射SRH后FG、PT、APTT、TT无显著差异,表明SRH对正常大鼠的内外源性凝血功能未造成显著影响,因而是相对安全的.血浆中PIG、PAI和D-dimer是反映纤溶状态的良好指标,系统纤溶亢进时显著增加[7-8].本研究各组动物使用SRH这种溶栓剂溶栓后PIG、PAI均未出现下降,且D-dimer均无显著变化,提示SRH未引起持续的系统纤溶亢进状态.正常大鼠在使用SRH后其血压和心率也未受影响,说明SRH未改变心血管功能.
本研究证实在动物实验期间SRH是相对安全的,它能够改善高血压大鼠的血液高凝状态和高血压状态,降低血脂水平,并且高血压状态下心率过快得以缓解,以上的实验结果为进一步临床的研究提供了一定的依据.
[1]王旻,王圆圆,邹民吉,等.新型抵抗原性葡激酶的构建、表达及功能性分析[J].军事医学科学院院刊,2007,31(2):118-121.
[2]王园园,龙民慧,王金凤,等.长期应用葡激酶衍生体对大鼠凝血、纤溶系统影响的研究[J].中国实验血液学杂志,2009,17(3):670-673.
[3]王园园,龙民慧,朱贺,等.葡激酶突变体对高脂喂养大鼠血液常规指标的影响[J].中国比较医学杂志,2009,19(3):57-59.
[4]LUSISA J,ATTIE A D,REUE K.Metabolic syndrome:from epidemiology to systems biology[J].Nat Rev Genet,2008,9(11):819-830.
[5]KOTHE K,GOLA G,PARSIR A,et al.Isoenzyme diagnosis in the clinical course of acute myocarial infarct[J].ZGesamte Inn Med,1980,35(4):170-173.
[6]PHILIPS JC,MARCHAND M,SCHEEN A J.Changes in pulse pressure,heart rate and the pulse pressure x heart rate product during squatting in Type 1 diabetes according to age[J].Diabetic Med,2010,27(7):753-761.
[7]MOREADITH RW,COLLEN D.Clinical development of PEGylated recombinant staphylokinase(PEG-Sak)for bolus thrombolytic treatmentof patientswith acutemyocardial infarction[J].Adv Drug Deliver Rev,2003,55:1337-1345.
[8]TBOGERSEN A M,JANSSON J H,BOMAN K.High plas minogen activator inhibitor and tissue plasminogen activator levels in plasma precedea first acute infarction in both men and evidence for them yocardial fibrinolyticsystem as an independent women:primary risk factor[J].Circulation,1998,98(21):2241-2247.
