针铁矿非均相Fenton法降解抗生素的研究
2013-08-16蒋芬芬吴宏海成思敏刘一帆管玉峰何广平
蒋芬芬,吴宏海,成思敏,刘一帆,管玉峰,何广平
(华南师范大学化学与环境学院,广东广州510006)
四环素类抗生素是应用最为广泛的抗生素之一,据统计仅欧洲每年抗生素的消耗量就达5 000 t[1].四环素类抗生素是一类广谱抗生素,包括盐酸四环素、土霉素、金霉素、多西霉素和美他环素等,其分子结构都含有并四苯基本骨架.近年来,盐酸四环素在土壤中的存在和转化受到广泛关注.残留的四环素会导致一些耐药性微生物种群的产生或者引发一些生物反应[2].其中盐酸四环素(TC)是一种极性很强的分子,有3个活性基团,分别是三羰基甲烷(pka1=3.30)、酚二酮基(pka2=7.68)和二甲胺基(pka3=9.68)系统.而且,这些基团能够质子化或去质子化形成不同化学形态.
四环素类抗生素在土壤中的吸附-解吸行为已成为国际上的研究热点,据报道,四环素在粘土矿物[3]、氧化物[4]、腐殖酸物质[5]、土壤以及沉积物上均有较好的吸附性.粘土矿物等对TC的主要吸附机理是因为TC+00的阳离子交换和两性离子TC+-0的表面络合作用.目前研究主要集中在此类单一抗生素在土壤或矿物上的吸附和解吸行为上,并发现阳离子类型、pH、有机质等因素均对上述吸附、解吸有影响.抗生素是离子型小分子有机化合物类的代表,但常用的疏水性吸附剂如活性炭等无法将其很好地吸附去除和脱附回收[6].目前国内外有关抗生素的研究大都集中在粘土矿物及铁铝氧化物表面的吸附方面,对TC降解方面的研究报道很少[7-8].以铁氧化物矿物作为催化剂的类Fenton反应体系,具有异相催化反应特征、便于回收利用等优越性能.其中,针铁矿广泛分布于土壤、水体沉积物和矿山废水等环境介质中,是一种环境友好的地质材料.本文拟对针铁矿催化非均相Fenton氧化分解TC开展研究,考察pH、H2O2初始浓度、针铁矿投加量和反应温度等工艺因素对TC降解效果的影响,以期获得降解动力学的优化参数,可为抗生素的环境污染治理提供重要依据.
1 材料和方法
1.1 试剂
盐酸四环素(C22H24O8N2·HCl,上海阿拉丁试剂厂,USP级);KOH(天津市大茂化学试剂厂);Fe(NO3)3·9H2O(天津市大茂化学试剂厂);30%H2O2(天津市大茂化学试剂厂);实验用水均为二次水;其它试剂均为AR级国产试剂.
1.2 实验方法
1.2.1 针铁矿的合成 将 100 mL 1 mol/L的Fe(NO3)3溶液和180 mL 5 mol/L KOH溶液迅速混合并搅拌,置于2 L的聚乙烯容器中,用二次水稀释至2 L,于70℃下恒温60 h.在此过程中,红棕色絮状氢氧化铁沉淀逐渐转变成棕黄色小颗粒.将溶液用水洗涤至电导率小于50μS/cm,利用真空冷冻干燥机在-48℃下真空干燥针铁矿(α-FeOOH)样品[9].
1.2.2 催化氧化实验 在500 mL的玻璃反应器中加入一定量针铁矿催化剂,然后加入适当的盐酸四环素溶液.采用85-1A磁力恒温搅拌器(江苏金坛市正基仪器有限公司),温度恒定后,初始磁力搅拌1 h,使针铁矿对盐酸四环素的吸附达到平衡.接着在磁力搅拌条件下加入一定量的H2O2,降解开始并计时.反应一定时间间隔取样,过0.45μm滤膜,然后采用紫外可见光分光光度计(UV-3802型:尤尼克上海仪器有限公司)在四环素的最大吸收波长357 nm处测定其吸光度.
2 结果与讨论
2.1 针铁矿表征
针铁矿的XRD衍射图(图1)显示,它的主要2θ值在21.23°、33.28°和 36.67°,与标准比对卡吻合得很好[10].图2 表明针铁矿的 BET 表面积是33.66 m2/g,平均孔体积和孔径分别为 0.078 cm3/g、9.27 nm,针铁矿颗粒呈针状,长度为1~5μm,与文献报道相符合,表明合成产物是纯度很高的α-FeOOH(图3).

图1 合成针铁矿样品的X射线衍射(XRD)图谱(A)与纯针铁矿α-FeOOH(B)的标准图谱对比Figure 1 X-ray diffraction(XRD)analysis of as-synthesized goethite samples(A)in comparison with the reference diffractogram forα-FeOOH(B)
2.2 盐酸四环素的氧化分解
图4表示在盐酸四环素(TC)初始浓度40mg/L、H2O2浓度20.0 mmol/L、pH 4和反应温度35℃的条件下,以合成的针铁矿为催化剂,TC非均相Fenton氧化分解过程的紫外可见光谱演化图.扫描范围是200~800 nm,TC的主要吸收峰在357 nm和275 nm处.随着反应的进行,357 nm和275 nm处的吸收峰逐渐减小,当反应进行到240 min后,上述2个吸收峰几近消失.这表明TC分子被较好地氧化分解了.

图2 BET等温吸附/脱附曲线图(A)及针铁矿孔径分布图(B)Figure 2 Nitrogen adsorption-desorption isotherms of goethite(A)and its corresponding pore size distribution curve(B)

图3 针铁矿的SEM图像(×18 000)Figure 3 SEM images of goethite

图4 TC非均相Fenton氧化分解的UV-VIS光谱演化图Figure 4 UV-VIS spectral changes of TC during the Fenton process vs.reaction time
2.2.1 初始pH的影响 图5表示TC初始质量浓度为 40 mg/L、H2O2浓度为 20.0 mmol/L、针铁矿的投加量1.0 g/L和反应温度为35℃的条件下,pH从3.0到5.4时,氧化分解效果是逐渐减小的,在pH为5.4时 TC 氧化分解率最小.针铁矿在 pH 3.0 ~4.0时有一定的溶解或形成铁配合物,此时均相Fenton反应起到一定的作用[11].当 pH 从5.4到10.0的变化过程中,氧化分解效率是逐渐增大的.针铁矿在pH 7.0 ~10.0 时,容易吸附 H2O2[9],使其在针铁矿表面产生自由基,同时有利对TC的吸附,在pH等于8.0附近达最大,此外在碱性条件下氢氧自由基容易攻击带负电的TC,从而增强了对TC的氧化分解效果.

图5 初始pH对TC Fenton氧化分解作用的影响Figure 5 Effect of initial pH values on the heterogeneous Fenton oxidation of TC
2.2.2 H2O2浓度的影响 其他条件同 2.2.1,当H2O2浓度为10 mmol/L,240 min时TC的氧化分解率为 91.8%(图 6),当 H2O2浓度增至 20 mmol/L时,氧化分解率达97.2%.这是因为加入的 H2O2浓度越大,产生的羟基自由基越多,从而加快TC的氧化分解速率.然而继续增加H2O2浓度,反而会抑制TC的氧化分解反应.当H2O2浓度增加至30、40 mmol/L时,氧化分解效果反而降低,氧化分解率分别为86.2%、82.5%.当 H2O2浓度超过20 mmol/L时,H2O2本身会与TC发生竞争,其可能的反应过程如下[12]:

图6 H2 O2投加量对TC Fenton氧化分解作用的影响Figure 6 Effect of H2 O2 dosage on the heterogeneous Fenton oxidation of TC

虽然反应中产生了·O2H,但它的氧化能力弱于·OH,并且它能与·OH反应减少了·OH的数量,使TC的氧化分解率减少[13].在本实验中最佳的H2O2浓度为20 mmol/L.
2.2.3 针铁矿投加量的影响 其他条件同2.2.1,随着针铁矿投加量的增加,TC的分解速率也随之提高(图7),但当针铁矿的投加量超过1.0 g/L时,再增加针铁矿的用量对TC氧化分解率反而不利,出现下降.因为一方面,增加针铁矿的用量可为H2O2提供更多的活性位置,增加·OH的产量,从而提高氧化分解率[12];另一方面,如果针铁矿用量过多则会导致活性位置过量,·OH被捕捉[14].2种作用达到平衡时,氧化性能最佳.在该实验中,当针铁矿用量为1.0 g/L时,氧化性能发挥到最佳效能.

图7 针铁矿投加量对TC Fenton氧化分解作用的影响Figure 7 Effect of goethite dosage on the heterogeneous Fenton oxidation of TC
2.2.4 TC初始质量浓度的影响 其他条件同2.2.1,随着TC浓度的增大,TC的氧化分解率随之降低(图8).当TC质量浓度为10 mg/L时,反应进行到30 min时,氧化分解率达到92.3%;TC初始质量浓度为60 mg/L时,氧化分解率仅为35.7%.但当反应进行到240 min时,其氧化分解率均达到了95%左右.这是因为催化剂针铁矿的投加量和H2O2浓度都是一定的,仅能产生一定量的·OH,若TC的初始浓度增大,·OH的量却没有增加,则使TC的氧化分解率随之降低.随着反应时间的延长,·OH与目标物TC循环作用,最终可把TC全部氧化分解.2.2.5 反应温度的影响 其他条件同2.2.1,研究温度对TC氧化分解作用的影响.当反应进行到120 min时,温度分别为 25、30、35、40 ℃ 时,TC 的氧化分解率分别为 49.2%、58.1%、84.7%、92.1%(图9).由此可以看出,随着温度的升高TC的氧化分解率逐渐增大.这是因为,升高温度提高·OH的产生速率[15],同时升高温度也增加针铁矿对TC的吸附作用[16].另一方面,可能是升高温度加快吸附和解析过程中固/液两相间的传递作用,从而整体上加快TC的氧化分解速率.

图8 四环素初始浓度对TC Fenton氧化分解影响Figure 8 Effect of initial concentration of TC on its heterogeneous Fenton oxidation

图9 温度对TC异相Fenton氧化分解作用的影响Figure 9 Effectof temperature on the heterogeneous Fenton oxidation of TC
2.2.6 叔丁醇的影响 其他条件同2.2.1,在4个相同的玻璃反应器中分别加入0、0、5、20 mmol/L的叔丁醇作为自由基捕获剂,第1个玻璃瓶中不加催化剂.不加入针铁矿作为催化剂时,单独的H2O2对TC几乎没有氧化分解作用(图10).加入叔丁醇后,针铁矿对TC的催化氧化分解率明显降低,且随着叔丁醇在体系中浓度的逐渐提高,其抑制程度逐渐增大.当反应进行到180 min时,加入叔丁醇浓度分别为 0、5、20 mmol/L时,氧化分解率分别为93.9%、82.8%、73.4%.这是因为,叔丁醇能迅速捕获·OH,从而中断H2O2引发的自由基链反应.可见,针铁矿催化H2O2对TC的氧化分解的过程中存在·OH的氧化作用,从而提高了TC的氧化分解率和矿化率.
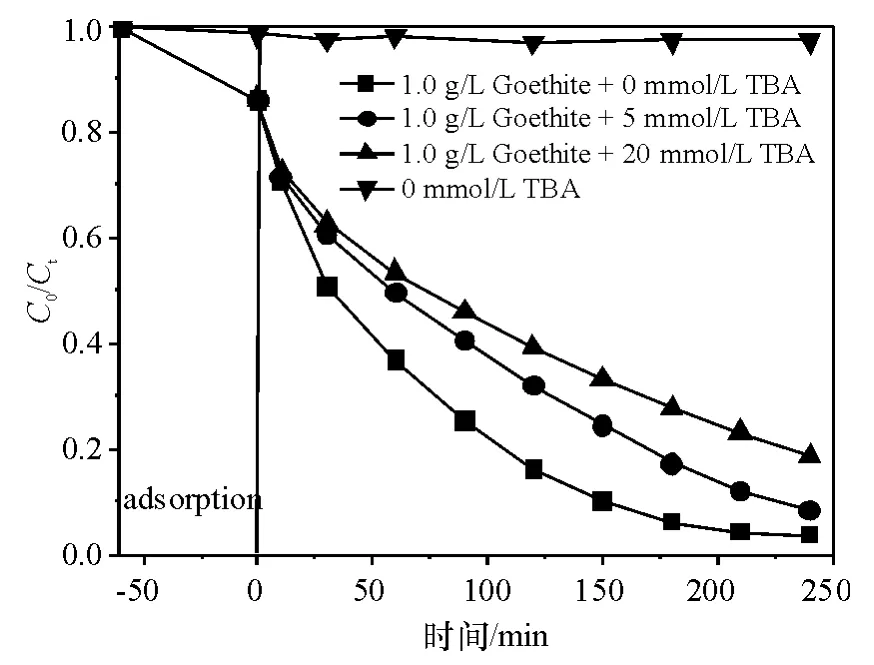
图10 叔丁醇对TC异相Fenton氧化分解作用的影响Figure 10 Effect of TBA on the heterogeneous Fenton oxidation of TC
2.3 TC的TOC氧化去除率
其他条件同2.2.1,研究反应过程中TOC的去除率(图11).当反应进行到360 min时,没有加催化剂针铁矿的空白和加入了1.0 g/L针铁矿催化剂的TOC的去除率达分别为2.52%、53.8%,表明针铁矿与H2O2形成的非均相Fenton试剂能很好地氧化分解TC.TC在针铁矿催化氧化过程中矿化程度较高,能有效地去除溶液中的TC.未加催化剂的空白对比实验证明单纯的H2O2无法氧化分解TC.

图11 针铁矿氧化分解TC的TOC去除率Figure 11 TOC removal ratio on the heterogeneous Fenton oxidation of TC
2.4 TC氧化分解的动力学模型

图12是ln(C0/C)与反应时间t的线性关系图.其条件为:C0=60 mg/L,TC 20 mmol/L,H2O21.0 g/L α-FeOOH 和400mL,pH 4.0,T=35 ℃,该方程拟合的相关性系数R2>0.998,表明针铁矿氧化分解TC的反应是符合准一级动力学模型:其中,kapp是反应速率常数,t为反应时间,上述条件下针铁矿催化H2O2氧化分解TC的反应速率常数是0.012 8min-1.其他相似条件下的动力学拟合结果于表1列出.另外,根据阿伦尼乌斯公式可计算出针铁矿氧化分解TC的表观活化能是31.86 kJ/mol.一般来说,普通热力学反应的表观活化能是在60~250 kJ/mol之间[17],可见,该氧化分解反应表观活化能是相对比较低的,说明该反应比较容易进行,温度升高也有助于提高反应速率.

图12 TC氧化分解的伪一级动力学曲线Figure 12 The peseudo-first-order linear relationship for reaction kinetic curve

表1 不同条件下针铁矿氧化分解TC的动力学拟合结果Table 1 Pseudo-first-order kinetic rate constants for TC Fenton oxidation at varied reaction conditions
2.5 催化剂的重复利用率与稳定性
一般的均相Fenton反应都存在催化剂难与介质分离,易流失和二次污染的问题.针铁矿催化TC氧化分解是非均相Fenton反应,催化剂易于分离,可以重复利用.经过简单的过滤,干燥,对催化剂进行2次、3次重复利用,当反应进行到240 min时,其Fenton 氧化分解率分别为96.5%、95.1%、93.8%(图13).可见,催化剂的催化效果几乎没有受到影响,说明催化剂有良好的稳定性,重复利用性能很好.

图13 针铁矿催化剂重复使用时的效果Figure 13 The recycling property of goethite
3 结论
合成的针铁矿作为非均相Fenton反应催化剂,具有很好的催化氧化性能.在 TC初始浓度为40 mg/L,H2O2浓度为20.0 mmol/L,pH 为 4 和反应温度为35℃的条件下,反应240 min时,针铁矿对TC氧化分解率为97.2%.该反应较好地符合准一级动力学模型,其相关性系数R2>0.998.其中,反应是随着温度的升高氧化分解率也逐渐增大.pH对该反应也有明显的影响,当 pH从3.0~5.4变化时,氧化分解率逐渐减小;而pH从5.4~10.0变化时,氧化分解率是逐渐增大的.H2O2浓度、催化剂投加量的最佳条件分别是20 mmol/L、1.0 g/L.叔丁醇作为自由基捕获剂对针铁矿氧化分解TC的反应具有明显的抑制作用,表明该反应是自由基链反应,反应的表观活化能为31.86 kJ/mol.
[1]HIRSCH R,TERNES T,HABERER K,et al.Occurrence of antibiotics in the aquatic environment[J].Sci Total Environ,1999,225(1):109-118.
[2]CHENW R,HUANG C H.Adsorption and transformation of tetracycline antibiotics with aluminum oxide[J].Chemosphere,2010,79(8):779-785.
[3]WANG Y J,JIA D A,SUN R J,et al.Adsorption and cosorption of tetracycline and copper(II)on montmorillonite as affected by solution pH[J].Environ Sci Technol,2008,42(9):3254-3259.
[4]FIGUEROA R A,MACKAY A A.Sorption of oxytetracycline to iron oxides and iron oxide-rich soils[J].Environ Sci Technol,2005,39(17):6664-6671.
[5]GU X Y,EVANS L J.Surface complexation modelling of Cd(II),Cu(II),Ni(II),Pb(II)and Zn(II)adsorption onto kaolinite[J].Geochim Cosmochim AC,2008,72(2):267-276.
[6]GU C,KARTHIKEYAN K G,SIBLEY SD,et al.Complexation of the antibiotic tetracycline with humic acid[J].Chemosphere,2007,66(8):1494-1501.
[7]KENNEDY F,PEDERSEN JA.Kinetics of oxytetracycline reaction with a hydrousmanganese oxide[J].Environ Sci Technol,2006,40(23):7216-7221.
[8]ZHANG H,HUANG C H.Adsorption and oxidation of fluoroquinolone antibacterial agents and structurally related amines with goethite[J].Chemosphere,2007,66(8):1502-1512.
[9]WU H H,DOU X X,DENG D Y,etal.Decolourization of the azo dye Orange G in aqueous solution via a heterogeneous Fenton-like reaction catalysed by goethite[J].Environ Technol,2012,33(14):1545-1552.
[10]MENG F,MORIN SA,JIN S.Rational solution growth ofα-FeOOH nano wires driven by screw dislocations and their conversion to α-Fe2O3nanowires[J].J Am Chem Soc,2011,133(22):8408-8811.
[11]LIANG X,ZHOU Y,ZHU S,et al.The decolorization of Acid Orange II in non-homogeneous Fenton reaction catalyzed by natural vanadium-titanium magnetite[J].JHazard Mater,2010,181(1):112-120.
[12]KITAJIMA N,FUKUZUMIS,ONO Y.Formation of superoxide ion during the decomposition of hydrogen peroxide on supported metal oxides[J].J Phys Chem,1978,82(13):1505-1509.
[13]PIGNATELLO J J,OLIVEROS E,MACKAY A.Advanced oxidation processes for organic contaminant destruction based on the Fenton reaction and related chemistry[J].Crit Rev Env Sci Tec,2006,36(1):1-84.
[14]ORTIZ de la Plata G B,ALFANO OM,CASSANO A E.Decomposition of 2-chlorophenol employing goethite as Fenton catalyst:I:Proposal of a feasible,combined reaction scheme of heterogeneous and homogeneous reactions[J].Appl Catal B:Environ,2010,95(1):1-13.
[15]SUN JH,SUN SP,FANM H,et al.Oxidative decomposition of p-nitroaniline in water by solar photo-Fenton advanced oxidation process[J].J Hazard Mater,2008,153(1):187-193.
[16]SUN SP,LIC J,SUN JH,et al.Decolorization of an azo dye Orange G in aqueous solution by Fenton oxidation process:Effect of system parameters and kinetic study[J].JHazard Mater,2009,161(2):1052-1057.
[17]KASIRIM B,ALEBOYEH H,ALEBYEH A.Mineralization of C.I.Acid Red 14 azo dye by UV/Fe-ZSM5/H2O2process[J].Environ Technol,2010,31(2):165-173.
