新辅助化疗对进展期胃癌患者的临床疗效分析
2013-08-14王洪云黄忠英赵艳萍张文婷曹继红
王洪云,黄忠英,赵艳萍,张文婷,曹继红
(九江市第三人民医院:1.肿瘤一科;2.药剂科;3.肿瘤科;4.肝病科,江西九江 332000)
根治性手术是治疗进展期胃癌的主要方法,但由于转移范围广,浸润程度深,大部分患者术后易复发,术后化疗对于延长生存时间的作用也非常有限[1]。新辅助化疗也称术前化疗,在治疗乳腺、膀胱、头颈等部位的恶性肿瘤中取得较好的效果,可快速改善患者症状,减少肿瘤的微转移灶,缩小肿瘤浸润范围,降低临床分期,提高根治性切除率。但胃癌新辅助化疗的方案仍存在一定的争议,本次研究选用了FOLFOX与XELOX方案,并以单纯手术作为对照,为探讨新辅助化疗对于手术的效果及不良反应做一回顾性对照研究。
1 资料与方法
1.1 一般资料 选取2006年12月至2012年5月本院肿瘤一科手术前采用新辅助化疗的81例进展期胃癌患者为研究对象,根据化疗方案不同分为XELOX组26例(奥沙利铂、卡培他滨)与FOLFOX组25例(奥沙利铂、氟尿嘧啶、甲酰四氢叶酸钙),将单纯手术治疗的进展期胃癌患者30例纳入对照组。所有患者均完成B超、CT、胃镜等辅助检查,胃镜确定肿瘤的性质、部位,B超、CT观察病灶浸润范围、邻近淋巴结或其他器官转移。入选患者均符合下列条件:(1)有可评价病灶,病理学确诊为进展期胃癌,且预计生存期超过3个月;(2)肿瘤浸润程度深,体积大,可有胃周、腹膜后淋巴结转移,预期切除困难;(3)心、肺、肝、肾、骨髓等器官均正常,KPS评分大于60;(4)患者接受治疗方案,签署知情同意书。3组患者的性别、年龄、肿瘤部位、肿瘤分化、病理类型、肿瘤分期差异均无统计学意义(P>0.05),具有可比性。见表1。
1.2 方法
1.2.1 治疗方法 FOLFOX组:奥沙利铂85mg/m2,第1天持续静脉滴注3h;亚叶酸钙(CF)0.2g/m2,第1、2天静脉滴注2h;氟尿嘧啶2.5g/m2化疗泵持续静滴48h,14d后重复,共2个疗程。XELOX组:奥沙利铂85mg/m2,第1天持续静脉滴入3h;卡培他滨(希罗达)每日2.5mg/m2,连用14d,休息1周,共2个疗程。化疗期间每周检测2次血常规,每个疗程开始前、结束后检查肝、肾功,治疗2个疗程后B超、CT检查病灶变化,测量肿瘤标志物。化疗结束后4周按RECEST标准[2],根据疗效决定是否行标准胃癌根治术(D2或D2+),具体为:完全缓解(CR)的患者立即实施手术;部分缓解(PR)但能够耐受手术的患者采取手术治疗,PR但仍不能耐受手术者则继续化疗;疾病稳定(SD)且能耐受手术患者立即手术治疗,SD但不能耐受手术或者疾病进展(PD)患者改其他治疗。FOLFOX组与XELOX组患者均在术后1个月再给予2~3周期的化疗。对照组:Ⅲ期患者行剖腹探查术,根据探查情况决定术式,术后FOLFOX化疗4个周期,肠梗阻行空肠造瘘术。
表1 3组患者一般资料的比较
1.2.2 评价标准 所有患者均采用WHO制定的实体瘤近期疗效、不良反应评价标准,总有效率(%)=CR%+PR%。不良反应依据WHO抗癌药物不良反应的分级标准,包括恶心呕吐、粒细胞减少、血小板减少、腹泻、外周神经毒性等。各毒性反应分0~Ⅳ级,以Ⅲ或Ⅳ级视为重度不良反应。术后并发症包括吻合口瘘、肠梗阻、肺部感染、切口感染、腹腔感染、胰瘘(依据引流液胰酶含量及B超诊断胰瘘)等。
1.3 统计学处理 本研究数据采用SPSS13.0软件进行统计学分析,计数资料以率表示,比较采用Fisherχ2检验,疗效的分析采用Fisher确切概率法,以P<0.05为差异有统计学意义。
2 结 果
2.1 XELOX组与FOLFOX组术前化疗疗效比较 XELOX组患者CR 3例,PR 15例,SD 6例,PD2例,总有效率为69.2%。FOLFOX组患者CR 3例,PR 14例,SD 5例,PD2例,总有效率为68.0%;两组患者术前化疗疗效比较差异无统计学意义(χ2=0.842,P>0.05)。见表2。
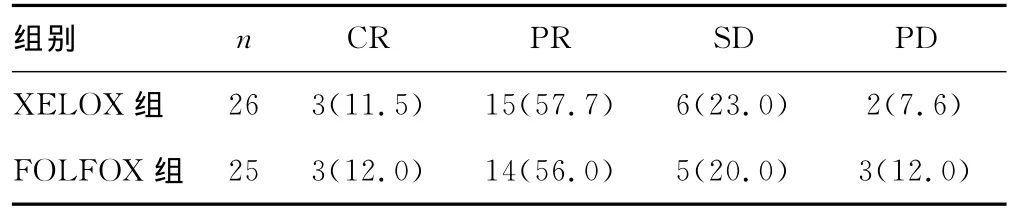
表2 XELOX组与FOLFOX组术前化疗疗效比较[n(%)]
2.2 XELOX组与FOLFOX组术前化疗不良反应的比较两组均以恶心呕吐最多见,其次为粒细胞减少。FOLFOX组恶心呕吐(χ2=7.842,P<0.05)、粒细胞(χ2=6.175,P<0.05)及血小板减少(χ2=5.292,P<0.05)和腹泻(χ2=3.915,P<0.05)等不良反应明显高于XELOX组。见表3。

表3 XELOX组与FOLFOX组术前化疗不良反应的比较(n)
2.3 XELOX组、FOLFOX组与对照组手术情况的比较XELOX组与FOLFOX组患者根治性切除率比较差异无统计学意义(χ2=0.627,P>0.05),均显著高于对照组(χ2=7.361,P<0.05;χ2=7.158,P<0.05)。见表4。

表4 3组手术情况的比较[n(%)]

表5 3组术后并发症的比较(n)
2.4 XELOX组、FOLFOX组与对照组术后并发症的比较术后并发症多为感染(切口感染、肺部感染或腹腔感染)及吻合口瘘,1例肠梗阻,未见胰瘘。XELOX组、FOLFOX组与对照组术后并发症发生率比较差异无统计学意义(χ2=0.195,P>0.05;χ2=0.195,P>0.05)。见表5。
3 讨 论
新辅助化疗近年来受到国内外学者的密切关注,在2010年的《NCCN胃癌临床实践指南》中,建议对T2及更高分期的胃癌实施新辅助化疗,以提高进展期胃癌的根治性手术切除率,延长术后生存时间。本次研究发现,术前实施新辅助化疗,XELOX组总有效率为69.2%,FOLFOX组总有效率为68.0%,提示两种化疗方案总有效率均较高,一方面可在术前降低大部分患者的肿瘤分期,缩小肿瘤与邻近组织、脏器侵犯范围,降低肿瘤与组织反应性水肿;另一方面,也可降低手术前微转移灶的肿瘤负荷,提高术后化疗敏感度,降低术后复发率[3]。XELOX组 与FOLFOX组患者在新辅助化疗后根治性手术切除(R0切除)均显著高于对照组,说明新辅助化疗可提高进展期胃癌患者的临床缓解率、根治性切除率,与其他报道相符[3-4]。另外,对于XELOX或FOLFOX方案治疗不敏感的患者,也可及时调整治疗方案,避免术后无效化疗。
本次研究中使用的奥沙利铂属于第3代铂类抗肿瘤药物,铂原子以DNA作为靶点,与之交叉联结,从而阻断肿瘤细胞DNA复制和转录过程,其不良反应包括消化道、骨髓抑制等较顺铂、卡铂轻,而且无肾毒性、耳毒性,无需水化,临床治疗中的主要不良反应为随累积剂量增加的外周感觉异常[5-6]。卡培他滨是氟尿嘧啶类药物,国际多中心临床试验证实[7],卡培他滨对结肠癌的疗效肯定,但毒性低,欧洲国家已将其作为晚期结直肠癌的一线化疗药物,可取代氟尿嘧啶/亚叶酸钙治疗晚期结直肠癌以及部分乳腺癌,并扩展到胃癌、胆管癌、胰腺癌等恶性消化系统肿瘤。XELOX组与FOLFOX组不良反应的发生率均较低,尤其是XELOX方案安全性更高。
欧洲癌症研究组织在一项随机对照试验中发现,实施新辅助化疗的患者根治性手术切除率明显高于单纯手术组,而且术后病理提示淋巴结转移更少,但该研究同时指出新辅助化疗术后并发症发生率提高,且并不延长生存率[8]。但也有研究认为新辅助化疗并不会增加术后并发症的发生率,而且可以提高病理完全缓解率,延长中位生存期[9-12]。本次研究中3组患者的术后并发症差异无统计学意义,主要以感染、吻合口瘘为主,作者认为感染与患者术前合并呼吸系统疾病等因素有关,而吻合口瘘与手术切除范围和手术者操作有关[13]。本次研究结果说明进展期胃癌患者接受新辅助化疗后再手术治疗较单纯手术的根治性切除率更高,并且新辅助化疗并不会增加术后并发症的发生率。
[1]Mezhir JJ,Tang LH,Coit DG,et al.Neoadjuvant therapy of locally advanced gastric Cancer[J].J Surg Oncol,2010,101(4):305-314.
[2]Therasse P,Arbuck SG,Eisenhauer EA,et al.New guidelines to evaluate the response to treatment in solid tumors.European Organization for Research and Treatment of Cancer,National Cancer Institute of the United States,National Cancer Institute of Canada[J].J Natl Cancer Inst,2000,92(3):205-216.
[3]汪劭婷,朱朝晖,李小毅.胃癌新辅助化疗疗效临床评价方法及进展[J].中国普外基础与临床杂志,2010,17(2):200-204.
[4]D′ugo D,Persiani R,Zoccali M,et al.Surgical issues after neo-adjuvant treatment for gastric Cancer[J].Eur Rev Med Pharmacol Sci,2010,14(4):315-319.
[5]Zaniboni A,Meriggi F.The emerging role of oxaliplatin in the treatment of gastric Cancer[J].J Chemother,2005,17(6):656-662.
[6]Boda-Heggemann J,Hofheinz RD,Weiss C,et al.Combined adjuvant radiochemotherapy with IMRT/XELOX improves outcome with low renal toxicity in gastric Cancer[J].Int J Radiat Oncol Biol Phys,2009,75(4):1187-1195.
[7]Cassidy J,Clarke S,Díaz-Rubio E,et al.Randomized phase III study of capecitabine plus oxaliplatin compared with fluorouracil/folinic acid plus oxaliplatin as first-line therapy for metastatic colorectal Cancer[J].J Clin Oncol,2008,26(12):2006-2012.
[8]Cunningham D,Allum WH,Stenning SP,et al.Perioperative chemotherapy versus surgery alone for resectable gastroesophageal Cancer[J].N Engl J Med,2006,355(1):11-20.
[9]Fujitani K,Ajani JA,Barry W,et al.Impact of induction chemotherapy and preoperative chemoradiotherapy on operative morbidity and mortality in patients with locoregional adenocarcinoma of the stomach or gastroesophageal junction[J].Ann Surg Oncol,2007,14(7):2010-2017.
[10]Valenti V,Hernandez-Lizoaín JL,Beorlegui MC,et al.Morbidity,mortality,and pathological response in patients with gastric Cancer preoperatively treated with chemotherapy or chemo-radiotherapy[J].J Surg Oncol,2011,104(2):124-129.
[11]Rivera F,Galán M,Tabernero J,et al.PhaseⅡtrial of preoperative irinotecancisplatin followed by concurrent irinotecancisplatin and radio-therapy for respectable locally advanced gastric and esophagogastric junction adenocarcinoma[J].Int J Radiat Oncol Biol Phys,2009,75(5):1430.
[12]Stahl M,Walz MK,Stuschke M,et al.Phase III comparison of preoperative chemotherapy compared with chemoradiotherapy in patients with locally advanced adenocarcinoma of the esophagogastric junction[J].J Clin Oncol,2009,27(6):851-856.
[13]李柱,李亮,吕国庆,等.局部进展期胃癌的新辅助化疗及联合脏器切除术疗效分析[J].重庆医学,2012,41(21):2160-2161,2163.
