早期机械通气及全氟化碳气化吸入对重症胰腺炎患者炎性因子水平影响*
2013-08-14谢红,李园
谢 红,李 园
(1.四川省德阳市人民医院重症医学科 618000;2.四川大学华西医院普外科,成都 610041)
急性重症胰腺炎(severe acute pancreatitis,SAP)是常见的急腹症,患者多因腹部剧烈疼痛而前来就诊,SAP患者病情紧急、发病迅速、患者临床表现复杂,因此容易出现多脏器功能衰竭,随着病情的发展,机体防御系统会被启动,相关的促炎性因子会随之释放,破坏免疫系统平衡,破坏机体正常状态,加重患者炎性反应[1]。全氟化碳(PFC)属于呼吸性运载物质,通过气化或雾化的方式吸入能有效治疗呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)[2]。近年研究表明[3],PFC具有特异性抗炎的效果,为此本文将对2012年1~12月收治的SAP合并ARDS患者给予早期机械通气同时配合PFC气化吸入,与单纯性早期通气患者相比,治疗效果满意,现报道如下。
1 资料与方法
1.1 一般资料 选取2012年1~12月在四川省德阳市人民医院重症医学科就诊的68例伴有ARDS症状的SAP患者为研究对象,其中男42例,女26例,年龄18~62岁,平均(42.8±11.7)岁。68例患者根据随机数字表将其分为观察组和对照组各34例,两组患者在性别、年龄等方面差异均无统计学意义(P>0.05),具有可比性。
1.2 方法
1.2.1 纳入及排除标准 所有患者均符合2004年中华医学会胰腺学组对SAP的诊断标准以及对ARDS的诊断标准:(1)急性起病;(2)患者呼吸窘迫、呼吸频繁;(3)低血氧症,吸入纯氧后症状不能纠正;(4)经胸部X线片提示为双肺浸润性阴影;(5)氧合指标(PaO2/FiO2)≤18mm Hg;(6)所有患者均签署知情同意书。排除标准:(1)短期内应用免疫抑制剂患者;(2)肝、肾功能异常者;(3)晚期肿瘤患者;(4)对 PFC或早期通气不耐受患者;(5)妊娠期或哺乳期者。
1.2.2 治疗方法 两组患者在控制胰腺炎的基础上均建立人工气道对患者进行机械通气,通气模式为呼气末正压(PEEP)+间歇指令性通气(SIMV)。参考指数:潮气量设置为6~8mL/kg,吸气时间为0.8~1.2s,呼吸比为1.0∶1.5,压力控制通气(PCV)设置为15~25cm Hg,压力支持通气(PSV)气压为10~15cm Hg,呼吸频率(RR)为14~20次/分,PEEP为8~15cm Hg,氧流量6~15L/min,吸入氧浓度(FiO2)为35%。观察组患者在早期机械通气的基础上,加入PFC,以气化的方式吸入。两组患者持续通气时间为7~10d,通气结束后对患者进行拔管,让患者自主呼吸。
1.2.3 疗效评价及观察指标 疗效评价:患者临床症状参照《中国急性胰腺炎临床诊治指南》[3]对指标进行评定,分为治愈、显效、无效,有效=治愈+显效。观察指标:观察两组患者治疗前及通气结束后动脉二氧化碳分压(PaCO2)以及动脉血氧分压(PaO2)、血氧饱和度(SaO2)、PaO2/FiO2的变化。同时抽取患者静脉血液3mL,将盛有血液的试管置于离心机中2000r/min离心15min,取上清液,并采用全自动化免疫分析仪测定白细胞介素(IL)-1、6、8以及肿瘤坏死因子α(TNF-α)的水平。
1.3 统计学处理 采用SPSS17.0进行统计学分析,计量资料采用表示,组间比较采用t检验;计数资料采用率表示,组间采用χ2检验。检验水准α=0.05,以P<0.05为差异有统计学意义。
2 结 果
2.1 两组患者临床治疗效果分析 观察组总有效率为94.12%,对照组患者总有效率为76.47%,观察组患者疗效显著优于对照组,差异有统计学意义(P<0.05),见表1。

表1 两组患者有效率对比分析[n(%),n=34]
2.2 两组患者治疗前后血气指标分析 两组患者治疗后PaO2、SaO2以及PaO2/FiO2;显著高于治疗前,差异有统计学意义(P<0.05);观察组治疗后 PaO2、SaO2以及PaO2/FiO2高于对照组,差异有统计学意义(P<0.05);而两组的PaCO2组内及组间比较均无统计学意义(P>0.05),见表2。
表2 两组患者治疗前后血气指标分析(,n=34)
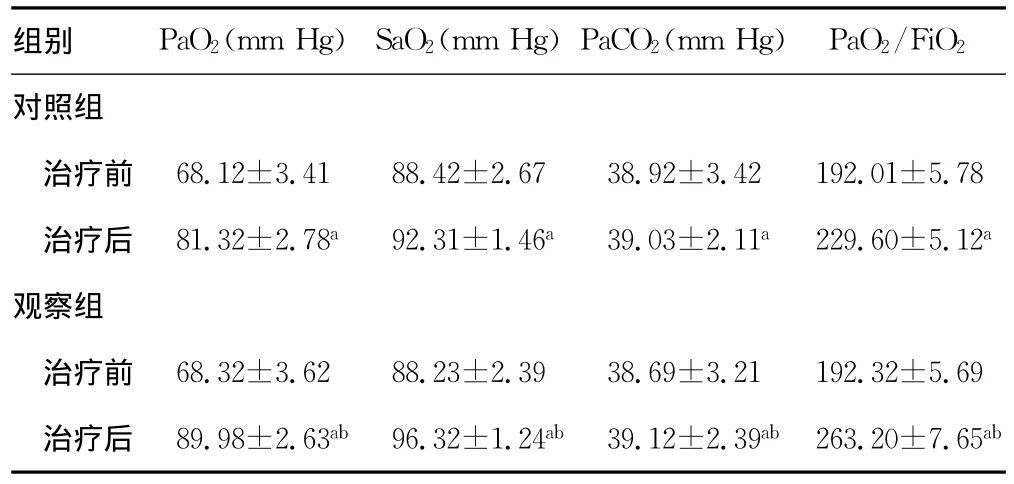
表2 两组患者治疗前后血气指标分析(,n=34)
a:P<0.05,与治疗前比较;b:P<0.05,与对照组比较。
组别 PaO2(mm Hg)SaO2(mm Hg)PaCO2(mm Hg) PaO2/FiO 2对照组治疗前 68.12±3.4188.42±2.6738.92±3.42192.01±5.78治疗后 81.32±2.78a92.31±1.46a39.03±2.11a229.60±5.12a观察组治疗前 68.32±3.6288.23±2.3938.69±3.21192.32±5.69治疗后 89.98±2.63ab 96.32±1.24ab 39.12±2.39ab 263.20±7.65ab
表3 两组患者治疗前后炎性因子水平变化(ng/L,,n=34)
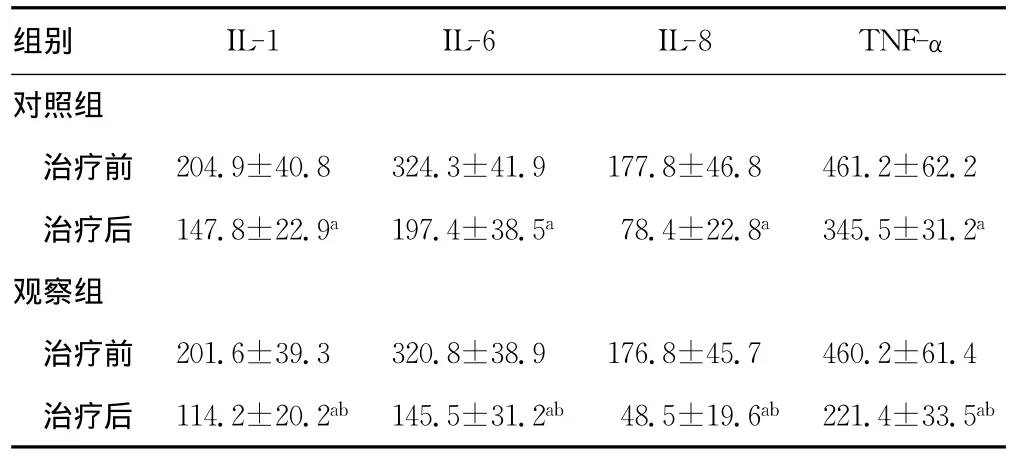
表3 两组患者治疗前后炎性因子水平变化(ng/L,,n=34)
a:P<0.05,与治疗前比较;b:P<0.05,与对照组比较。
组别 IL-1 IL-6 IL-8 TNF-α对照组治疗前 204.9±40.8324.3±41.9177.8±46.8461.2±62.2治疗后 147.8±22.9a197.4±38.5a78.4±22.8a345.5±31.2a观察组治疗前 201.6±39.3320.8±38.9176.8±45.7460.2±61.4治疗后 114.2±20.2ab 145.5±31.2ab 48.5±19.6ab 221.4±33.5ab
2.3 两组患者治疗前后炎性因子水平变化 观察组患者治疗后IL-1、6、8以及TNF-α水平显著低于对照组,差异有统计学意义(P<0.05),见表3。
3 讨 论
SAP病机较为复杂,主要表现为炎性介质在急性胰腺炎中参与炎性反应[4]。在胰腺炎患者中最早升高的炎性因子是TNF-α[5],随着病情的发展,机体防御系统会被启动,IL-1、6、8等促炎性因子随之释放,加重患者炎性反应[6]。持续的炎性反应能损伤器官,肺部是最早被累及的器官,从而引发ARDS[7]。ARDS的本质是重症胰腺炎引起的全身炎性反应,是非心源性肺部疾病中出现的多种细胞炎性因子作用于肺部组织,损伤肺泡上皮细胞及毛细血管内皮细胞导致肺部活性物质合成减少,从而导致肺部出血、肺部扩张,进而导致患者通气/血流(V/Q)比例失调的顽固性低血症[8-9]。
目前ARDS的治疗主要是对患者进行早期机械通气,其目的是为了改善患者PaO2/FiO2,增加患者通气量,从而减轻重要器官受损程度[10]。但对于SAP合并ARDS的患者除了改善ARDS的症状外,还应控制患者炎性水平,减少炎性进一步发展对机体造成的影响。PFC是一种在常温下为无色、无毒、无味的透明液体,可作为呼吸气体的运载载体,对氧的溶解度为血液的2~3倍,在临床上可作为血液的替代品,药物传送载体以及支气管肺泡灌洗[11]。Obraztsov等[12]认为PFC能弥散到细胞膜脂质双层结构中,从而对细胞膜起到稳定及保护,减少炎性因子对细胞的损害,从而起到抗炎作用。Nader等[13]研究认为血中PFC除了极少量会从网状内皮系统中排出外,大部分会以气体的形式排出肺部,从而增加与肺部组织接触的面积,有利于保护肺部免受伤害。Greenspan等[14]曾对呼吸困难综合征(RDS)早产儿应用PFC吸入治疗,治疗前患儿PO2、PCO2均得到有效改善。Leach等[15]曾对13例RDS早产儿采用常规治疗无效后应用PFC 24~76h后,患儿顺应性增加61%。
本研究中,观察组总有效率高于对照组,治疗后观察组IL-1、6、8以及TNF-a水平显著低于对照组,PaO2、SaO2以及PaO2/FiO2高于对照组,说明PFC可起到抗炎、改善肺部功能的作用。
综上所述,早期机械通气联合PFC气化吸入能有效控制患者炎症的发生,提高患者治愈率,有利于患者预后。
[1]毛恩强,汤耀卿,李磊,等.重症胰腺炎急性反应期控制性液体复苏策略[J].中华外科杂志,2007,45(19):1331-1334.
[2]中华医学会消化病分会胰腺病学组.中国急性胰腺炎诊治指南(草案)[J].中国消化内镜,2007,43(10):30-33.
[3]陈玺,魏春林.急性重症胰腺炎并呼吸窘迫综合征的临床特点与治疗[J].中国实用医药,2010,5(27):118-119.
[4]刘志鹏,邹利权,游斌.血清 TNF-α、sTNF-1R及IL-10在急性胰腺炎中的变化及意义[J].重庆医学,2011,40(5):433-434,437.
[5]王兆,杨蕾,陈微微.早期持续静-静脉血流滤过在重症胰腺炎并急性呼吸窘迫综合征治疗中的应用[J].山东医药,2013,53(3):52-54.
[6]张克君,宋彩霞,焦学龙,等.NF-κB和PUMA与重症胰腺炎致急性肺损伤的关系以及PDTC的干预作用[J].中华急诊医学杂志,2010,19(9):921-926.
[7]Kawamae K,Pristine G,Chiumello D,et al.Partial liquid ventilation decreases serum tumor necrosis factor-alpha concentrations in a rat acid aspiration lung injury model[J].Crit Care Med,2000,28(2):479-483.
[8]Rotta AT,Gunnarsson B,Hernan LJ,et al.Partial liquid ventilation with perflubron attenuates in vivo oxidative damage to proteins and lipids[J].Crit Care Med,2000,28(1):202-208.
[9]Curtis S.Perfluorocarbon-associated gas exchange:a hybrid approach to mechanical ventilation [J].Crit Care Med,1991,19(5):600-601.
[10]米洁,周发春,刘丹.序贯通气治疗重症急性胰腺炎所致急性呼吸窘迫综合征的临床研究[J].重庆医学,2011,40(22):2211-2212,2215.
[11]Nader ND,Knight PR,Davidson BA,et al.Systemic perfluorocarbons suppress the acute lung inflammation after gastric acid aspiration in rats[J].Anesth Analg,2000,90(2):356-361.
[12]Obraztsov VV,Neslund GG,Kornbrust ES,et al.In vitro cellular effects of perfluorochemicals correlate with their lipid solubility[J].Am J Physiol Lung Cell Mol Physiol,2000,278(5):1018-1024.
[13]Nader ND,Knight PR,Davidson BA,et al.Systemic perfluorocarbons suppress the acute lung inflammation after gastric acid aspiration in rats[J].Anesth Analg,2000,90(2):356-361.
[14]Greenspan JS,Wolfson MR,Rubenstein SD,et al.Liquid ventilation of human preterm neonates [J].J Pediatr,1990,117(1Pt 1):106-111.
[15]Leach CL,Greenspan JS,Rubenstein SD,et al.Partial liquid ventilation with perflubron in premature infants with severe respiratory distress syndrome[J].N Engl J Med,1996,335(11):761-767.
