大孔吸附树脂对莲房黄酮的吸附分离特性研究
2013-08-08陈红梅
陈红梅
(安庆师范学院生命科学学院,安徽安庆 246011)
莲(Nelumbium nuciferum)为睡莲科多年生水生草本植物,在我国有广泛的种植面积。莲房(lotus seed pod,LS)为其干燥成熟花托,具有化瘀止血袪湿功效,可用于尿血、产后瘀阻等治疗[1]。目前莲房除少数被民间作为食物香料使用外,大部分被丢弃,造成了资源浪费,也严重影响了环境。近年来研究报道,莲房中含有槲皮素、槲皮素-3-二葡萄糖苷、金丝桃苷等黄酮类化合物[2]。黄酮类化合物具有抗氧化、抗辐射、抗肿瘤、降血脂等作用[3-4],有广泛的应用领域。
大孔吸附树脂是一种人工合成的多孔性的有机高分子聚合物[5-6],因其具有良好的化学稳定性、吸附选择性强、解吸温和、再生容易、价格低廉等优点,而被广泛用于食品、医药等领域物质的分离纯化中[7-9]。目前未见有采用大孔树脂对莲房黄酮进行分离纯化的报道。本实验采用微波辅助提取法对莲房黄酮进行提取,并利用大孔树脂对莲房黄酮类化合物进行纯化,为充分开发利用莲房黄酮提供理论依据。
1 材料与方法
1.1 材料与仪器
莲房,购于农贸市场,烘干粉碎后过50目筛,备用。
大孔树脂:AB-8、NKA-9、S-8、X-5、H103购于南开大学化工厂;D101、HPD-826、HPD-722购于沧州宝恩吸附材料科技有限公司;芦丁标准品购自上海生化制品厂;亚硝酸钠、硝酸铝、氢氧化钠均为分析纯。
UV-2000型紫外-可见分光光度计,上海尤尼柯公司;FA2004A型电子天平,上海精天电子仪器有限公司;HH-6型数显恒温水浴锅,常州国华电器有限公司;RE-52A型旋转蒸发仪,上海亚荣生化仪器厂。
1.2 实验方法
1.2.1 莲房黄酮提取工艺及含量测定
准确称取莲房粉末5.0g放入磨口三角烧瓶中,按料液比1∶1的比例加入70%的乙醇溶液,在350W的微波功率下提取100s,减压蒸馏,浓缩液用石油醚脱色2次后再次过滤,滤渣用70%乙醇溶解并定容至50mL,按“1.3”进行操作,根据测定的吸光度计算黄酮含量。
1.2.2 标准曲线的制作
准确称取芦丁标准品20mg,用70%的乙醇溶解并定容至50mL。精密吸取上述溶液0、1.0、2.0、3.0、4.0、5.0mL于25mL容量瓶中,分别加入5%的亚硝酸钠溶液2mL,混匀后静置6min,再加入10%的硝酸铝溶液2mL,混匀后静置6min,再加入4%的氢氧化钠溶液2mL,最后用70%乙醇定容,在510nm处测定吸光度。以芦丁质量浓度(C:mg·mL-1)为横坐标,所测吸光度(A)为纵坐标,得到回归方程:A=0.2969C-0.2945,R2=0.9994。
1.2.3 树脂的预处理
将树脂置于95%乙醇溶液中浸泡20h以上,使其充分溶胀,湿法装柱,再用乙醇淋洗,观察洗出液加水后是否变澄清液体,澄清后改用蒸馏水淋洗,洗至无醇味,备用。
1.2.4 树脂吸附率和解吸率测定
取250mL的磨口三角瓶,准确称取5.0g预处理的湿树脂放入其中,再加入50mL莲房黄酮水溶液,盖上瓶塞,置于恒温水浴震荡器上,充分震荡24h,待溶液达到吸附平衡后,过滤,收集滤液,测定溶液中黄酮的浓度,按下式计算树脂的吸附率。
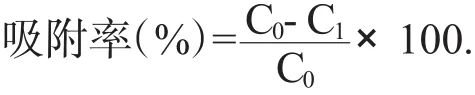
式中Q为吸附量(mg·g-1);C0为黄酮液初始质量浓度(mg·mL-1);C1为吸附平衡后溶液中的黄酮质量浓度(mg·mL-1)。
取250mL的磨口三角瓶,将上述吸附饱和的树脂,先用蒸馏水洗涤后,再加入95%的乙醇溶液50mL,置于恒温水浴震荡器上,充分震荡24h,过滤,测定滤液中黄酮浓度,按下式计算树脂的解吸率。
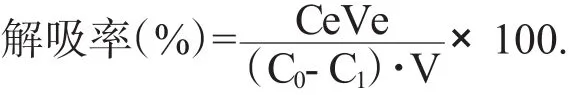
式中Ce为洗脱液黄酮浓度(mg·mL-1);Ve为洗脱液体积(mL);C0为黄酮液初始质量浓度(mg·mL-1);C1为吸附平衡后溶液中的黄酮质量浓度(mg·mL-1);V为吸附溶液体积(mL)。
1.2.5 静态吸附动力学特性测定
取250mL的磨口三角瓶,准确称取5.0g预处理的湿树脂放入其中,再加入50mL莲房黄酮水溶液,置于恒温水浴震荡器上震荡9h,每隔1h吸取一定体积的溶液,测定其中黄酮含量,绘制静态吸附动力学曲线。
1.2.6 动态吸附实验
1.2.6.1 样液浓度对吸附的影响
将预处理的树脂上柱,将10mL浓度分别为0.5、1、1.5、2mg·mL-1的黄酮溶液以2BV/h的流速加入,每5mL收集一管,测定吸附率。
1.2.6.2 流速对吸附的影响
将预处理的树脂上柱,将10mL 1.0mg·mL-1的黄酮溶液分别以1、2、3、4BV·h-1的流速加入,每5mL收集一管,测定吸附率。
1.2.6.3 pH对吸附的影响
将预处理的树脂上柱,分别调节1.0mg·mL-1黄酮溶液pH值至2.5、3.5、4.5、5.5,取10mL以2BV·h-1的流速加入,每5mL收集一管,测定吸附率。
1.2.7 动态洗脱实验
1.2.7.1 乙醇浓度对洗脱的影响
将预处理的树脂上柱,取10mL 1.0mg·mL-1的黄酮溶液加入,用蒸馏水洗涤至流出液近无色,分别用50%、60%、70%、80%、90%的乙醇溶液以2BV·h-1的流速进行洗脱。
1.2.7.2 洗脱速率对洗脱的影响
将预处理的树脂上柱,取10mL1.0mg·mL-1的黄酮溶液加入,用蒸馏水洗涤至流出液近无色,用75%的乙醇溶液分别以1、2、3、4BV·h-1的流速进行洗脱。
1.2.7.3 动态洗脱曲线
将处理好的树脂装柱后,取黄酮溶液5mL上柱,用蒸馏水洗涤至流出液近无色,再用75%的乙醇溶液以2BV/h的流速洗脱,第1BV收集一管,测定每管中黄酮的浓度,绘制动态洗脱曲线。
2 结果与讨论
2.1 不同大孔树脂的吸附和解吸附效果
在相同条件下对8种大孔树脂进行吸附和解吸附能力测定,结果如表1所示。其中AB-8、X-5、HPD-826、HPD-722具有较高的吸附率,都在80%以上,其中以AB-8的吸附率最大;AB-8、NKA-9、D101、X-5、HPD-722、H103具有较高的解吸率,其中以NKA-9的解吸率最高,达到92.7%,但其吸附率只有73.1%。在选取的8种树脂中,以AB-8、X-5、HPD-722这3种树脂同时表现出较好的吸附效果和解吸附效果。综合考虑,初选AB-8、X-5、HPD-722作吸附动力学特性测定。
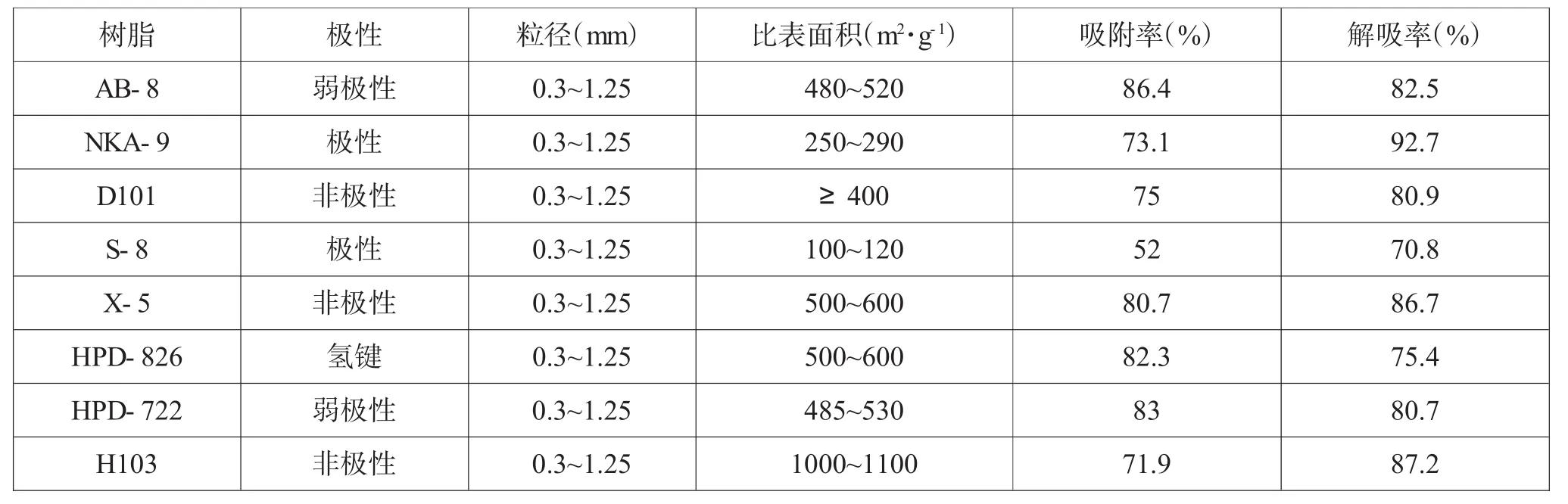
表1 大孔树脂吸附率与解吸率比较
2.2 静态吸附动力学特性测定
对AB-8、X-5、HPD-722树脂进行吸附动力学测定,结果如图1所示。从3种树脂的静态吸附动力学曲线可知,AB-8、X-5和HPD-722均为吸附快速平衡型,三者在4h左右基本达到吸附平衡,但AB-8的吸附率始终要高于X-5和HPD-722树脂,表现出更好的吸附动力学特性,因此选择AB-8树脂作进一步的研究。

图1 大孔树脂吸附动力学曲线

图2 黄酮浓度对吸附效果的影响
2.3 AB-8树脂动态吸附试验
2.3.1 样液浓度对AB-8树脂吸附效果的影响
不同样液浓度对AB-8树脂吸附效果的影响见图2。随着样液浓度的增加,树脂对黄酮的吸附率也随之升高。但当样液浓度达到1.5mg·mL-1时,继续增加样液浓度,吸附率呈缓慢增加趋势。考虑到样液浓度太大时有可能会使树脂堵塞,故选择样液浓度为1.5mg·mL-1。
2.3.2 流速对AB-8树脂吸附效果的影响
不同上样流速对AB-8树脂吸附效果的影响见图3。随着上样流速的增加,树脂的吸附率呈下降趋势。流速慢,样液能与树脂充分结合,树脂的吸附率增加。当流速为1BV·h-1时,树脂的吸附率为77.8%。流速的增加可以提高工作效率,当流速增加到3BV·h-1时,树脂的吸附率为73.5%;而当流速增加到43BV·h-1时,树脂的吸附率下降较多。综合考虑树脂吸附率和工作效率,选取上样流速为3BV·h-1较为合适。
2.3.3 样液pH值对AB-8树脂吸附效果的影响
pH的影响主要与溶质的酸碱性质相关,黄酮类化合物属弱酸性化合物,根据“相似相溶”的规则,宜选择在酸性溶液中进行吸附。样液pH值对AB-8树脂吸附效果的影响见图4。由图4可知,pH值为3.5时,树脂的吸附率最高。
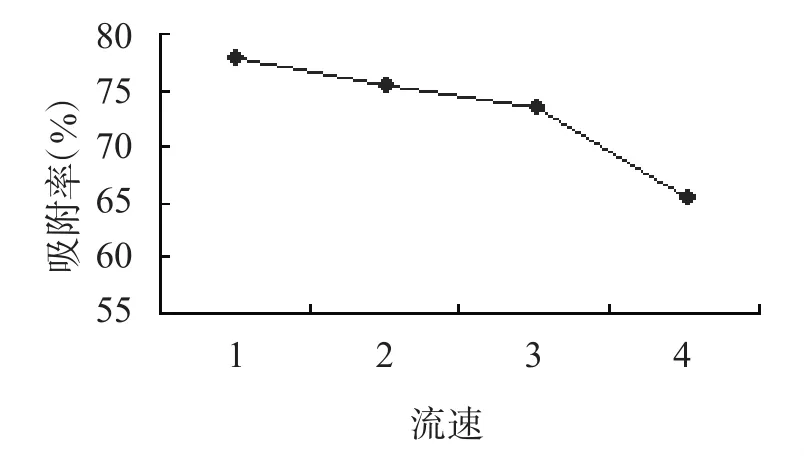
图3 流速对AB-8树脂吸附效果的影响

图4 pH对AB-8树脂吸附效果的影响
2.4 动态洗脱试验
2.4.1 乙醇浓度对洗脱效果的影响
乙醇浓度对洗脱效果的影响如图5所示,由图5可知,随着乙醇浓度的增加,洗脱率也呈增加趋势。这可能是因为乙醇浓度增加,减弱了黄酮类物质与树脂之间的吸附作用。当乙醇浓度为70%时,洗脱率达81.4%,而当乙醇浓度继续增加,洗脱率呈缓慢增加趋势。因此,考虑到试剂成本,选择70%的乙醇溶液作为洗脱液,也可以有较好的洗脱效果。
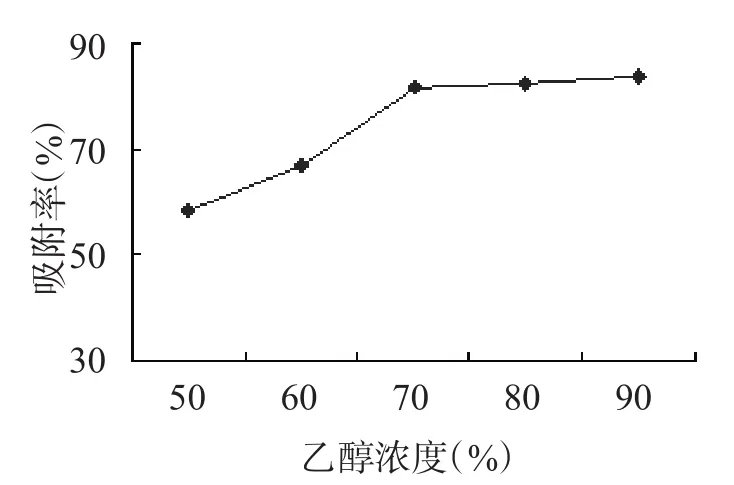
图5 乙醇浓度对洗脱效果的影响

图6 流速对洗脱效果的影响
2.4.2 流速对洗脱效果的影响
流速是影响洗脱效果的重要因素之一,流速慢,洗脱效果好,分辨率高,但洗脱时间长,耗时;流速快,洗脱效果变差,分辨率低,但节约工作时间。因此,选择合适的洗脱流速也至关重要。如图6所示,当流速为1BV·h-1时,洗脱率为86.2%;当流速为2BV·h-1时,洗脱率为79.4%;当流速进一步加快,此时洗脱率也呈快速下降趋势。考虑到洗脱效果和洗脱效率,选择流速为2BV·h-1比较合适。
2.4.3 洗脱曲线的测定
黄酮洗脱曲线如图7所示,以2BV·h-1的流速洗脱时,所得的洗脱曲线峰型较集中,几乎没有拖尾现象。当洗脱体积为3BV时,洗脱液中黄酮浓度达到最高值3.041mg·mL-1,当洗脱液用量在7BV时基本可以将黄酮洗脱完全。

图7 动态洗脱曲线
3 结论
在所选的AB-8、NKA-9、D101、S-8、X-5、HPD-826、HPD-722、H103树脂中,AB-8树脂在对莲房黄酮液的吸附效果和解吸效果方面均有较好的改良,操作简单,可以用于莲房黄酮的纯化。
AB-8树脂对莲房黄酮的最佳层析条件为:上样液浓度为1.5mg·mL-1,上样流速3BV·h-1,样液pH为3.5,乙醇浓度70%,洗脱流速2BV·h-1。
[1]国家药典委员会.中华人民共和国药典:一部[M].北京:中国医药科技出版社,2010:257.
[2]国家中医药管理局.中华本草:第八卷[M].上海:上海科学技术出版社,1999:405,333.
[3]曹纬国,刘志勤,邵云,等.黄酮类化合物药理作用的研究进展[J].西北植物学报,2003,23(12):2241-2247.
[4]Baglin IMitaine-0 er,NourAC,TanM,et al Areviewofnatural and modied betulinic,ursolic and echinocystic acid derivatives as potential antitumor and anti-HIVagents[J].Mine RevMed Chem,2003,3:525-539.
[5]娄嵩,刘永峰,白清清,等.大孔吸附树脂的吸附机理.化学进展,2010,8(24):1427-1436.
[6]李岂凡、白兰莉,胥勇,等.葛根总黄酮的分离纯化[J].南昌大学学报:理科版,2007,31(5):463-466.
[7]BoqiangFu,Jie Liu,Huan Li,et al.The application ofmacroporous resins in the separation oflicorice flavonoids and glycyrrhizic acid[J].Journal ofChromatographyA,2005,1089(1):18-24.
[8]GuangTJ,Xiu YL.Enrichment and purification ofmadecassoside and asiaticoside fromCentella asiatica extracts with macroporous resins[J].Journal ofChromatographyA,2008,1193(1-2):136-141.
[9]王晓林,钟方丽,李敦猛,等.广金钱草中总黄酮提取工艺研究[J].中药材,2008,31(6):900-902.
