茶树EGCG-O-甲基转移酶的纯化及酶学性质
2013-08-07吕海鹏费冬梅
吕海鹏,张 悦,费冬梅,林 智*
(中国农业科学院茶叶研究所,国家茶产业工程技术研究中心,浙江 杭州 310008)
近年来,茶叶中的甲基化儿茶素成分因其有显著的抗氧化、抗衰老、抗过敏等功效引起了科研工作者的关注;目前已在相关资源筛选[1-2]、基因克隆[3-4]以及生物活性评价[5-6]等方面取得了很大的研究进展。然而,甲基儿茶素的天然资源十分有限,只有极少数的茶树品种中的甲基儿茶素含量在1%以上[7-9],加之由化学合成途径获得甲基儿茶素相对困难。因此,为了开发利用这种天然功能成分,甲基儿茶素的酶学合成更具有重要的研究意义[10-11]。
在酶学合成方面,笔者所在的研究团队在前期的研究过程中,首先研究了重组大肠杆菌内EGCG-O-甲基转移酶(EOMT)的诱导表达条件[12];继而分析推断出EGCG-O-甲基转移酶催化EGCG后生成的不同类型的EGCG甲基化衍生物[13];并查明了甲基化衍生物酶促合成的反应条件[14];但在实验过程中发现,EGCG-O-甲基转移酶粗酶液的比活力很低,致使甲基化儿茶素的得率也比较低;因此,十分有必要对该酶进行分离纯化从而提高其催化活性。
本研究拟在上述研究基础之上,进一步开展EGCG-O-甲基转移酶的分离纯化研究,并查明其酶学特性,以期获得纯度较高、活性较强的EGCG-O-甲基转移酶。该结果将有助于研究甲基化EGCG的酶学合成技术从而实现后续较大规模的甲基化儿茶素的酶法制备,也有助于进一步研制开发甲基儿茶素相关的新型功能食品和天然药物等。
1 材料与方法
1.1 材料、试剂与仪器
基因重组茶树EGCG-O-甲基转移酶的大肠杆菌工程菌由本实验室构建和保存[12]。宿主菌(感受态细胞)E.coli BL21(DE3)购自北京全式金生物技术有限公司。
镍离子螯合柱(HisTMTrapHP) 美国GE Healthcare Bio-Science AB公司;蛋白质分子质量标准 美国Bio-Rad公司;Bug Buster Master Mix菌体裂解液 美国Novagen公司;咪唑、牛血清白蛋白、表没食子儿茶素没食子酸酯(EGCG,纯度≥98%)、氨苄青霉素(Amp)、琼脂粉 阿拉丁试剂(上海)有限公司;S-腺苷-甲硫氨酸对甲苯磺酸盐(SAM)、异丙基-β-D-硫代吡喃半乳糖苷(IPTG) 美国Sigma公司;蛋白胨、酵母提取物 英国Oxoid公司。
Waters 2489-2690高效液相色谱仪 美国Waters公司;Buchi R-210旋转蒸发仪 瑞士Buchi公司;BS-1E振荡培养箱 金坛市环宇科学仪器厂;Eppendorf 5810R冷冻离心机 德国Eppendorf公司。
1.2 方法
1.2.1 重组茶树EGCG-O-甲基转移酶的制备
1)取1μL重组质粒加入刚刚融化的表达感受态细胞BL(21)DE3中,轻轻混匀,冰上孵育30min;42℃热激1min,置于冰上3~5min后均匀涂布于LB固体培养基(Amp+)上,37℃培养过夜。2)从平板中挑取单克隆于100mL液体培养基中,在37℃、200r/min培养约5~7h,使菌液生长至对数期;按1%的接种比例接种于新的10瓶500mL LB液体培养基,继续37℃、200r/min培养至菌液生长至对数前期约4h;加入IPTG溶液使其终浓度达到50mmol/L,20℃、150r/min培养诱导蛋白表达。3)将过夜诱导的菌液于4℃、5000r/min离心收集菌体;将得到的约20g菌体保存于-80℃冰箱;4)取10g菌体,用50mL磷酸缓冲液混匀,-20℃冷冻1h,超声溶解菌体,如此反复3次后于4℃,5000r/min离心10min,收集上清液作为粗酶液用于纯化。
1.2.2 重组茶树EGCG-O-甲基转移酶的纯化
1)将粗酶液用注射器通过0.45μm滤膜,除去其中的菌体残骸及其他杂质。2)蛋白层析柱用纯水清洗5个体积,而后再用磷酸缓冲液平衡5个体积。3)上样,搅拌均匀,放置4h(期间0.5h搅拌一次)。4)采用梯度法开始洗脱,咪唑浓度分别为0、10、20、30、40、50、60、70、80、90、100、200、300、400、500mmol/L,并将没有结合的蛋白丢弃。5)收集各个浓度咪唑洗脱液所得。6)对收集的各管洗脱液进行A280nm比色,以磷酸缓冲液做空白,保留吸光度大于零的洗脱液。7)对A280nm的各洗脱液组分进行SDS-PAGE电泳,确定目的蛋白的位置和洗脱液咪唑浓度。8)将较纯的目的蛋白各组分合并,继而用磷酸缓冲液透析以除去咪唑。
1.2.3 蛋白分子质量和浓度的测定
采用Laemmli法进行SDS-PAGE测定蛋白质分子质量;采用Lowry法,以牛血清蛋白为标准测定蛋白质浓度。
1.2.4 酶活力测定
取1mL酶液加入15mL反应液(含2mmol/L MgCl2和DTT、0.4mmol/L SAM、0.3mmol/L EGCG),于35℃水浴中反应1h,加入0.2mL 1mol/L盐酸终止反应。加入25mL乙酸乙酯萃取离心,取乙酸乙酯层真空旋转蒸发浓缩干燥后,用1.0mL水溶出,再加入0.5mL水润洗后混匀,HPLC检测甲基化儿茶素的生成量,以此生成量表示酶活力。1个酶活力单位是指在35℃反应条件下,1min内甲基供体SAM向底物EGCG转移1μmol甲基(-CH3)所需的酶量。
HPLC分析条件参照文献[14-15]进行。色谱柱:Waters Sunfire C18(4.6mm×250mm,5μm);流动相A为2%冰乙酸,流动相B为乙腈,流速为1mL/min,柱温40℃,检测波长280nm,进样量10μL,梯度洗脱,流动相B在25min内由12%线性梯度变化到25%,25.5min回到初始状态,平衡10min。
1.2.5 重组茶树EGCG-O-甲基转移酶的酶学性质测定
1.2.5.1 最适反应温度
在pH7.5时,测定不同反应温度(25、30、35、40、45、50℃)条件下EGCG-O-甲基转移酶活力,确定其最适反应温度。
1.2.5.2 最适反应pH值
在温度为35℃时,测定不同pH值(6.0、6.5、7.0、7.5、8.0)条件下EGCG-O-甲基转移酶活力,确定其最适反应pH值。
1.2.5.3 酶的动力学常数
在最适反应温度和最适pH值条件下,以EGCG为底物,分析测定EGCG-O-转移酶的动力学常数;用Lineweaver-Burk双倒数法绘出1/[V]-1/[S]直线,其斜率是Km/Vmax,在纵轴上的截距为1/Vmax,横轴上的截距为-1/Km。
2 结果与分析
2.1 重组茶树EGCG-O-甲基转移酶的镍离子螯合柱亲和纯化
由图1可知,当洗脱液中的咪唑浓度为10~30mmol/L时,有部分杂质蛋白被洗脱下来,说明在纯化的起始过程中,可先用浓度为30mmol/L的咪唑洗脱液去除大肠杆菌体内以及反应体系中可能存在的一些原有的杂蛋白;当洗脱液中的咪唑浓度为40~90mmol/L时,无蛋白质被洗脱出来,说明大部分杂蛋白可能已洗脱干净;当洗脱液中咪唑浓度大于100mmol/L时,目的蛋白开始被洗脱出来,当咪唑浓度为200mmol/L时,目的蛋白被大量洗脱出来;此外,当洗脱液中咪唑浓度为300~500mmol/L时也有少量的目的蛋白被洗脱出来。可见,在纯化EGCG-O-甲基转移酶的过程中,可采用梯度洗脱的方法进行洗脱。100~300mmol/L咪唑对应的泳道中杂蛋白含量已经很少(箭头所示为目的蛋白),说明此浓度范围纯化效果较好,可获得高纯度的EGCG-O-甲基转移酶;经分析检测,酶的纯度超过95%,分子质量约为27.6kD。

图 1 0~500mmol/L的咪唑洗脱蛋白的SDA-PAGE图谱Fig.1 SDS-PAGE analysis of protein eluted by PBS with 0 — 500 mmol/L imidazole

表 1 重组茶树EGCG-O-甲基转移酶的纯化结果Table 1 Summary of purification of recombinant tea EGCG-Otransferase
重组茶树EGCG-O-甲基转移酶的纯化结果见表1,采用镍离子亲和层析可以实现对重组茶树EGCG-O-甲基转移酶的快速纯化,得到纯度较高的EGCG-O-甲基转移酶的酶蛋白。
2.2 重组茶树EGCG-O-甲基转移酶的酶学性质
2.2.1 最适反应温度
分别测定重组茶树EGCG-O-甲基转移酶在25~50℃条件下的酶活力,考察EGCG-O-甲基转移酶催化反应的最佳温度。以酶活力最高值为100%,对不同温度作图,结果见图2。EGCG-O-甲基转移酶的最适反应温度在35℃左右。
自发现O-甲基转移酶以来,已从植物中直接分离纯化或经基因克隆获得了多种O-甲基转移酶,通过研究其酶学性质发现O-甲基转移酶的最适反应温度在35℃左右,最适pH值在6.5~8.0之间。比如Noriko等[16]从荷兰鸢尾中克隆表达的2种咖啡酸-O-甲基转移酶,并发现其最适温度为35℃,最适pH值为7.5~8.0;Wang等[17]研究表明仙女扇(Clarkia breweri)中的丁香酚-O-甲基转移酶最适温度为35℃,最适pH值为7.5。
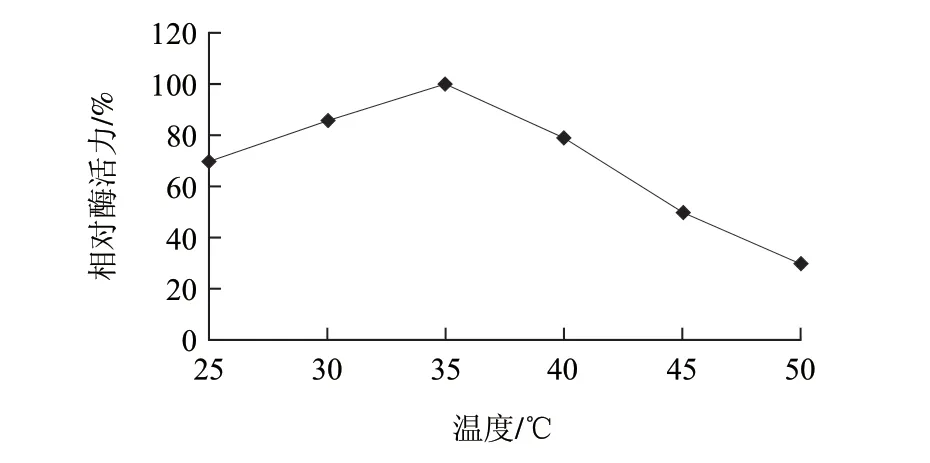
图 2 温度对EGCG-O-甲基转移酶活力的影响Fig.2 Effect of temperature on tea EGCG-O-transferase activity
2.2.2 最适反应pH值
预实验结果表明,当缓冲液pH值小于6.0时,向反应体系中加入EGCG-O-甲基转移酶后,反应体系会迅速变浑浊,经HPLC检测未发现任何新物质生成,这表明当pH值小于6.0时,EGCG-O-甲基转移酶会发生失活。实验分别测定重组茶树EGCG-O-甲基转移酶在pH6.0~8.5条件下的酶活力,考察EGCG-O-甲基转移酶催化反应的最适pH值。以酶活力最高值为100%,对不同 pH值作图,结果见图3。该酶的最适反应pH值为7.5。此结果与Noriko[16]、Wang[17]等的研究结果基本一致。
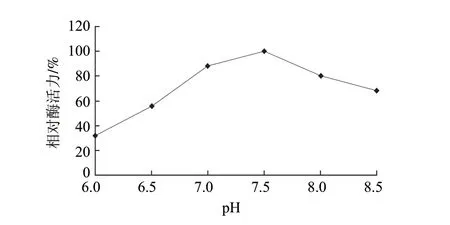
图 3 pH值对EGCG-O-甲基转移酶活力的影响Fig.3 Effect of pH on tea EGCG-O-transferase activity
2.2.3 酶动力学参数的确定
在最适反应温度35℃和最适pH 7.5条件下,以EGCG作为底物,测定酶反应的反应速率,用Lineweaver-Burk双倒数法作图。由图4可知,其回归方程为:y = 0.0134x +0.1336(R2=0.9943), EGCG-O-甲基转移酶的Km值为0.100mmol/L,Vmax为7.485mg/(L·min)。Km值的大小表示酶对底物亲合力的大小,Km越小表明酶对底物的亲合力越强。
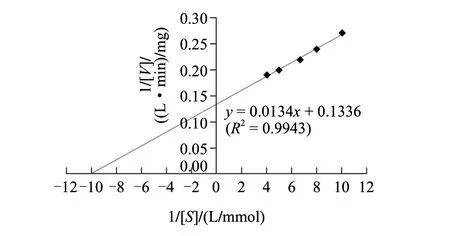
图 4 双倒数法测定EGCG-O-甲基转移酶的米氏常数Fig.4 Km determination of tea EGCG-O-transferase by doublereciprocal plot
3 结 论
重组茶树EGCG-O-甲基转移酶经过HisTMTrap亲和层析纯化后,可得到纯度超过95%的重组融合蛋白,纯化倍数为22.51倍,酶活回收率为34.54%,酶比活力达到0.0186U/mg,酶分子质量约为27.6kD。
酶学性质测定结果表明,该酶的最适反应温度为3 5 ℃,最适p H 值为7.5;以EGCG作为反应底物,得到Lineweaver-Burk双倒数线性回归方程为y= 0.0134x+0.1336(R2=0.9943),Km为0.100mmol/L,Vmax为7.485mg/(L·min)。
[1] MAEDA-YAMAMOTO M, EMA K, MONOBE M, et al. Epicatechin-3-O-(3”-O-methyl)-gallate content in various tea cultivars(Camellia sinensis L.) and its in vitro inhibitory effect on histamine release[J]. J Agric Food Chem, 2012, 60(9): 2165-2170.
[2] KURITA I, MAEDA-YAMAMOTO M, TACHIBANA H, et al. Antihypertensive effect of benifuuki tea containing O-methylated EGCG[J]. J Agric Food Chem, 2010, 58(3): 1903-1908.
[3] KIRITA M, HONMA D, TANAKA Y, et al. Cloning of a novel O-methyltransferase from Camellia sinensis and synthesis of O-methylated EGCG and evaluation of their bioactivity[J]. J Agric Food Chem, 2010, 58(12): 7196-7201.
[4] LEE S C, YAN R H, CHENG H Y, et al. Screen and genetic assessment of tea germplasms with elevated methylated catechin, (-)-epigallocatechin-3-O-(3-O-methyl)gallate[J]. J Agric Food Chem, 2009, 57(19): 8906-8912.
[5] 吕海鹏, 林智, 谭俊峰, 等. 茶叶中的EGCG3”Me研究[J]. 食品与发酵工业, 2008, 34(10): 22-25.
[6] 吕海鹏, 林智, 谭俊峰, 等. EGCG甲基化衍生物的清除DPPH自由基活性和总抗氧化活性[J]. 食品与发酵工业, 2011, 37(9): 166-170.
[7] 白艳, 江用文, 江和源, 等. 儿茶素改性的研究进展[J]. 食品科学, 2012, 33(17): 312-317.
[8] WANG Dongmei, LU Jiali, MIAO Aiqi, et al. HPLC-DAD-ESI-MS/MS analysis of polyphenols and purine alkaloids in leaves of 22 tea cultivars in China[J]. J Food Compos Anal, 2008, 21(5): 361-369.
[9] 吕海鹏, 谭俊峰, 林智. 茶树种质资源EGCG3”Me含量及其变化规律研究[J]. 茶叶科学, 2006, 26(4): 310-314.
[10] 吕海鹏, 林智, 谭俊峰, 等. 茶叶中 EGCG3”Me的研究与开发[J]. 食品工业科技, 2008, 29(12): 275-277.
[11] 吕海鹏, 孙业良, 林智, 等. 表没食子儿茶素没食子酸酯的甲基化分子修饰[J]. 食品科学, 2010, 31(15): 139-142.
[12] 费冬梅, 林智, 吕海鹏, 等. EGCG-O-甲基转移酶(EOMT)在重组大肠杆菌中的表达条件研究[J]. 茶叶科学, 2011, 31(4): 333-340.
[13] 吕海鹏, 费冬梅, 张悦, 等. EGCG-O-甲基转移酶(EOMT)催化EGCG形成的EGCG甲基化衍生物分析[J]. 茶叶科学, 2012, 32(2): 100-106.
[14] 吕海鹏, 费冬梅, 张悦, 等. EGCG甲基化衍生物酶促合成的反应条件研究[J]. 茶叶科学, 2012, 32(5): 276-282.
[15] 孙业良, 吕海鹏, 林智, 等. 茶叶中EGCG3”Me的分析方法研究[J]. 茶叶科学, 2009, 29(5): 379-384.
[16] NORIKO Y, MASAKO F M, HIROAKI O, et al. Molecular cloning and characterization of O-methyltransferases from the fl ower buds of Iris hollandica[J]. Journal of Plant Physiology, 2008, 165(4): 415-422.
[17] WANG J H, PICHERSKY E. Characterization of S-adenosyl-Lmethionine: (iso)eugenol O-methyltransferase involved in floral scent production in Clarkia breweri[J]. Archives of Biochemistry and Biophysics, 1998, 349(1): 153-160.
