莲房原花青素对大强度运动小鼠器官与组织的保护作用
2013-08-07吴俊,姚平,高超
吴 俊,姚 平,高 超
(1.中国人民解放军军事经济学院营养食品研究所,湖北 武汉 430035;2.华中科技大学同济医学院公共卫生学院营养与卫生学系,湖北 武汉 430030)
原花青素(proanthocyanidins,PC)属于植物来源的聚多酚类化合物,是由儿茶素、表儿茶素及表儿茶素没食子酸酯通过C4—C6或 C4—C8缩合而成的不同聚合度的混合物,广泛存在于葡萄、山楂、苹果、草莓、蓝莓、紫薯、可可豆、油菜籽、莲等多种植物中,为植物的次生代谢产物[1-3]。国内外大量研究表明,原花青素具有抗氧化、清除自由基、抗皮肤过敏、扩张血管、免疫调节、预防心血管疾病等多项生理功能,在食品、药品、化妆品等领域的研究价值日益受到关注。目前,对原花青素的开发已扩展到多个植物品种,其中包括莲科药用植物——莲。莲在我国是一种分布非常广泛的天然植物资源,具有很高的食用与药用价值。近年来的研究显示,莲的成熟花托(莲房)中含有丰富的莲房原花青素(lotus seedpod proanthocyanidins,LSPC),其分子聚合度低,生物利用率高,在清除自由基、抗脂质过氧化、抑制心血管疾病等方面均表现出显著的生理活性[4-6]。基于此,本研究采取乙醇浸提,柱层析纯化法提取莲房原花青素,建立小鼠大强度运动训练模型,通过灌服不同剂量莲房原花青素,测试与分析小鼠在大强度力竭性运动条件下的生理生化指标和组织器官变化,探讨莲房原花青素对大强度运动训练动物机体的保护作用,为拓展莲房原花青素在军事体能训练与体育竞技运动保健食品方面的应用研究提供理论及实验依据。
1 材料与方法
1.1 材料与试剂
选择产自湖北省洪湖地区当年生新鲜去籽莲房,清水洗涤后经石油醚脱脂,低温干燥、粉碎,加入一定量体积分数为75%的乙醇溶液,于60℃条件下振荡、浸提90min,减压蒸馏去除浸提液中的乙醇,过滤,将滤液经Sephadex LH-20凝胶柱层析分离纯化后冷冻干燥,得浅黄色莲房原花青素提取物[6-8]。以儿茶素为对照品,采用硫酸-香草醛法[9]测定提取物中原花青素含量大于98%,计算得率为3.06%。
BALB/c ICRC57清洁级雄性成年小鼠,体质量(18±1)g 上海西普尔-必凯实验动物有限公司。
血清尿素氮(BUN)、肌酐(Cre)、谷丙转氨酶(GPT)、谷草转氨酶(GOT)、乳酸脱氢酶(LDH)、肌酸激酶(CK)、超氧化物歧化酶(SOD)、谷胱甘肽(GSH)、丙二醛(MDA)试剂盒 北京中生北控生物科技股份有限公司;乳酸(LA)、肝糖原、肌糖原试剂盒 深圳麦瑞生物医疗电子有限公司;石油醚、乙醇均为分析纯。
1.2 仪器与设备
SpectraMax M2全能酶联仪 美国Molecular Devices公司;BS-200全自动生化分析仪 美国贝克曼库尔特公司;Hemastar 3血球计数仪 法国Yoder公司。
1.3 方法
将BALB/c ICRC57清洁级雄性成年小鼠,随机分为5组,每组10只。具体分组如下:A.安静对照组;B.运动对照组;C. LSPC低剂量运动组(20mg/(kg·d));D. LSPC中剂量运动组(50mg/(kg·d));E. LSPC高剂量运动组(100mg/(kg·d))。
各组小鼠经口灌胃给予不同剂量的莲房原花青素或对照物(蒸馏水),连续30d。在灌胃的第20天起,各运动组小鼠先进行3d的适应性跑台运动,休息2d后,开始正式大强度力竭性运动。每次运动初始速率为10m/min,在10min内逐渐增加负荷达到28m/min速率,以弱电刺激小鼠持续跑动60min,每天1次,至第5天运动结束,立即处死各运动组小鼠,采血,解剖分离心、肝、肾和股四头肌,作生化检测与病理分析[10-12]。
1.4 指标测定
血液学指标:采血,EDTAK2抗凝后利用全自动生化分析仪测定血红蛋白(Hb),利用血球计数仪计数红细胞(RBC)、白细胞(WBC)及其分类(淋巴细胞、单核细胞)。
BUN、Cre、GPT、GOT、LDH、CK活力:采用酶动力学法测定;BUN、Cre含量:采用两点法测定;肝糖原、肌糖原、LA水平:采用酶法测定;SOD水平:采用黄嘌呤氧化酶法测定;GSH水平:采用二硫代二硝基苯甲酸(DNTB)比色法测定;MDA水平:采用硫代巴比妥酸(TBA)比色法测定。上述指标均严格按照试剂盒说明程序进行。
1.5 数据统计
实验数据采用SAS软件进行方差分析与Q检验。
2 结果与分析
2.1 LSPC对大强度运动小鼠血液学指标的影响
表 1 LSPC对大强度运动小鼠血液学指标的影响(±s,n=10)Table 1 Effect of LSPC on blood indexes in mice with high intensity exercise(±s,n=10)
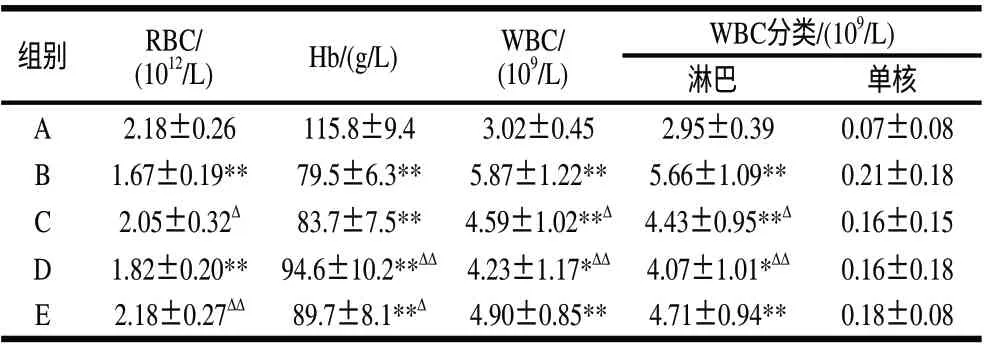
表 1 LSPC对大强度运动小鼠血液学指标的影响(±s,n=10)Table 1 Effect of LSPC on blood indexes in mice with high intensity exercise(±s,n=10)
注:*.与A 组相比,有显著性差异(P <0.05);**.与A 组相比,有极显著性差异(P <0.01);Δ.与B 组相比,有显著性差异(P <0.05);ΔΔ.与B 组相比,有极显著性差异(P <0.01)。下同。
WBC分类/(109/L)淋巴 单核A2.18±0.26115.8±9.43.02±0.452.95±0.390.07±0.08 B1.67±0.19**79.5±6.3**5.87±1.22**5.66±1.09**0.21±0.18 C2.05±0.32Δ83.7±7.5**4.59±1.02**Δ 4.43±0.95**Δ0.16±0.15 D1.82±0.20** 94.6±10.2**ΔΔ 4.23±1.17*ΔΔ 4.07±1.01*ΔΔ0.16±0.18 E2.18±0.27ΔΔ89.7±8.1**Δ4.90±0.85**4.71±0.94**0.18±0.08组别RBC/(1012/L)Hb/(g/L)WBC/(109/L)
大强度运动条件下机体活性自由基生成量增多,攻击细胞器及亚细胞器,成为造成机体组织出现运动性炎症反应的重要原因,甚至引发一系列病理损伤[13-14]。由表1可见,经过大强度力竭性运动,与A组小鼠相比,B组小鼠的RBC与Hb水平极显著下降,WBC与淋巴细胞计数极显著升高,说明大强度运动训练已致小鼠免疫功能下降,出现炎症反应。当预先给予不同剂量的莲房原花青素后,小鼠的上述指标均有不同程度的恢复,且中等剂量组干预效果明显,这主要与莲房原花青素具有较强的清除自由基活性直接相关。
2.2 LSPC对大强度运动小鼠血清生化指标的影响
由表2可见,B组小鼠的血清GPT、GOT明显升高,反映大强度力竭性运动后小鼠肝细胞受到损伤;BUN、Cre水平的升高则提示肾脏受到不良影响;过度运动导致骨骼肌中的CK和脏器细胞胞浆中的LDH大量渗出,从而使血清中CK与LDH水平极显著升高,提示脏器及骨骼肌受损;血糖是机体能量的重要来源,大强度力竭性运动条件下小鼠出现能量代谢障碍,细胞无氧代谢强度增加,致使血糖水平下降,而血液中LA水平明显增高,将加速运动性疲劳产生。经不同剂量的莲房原花青素干预后,小鼠上述血清指标均有不同程度的改善,尤其以中、高剂量组干预效果显著。
表 2 LSPC对大强度运动小鼠血清生化指标的影响(±s,n=10)Table 2 Effect of LSPC on serum biochemical indexes in mice with high intensity exercise(±s,n=10)

表 2 LSPC对大强度运动小鼠血清生化指标的影响(±s,n=10)Table 2 Effect of LSPC on serum biochemical indexes in mice with high intensity exercise(±s,n=10)
组别 GPT活力/(U/L) GOT活力/(U/L) BUN含量/(mmol/L) Cre含量/(μmol/L) Glu含量/(mmol/L) LA含量/(mmol/L) LDH活力/(1000U/L) CK活力/(U/L)A47.2±5.4113±154.48±0.6038.9±5.15.53±0.664.22±0.581.83±0.31354±41 B63.1±7.6**179±21**7.89±1.01**47.6±6.3**3.11±0.37**6.38±1.03**3.09±0.51**822±114**C59.7±7.6**144±19**ΔΔ6.92±1.35**44.8±5.7*3.44±0.50**6.00±0.92**2.88±0.46**772±98**D51.7±8.9ΔΔ149±22**ΔΔ5.83±0.72**ΔΔ38.4±7.0Δ3.95±0.54**ΔΔ5.87±0.70**2.24±0.50ΔΔ686±83**Δ E54.8±6.3*Δ156±27**6.07±0.85**ΔΔ41.6±8.93.38±0.54**5.75±0.88**2.49±0.43**Δ759±95**
2.3 LSPC对大强度运动小鼠肌肉及脏器的影响
解剖各组小鼠,取股四头肌、心肌、肝脏、肾脏,匀浆后测定超氧化物歧化酶(SOD)活性、谷胱甘肽(GSH)和丙二醛(MDA)含量,测定肝糖原和肌糖原的质量分数,结果如表3所示。
表 3 LSPC对大强度运动小鼠脏器氧化应激保护作用及肝、肌糖原水平的影响(±s,n=10)Table 3 Effect of LSPC on the protection of oxidative stress-induced organ damage, and the contents of hepatic glycogen and muscle glycogen in mice with high intensity exercise(±s,n=10)
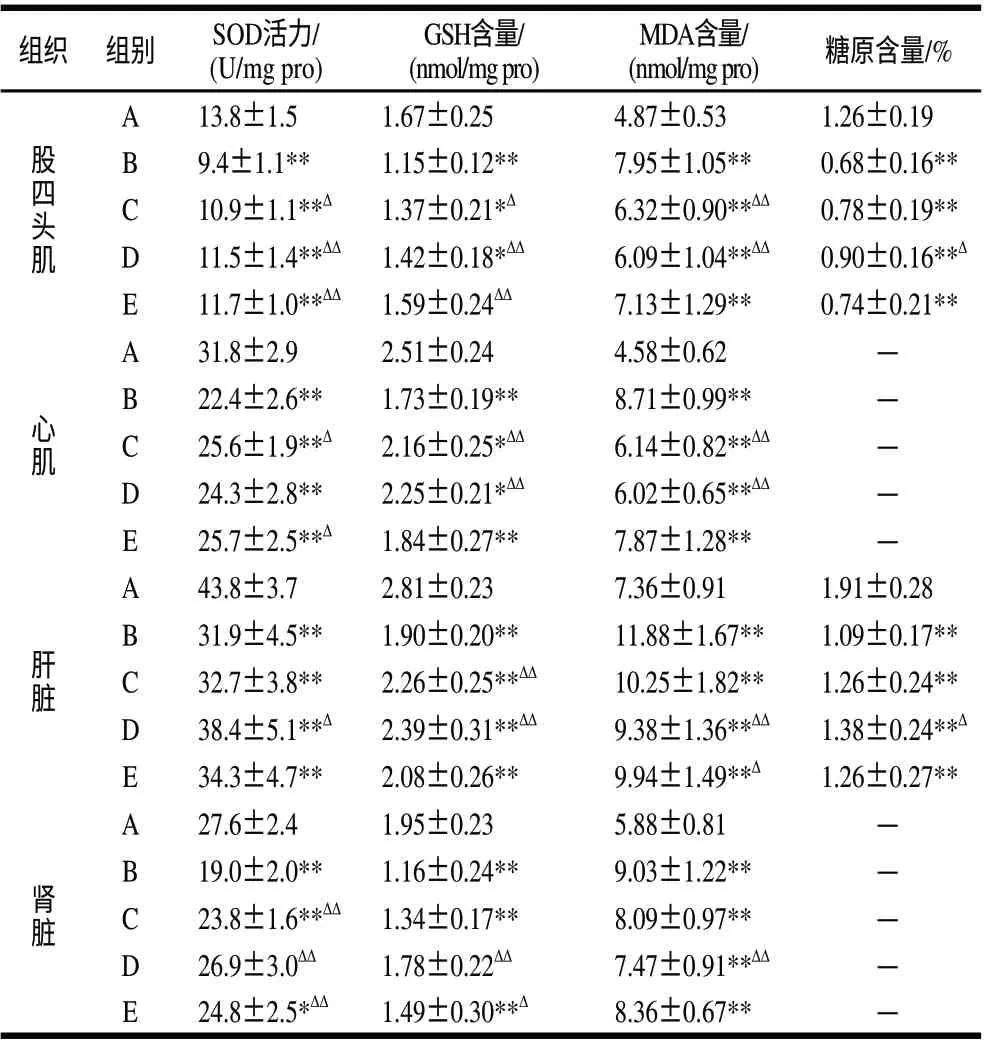
表 3 LSPC对大强度运动小鼠脏器氧化应激保护作用及肝、肌糖原水平的影响(±s,n=10)Table 3 Effect of LSPC on the protection of oxidative stress-induced organ damage, and the contents of hepatic glycogen and muscle glycogen in mice with high intensity exercise(±s,n=10)
注:—. 该项指标未进行测定。
组织 组别SOD活力/(U/mg pro)GSH含量/(nmol/mg pro)MDA含量/(nmol/mg pro)糖原含量/%股四头肌A13.8±1.51.67±0.254.87±0.531.26±0.19 B9.4±1.1**1.15±0.12**7.95±1.05**0.68±0.16**C10.9±1.1**Δ1.37±0.21*Δ6.32±0.90**ΔΔ0.78±0.19**D11.5±1.4**ΔΔ 1.42±0.18*ΔΔ6.09±1.04**ΔΔ0.90±0.16**Δ E11.7±1.0**ΔΔ 1.59±0.24ΔΔ7.13±1.29**0.74±0.21**心肌A31.8±2.92.51±0.244.58±0.62—B22.4±2.6**1.73±0.19**8.71±0.99**—C25.6±1.9**Δ2.16±0.25*ΔΔ6.14±0.82**ΔΔ —D24.3±2.8**2.25±0.21*ΔΔ6.02±0.65**ΔΔ —E25.7±2.5**Δ1.84±0.27**7.87±1.28**—肝脏A43.8±3.72.81±0.237.36±0.911.91±0.28 B31.9±4.5**1.90±0.20**11.88±1.67**1.09±0.17**C32.7±3.8**2.26±0.25**ΔΔ10.25±1.82**1.26±0.24**D38.4±5.1**Δ2.39±0.31**ΔΔ9.38±1.36**ΔΔ1.38±0.24**Δ E34.3±4.7**2.08±0.26**9.94±1.49**Δ1.26±0.27**A27.6±2.41.95±0.235.88±0.81—B19.0±2.0**1.16±0.24**9.03±1.22**—C23.8±1.6**ΔΔ 1.34±0.17**8.09±0.97**—D26.9±3.0ΔΔ1.78±0.22ΔΔ7.47±0.91**ΔΔ —E24.8±2.5*ΔΔ 1.49±0.30**Δ8.36±0.67**—肾脏
肝脏与肾脏通常是大强度运动训练过程中脏器损伤的主要靶器官,心肌组织与骨骼肌也是过度运动的易损部位[14-15]。由表3可见,在大强度力竭性运动的强氧化应激作用下,小鼠机体抗自由基损伤能力受到干扰,大量自由基持续攻击生物膜引发脂质过氧化作用,导致小鼠股四头肌、心肌、肝脏、肾脏中SOD活力显著下降,MDA水平明显升高。同时,GSH与肝糖原大量消耗,提示大强度力竭性运动导致机体免疫功能及能量代谢过程受到影响。给予不同剂量的莲房原花青素,上述各指标均有不同程度的恢复,尤其以中剂量干预效果明显,说明莲房原花青素对大强度力竭性运动引起的脏器组织氧化应激具有明显的保护作用,并可在一定程度上维持肝糖原和肌糖原的正常水平,从而有效降低过度运动所致的疲劳损伤,提高运动训练效果。
2.4 LSPC对大强度运动小鼠骨骼肌与心肌病理变化的影响
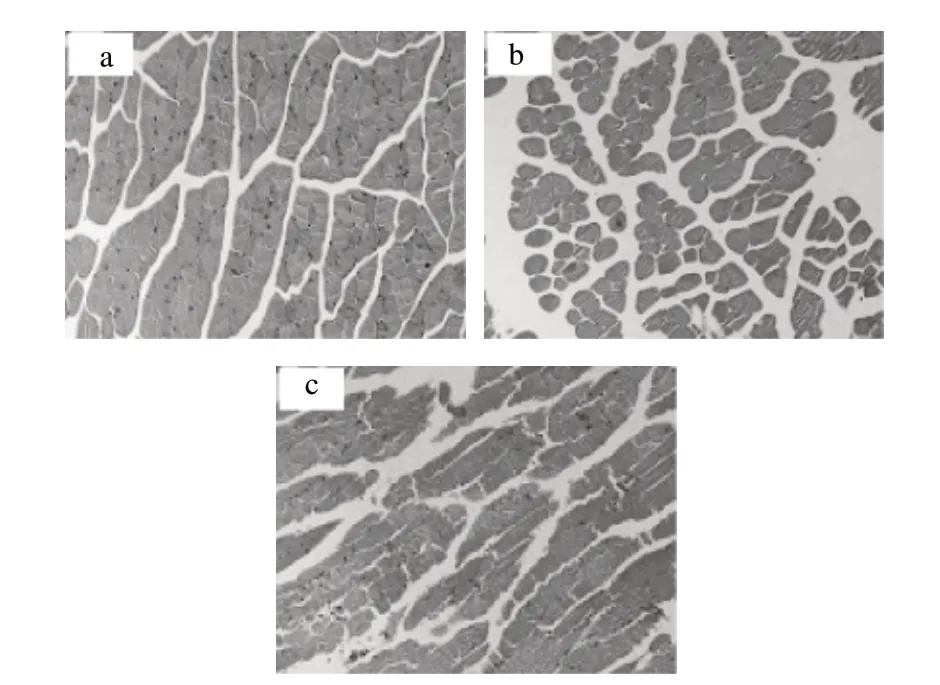
图 1 各组实验小鼠骨骼肌切片Fig.1 Skeletal muscle sections of the mice from each group

图 2 各组实验小鼠心肌切片Fig.2 Cardiac muscle sections of the mice from each group
由图1可知,运动对照组小鼠的骨骼肌纤维呈现广泛肿胀,形态扭曲或断裂,有肌溶解现象,肌核分布不匀,甚至局部出现核聚集[16]。而给予莲房原花青素的运动组小鼠,其骨骼肌仍保持了较为规则的细胞结构,只呈现出轻微肿胀。由图2可知,运动对照组小鼠心肌纤维广泛扭曲、断裂,出现肌溶解与间质出血,心肌灶性坏死,而灌服莲房原花青素的运动组小鼠,其心肌纤维虽然存在局部扭曲或断裂,但与运动对照组相比,肌纤维排列较规则,异常表现轻微。图1、2表明,莲房原花青素对大强度运动训练条件下小鼠的骨骼肌与心肌具有一定的保护作用。
3 结 论
利用莲房原花青素在清除自由基以及抗脂质过氧化方面所表现出的生理活性,能够有效缓解大强度力竭性运动训练对小鼠脏器及组织细胞的不良影响,并通过降低毛细血管通透性,减少毛细血管壁的脆性,以减轻大强度运动所致的机体炎症反应;莲房原花青能够促进无氧代谢条件下血乳酸的清除,降低大强度运动训练导致的强氧化应激损伤,对骨骼肌、心脏、肝脏及肾脏均表现出明显的保护作用,并呈现出一定的剂量性依赖关系。综上所述,莲房原花青素在缓解大强度运动性疲劳,预防过度训练所致机体损伤等方面具有明显的生理功能性作用。
[1] 张小军, 夏春镗, 吴建铭, 等. 原花青素的资源研究[J]. 中药材, 2009, 32(6): 1154-1158.
[2] ARLES A S, RAY H, GRUBER Y. New perspectives on proanthocyanidin biochemistry and molecular regulation[J]. Phytochemitry, 2003, 64: 367-383.
[3] 苏蕾. 原花青素保健功能研究概述[J]. 山东师范大学学报: 自然科学版, 2007, 22(3): 113-114.
[4] 唐瑛, 黄光华, 吴建军. 莲房原花青素对高脂血症大鼠脂质过氧化及内皮素的影响[J]. 华南国防医学杂志, 2008, 22(4): 9-11.
[5] 凌智群, 谢笔钧. 莲房原花青素抗氧化损伤作用的研究[J]. 食品科学, 2002, 23(7): 98-100.
[6] LING Zhiqun, XIE Bijun, YANG Erlin. Isolation, characterization and determination of antioxidative activity of oligomeric procyanidins from the seedpot of nelumbo nucifera gaerth[J]. J Agric Food Chem, 2005, 53: 2441-2445.
[7] 崔倩, 蒋益虹, 戴蕾, 等. 莲房原花青素的提取纯化工艺研究[J]. 食品工业科技, 2011, 32(8): 238-241.
[8] 肖付才. 葡萄籽原花青素检测方法的研究[D]. 杨凌: 西北农林科技大学, 2007.
[9] POTER L J, HRSTICH L N, CHAN B G. The conversion of procyanidins and prodelphinidins to cyaniding and delphinidin[J]. Phytochemistry, 1986, 25: 223-227.
[10] 白新鹏. 功能性食品设计与评价[M]. 北京: 中国计量出版社, 160-168.
[11] 龚梦娟, 王立为, 刘新民. 大小鼠游泳实验方法的研究概况[J]. 中国比较医学杂志, 2005, 15(5): 311-314.
[12] 刘畅, 何宇. 原花青素对大鼠力竭运动后不同时相肝脏自由基代谢的影响[J]. 成都体育学院学报, 2008, 34(10): 74-78.
[13] 陈洪. 高强度军事训练致肾损伤的研究进展[J]. 军医进修学院学报, 2007, 28(5): 384-385.
[14] 吴文礼, 容俊芳, 温进坤. 近年来过度训练致脏器损伤的研究概况[J]. 解放军医学杂志, 2006, 31(3): 267-269.
[15] 雷志勇, 秦永生, 宋立新, 等. 大强度体能训练对战士身体机能的影响[J]. 解放军预防医学杂志, 2007, 25(5): 350-351.
[16] JI Lili. Antioxidant signaling in skeletal muscle: a brief review[J]. Experimental Gerontology, 2007, 42: 582-593.
