胭脂萝卜红色素热处理及贮藏过程中降解动力学
2013-08-07雷丹丹赵国华
董 楠,王 强,雷丹丹,刘 宏,刘 嘉,赵国华,4,*
(1.西南大学食品科学学院,重庆 400715;2.重庆第二师范学院生物与化学工程系,重庆 400067;3.中国农业科学院农业信息研究所,北京 100081; 4.重庆市特色食品工程技术研究中心,重庆 400715)
胭脂萝卜红色素是以胭脂萝卜肉质根为原料提取的一种天然食用色素,属于类黄酮系,主要由花色素苷构成[1]。随着近年来天然食用色素的开发利用,胭脂萝卜红色素以其安全、无毒、资源丰富的优点逐渐为人们所关注。同时,作为花色苷类色素又具有一定营养和生理功能如抗氧化、抗辐射、抗肿瘤、预防糖尿病等,是国家添加剂标准委员会允许使用的天然色素之一[2]。因此,加强胭脂萝卜红色素的研究和利用对促进食品行业的发展有深远的意义。天然花色苷类色素的稳定性较差,容易受到诸多因素的影响。例如:温度、pH值、压强、光照等,其中受温度的影响最为显著[3-4],食品工业中常用的杀菌方法(如巴氏杀菌等)所引起的温度变化均会影响花色苷类色素稳定性,从而影响食品感官特性[5-6]。同时,溶液中的VC质量浓度对花色苷稳定性也有一定的影响[7]。本实验对胭脂萝卜红色素在不同温度、不同VC质量浓度的色素溶液中的降解动力学进行研究,以期为胭脂萝卜红色素的在食品行业中的开发利用提供参考。
1 材料与方法
1.1 材料与试剂
胭脂萝卜红色素、花青素E163,由重庆市武隆仙女天然色素有限责任公司提供。
抗坏血酸(优级纯) 天津市光复精细化工研究所;蔗糖、柠檬酸、山梨酸钾、苯甲酸钠等均为国产分析纯。
1.2 仪器与设备
UV-2450紫外-可见分光光度计 日本岛津公司;722紫外-可见分光光度计 上海现科仪器有限公司;HWS-24电热恒温水浴锅 上海齐欣科学仪器有限公司;PB-10酸度计 德国Sartorius公司。
1.3 方法
1.3.1 色素的最大吸收波长的测定
配制质量浓度为0.01g/100mL的色素溶液,用pH 3.0的柠檬酸-柠檬酸钠缓冲液定容,紫外-可见分光光度计在波长400~700nm范围内扫描图谱,确定该色素的最大吸收波长λmax。
1.3.2 缓冲溶液中的热降解动力学[8]
1.3.2.1 缓冲溶液中贮藏过程的热降解动力学
配制质量浓度为0.01g/100mL的色素溶液,用pH 3.0的柠檬酸-柠檬酸钠缓冲液定容,于85℃处理5min,然后取适量于具塞塑料管(无顶隙空间)在4、25℃条件下避光放置1、2、3、4、6、8、12、16、20、28d,然后,取样测定其λmax并计算花色苷保留量、降解的速率常数、半衰期和活化能。
1.3.2.2 缓冲溶液中热处理过程的热降解动力学
配制质量浓度为0.01g/100mL的色素溶液,装入具塞试管中,分别在75、80、85、90、95℃条件下恒温水浴连续加热6.5h,在10、20、30、40、50min和1、1.5、2、2.5、3、4、5、6.5h时分别取出一个样品在冰水中迅速冷却后测定其λmax并计算色素降解的速率常数、半衰期和活化能。
1.3.3 软饮料模型中的热降解动力学研究[9]
1.3.3.1 无CO2型软饮料的配制
1000g色素溶液中含蔗糖86g、苯甲酸钠0.14g、山梨酸钾0.18g、柠檬酸1.52g,色素质量浓度0.01g/100mL,VC添加量分别为0、0.04、0.12、0.36g,pH值调至3.0。
1.3.3.2 软饮料模型中贮藏过程的热降解动力学
将上述不同VC添加量的无CO2型软饮料于85℃处理5min,然后取适量于具塞塑料管(无顶隙空间)4、25℃条件下避光放置1、2、3、4、6、8、12、16、20、28d时取出样品测定其λmax并计算色素降解的速率常数、半衰期和活化能。
1.3.3.3 软饮料模型中热处理过程中热降解动力学
将上述不同VC添加量的无CO2型软饮料分别在75、80、85、90、95℃条件下恒温水浴连续加热6.5h,在10、20、30、40、50min和1、1.5、2、2.5、3、4、5、6.5h时分别取出一个样品在冰水中迅速冷却后测定其λmax并计算色素降解的速率常数、半衰期和活化能。
1.3.4 花色苷降解速率常数、半衰期和活化能的计算
1.3.4.1 零级反应动力学参数的计算[10]
零级动力学的降解速率可由下式表示:

式中:ρ是降解后花色苷含量/(g/100mL);ρ0是初始时刻花色苷含量/(g/100mL);ρt是一定温度下加热tmin或贮藏td后花色苷含量/(g/100mL);t1/2是花色苷降解的半衰期;k是降解动力学反应速率常数。
1.3.4.2 一级反应动力学参数的计算[11-12]
按公式(4)、(5)计算一级反应速率常数(k)、半衰期(t1/2)。
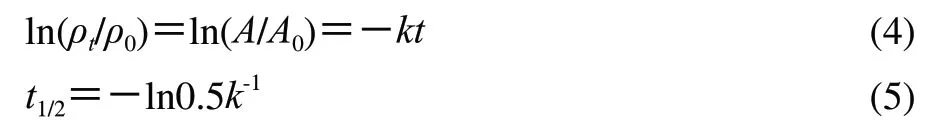
式中:ρ0是初始时刻花色苷含量/(g/100mL);ρt是一定温度下加热tmin或贮藏td后花色苷含量/(g/100mL);ρ0和ρt可用A0和A代替,A0为初始时刻花色苷样品液在最大吸收波长处的吸光度;A是一定温度下加热tmin后花色苷样品液在最大吸收波长处的吸光度。花色苷单体实验中,A0和A分别为初始时刻和加热tmin后各花色苷在λmax检测波长下的色谱峰面积。
反应活化能(Ea)按式(6)计算:

式中:k为热降解速率常数;R为气体常数,为8.314×10-3kJ/(mol·K);k0为频率常数;T为绝对温度/K。
当Arrhenius方程(式(6))两边同时取对数时,得lnk=lnk0-Ea/RT,由式(5)可得不同温度下的热降解反应常数k,根据不同温度下的k值,以lnk对1/T作线性回归,直线的斜率为-Ea/R,截距为lnk0,由直线的斜率即可求出活化能Ea。
1.3.4.3 色素保留量的计算[13]
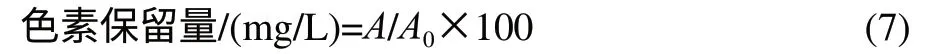
式中:A为一定条件处理后的吸光度;A0为初始吸光度。
2 结果与分析
2.1 胭脂萝卜红色素热降解动力学
2.1.1 pH3.0柠檬酸缓冲液中胭脂萝卜红色素的热降解动力学
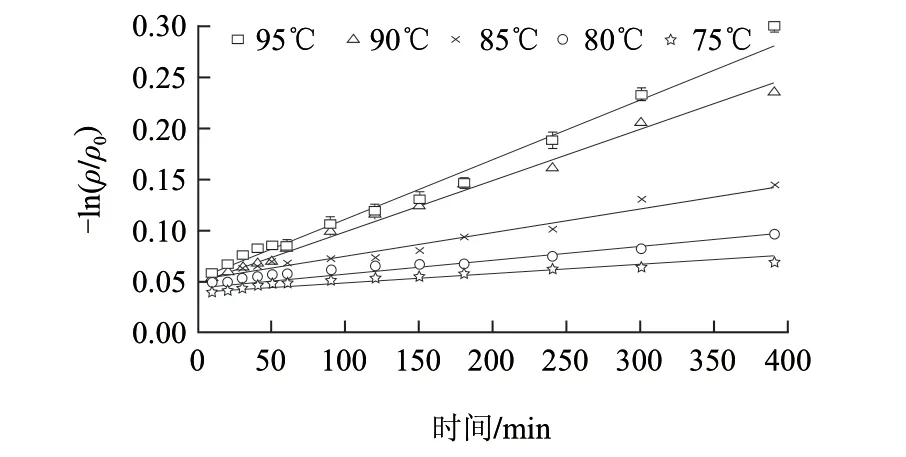
图 1 0.1mol/L、pH3.0柠檬酸缓冲液中胭脂萝卜红色素的热降解Fig.1 Degradation for raddish red pigment in citric acid-sodium buffer at different heating temperatures
由图1可知,不同加热温度条件下,-ln(ρ/ρ0)与时间呈良好的线性关系,相关系数均大于0.99,说明胭脂萝卜红色素热降解符合一级反应动力学规律,降解速率随温度升高而增大,降解的动力学参数计算结果见表1。花色苷的二苯基苯并吡喃阳离子(AH+)的失电子过程AH+→A是放热反应,水解反应AH+→B(甲醇假碱)和开环反应B→C(查尔酮)是吸热反应并且伴随着熵的增大。因此,温度升高时,平衡向着无色的甲醇假碱和查尔酮形式转化,并显著影响花色苷的热降解速率[14-15]。有学者研究了热处理温度变化对蓝莓花色苷热降解速率的影响,结果显示,70~90℃范围内,随着温度升高,蓝莓花色苷降解反应速率常数增大[16]。以lnk对1/T作线性回归,柠檬酸缓冲液中胭脂萝卜红色素热处理过程中的活化能线性回归方程为:Y=13053.0X-28.1(R2=0.9643)。
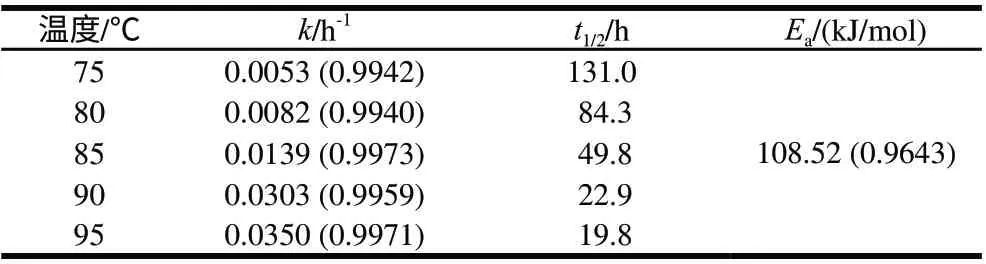
表 1 柠檬酸缓冲液中胭脂萝卜红色素热处理过程中的热降解参数Table 1 Kinetic parameters for raddish red pigment in citric acidsodium buffer (0.1 mol/L, pH 3.0) at different heating temperatures
2.1.2 不同VC添加量的软饮料模型中胭脂萝卜红色素的热降解动力学
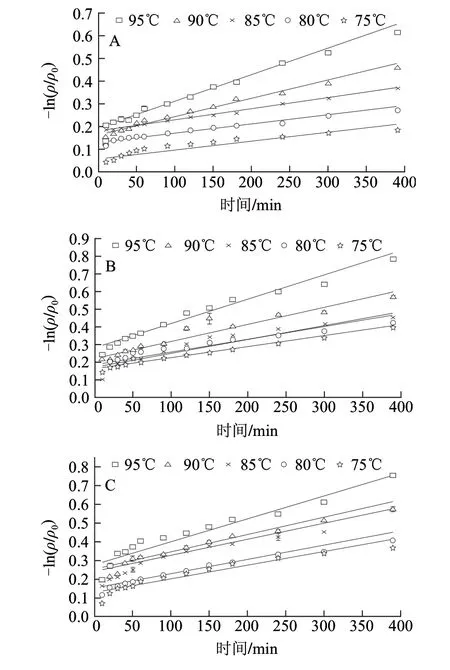
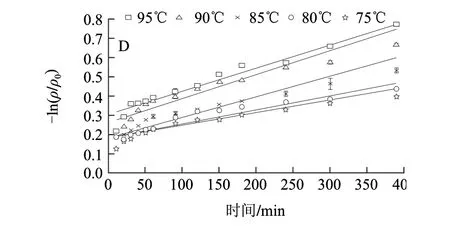
图 2 不同VC添加量饮料中胭脂萝卜红色素的热降解Fig.2 Degradation for raddish red pigment in soft drink with various vitamin C concentrations at different heating temperatures
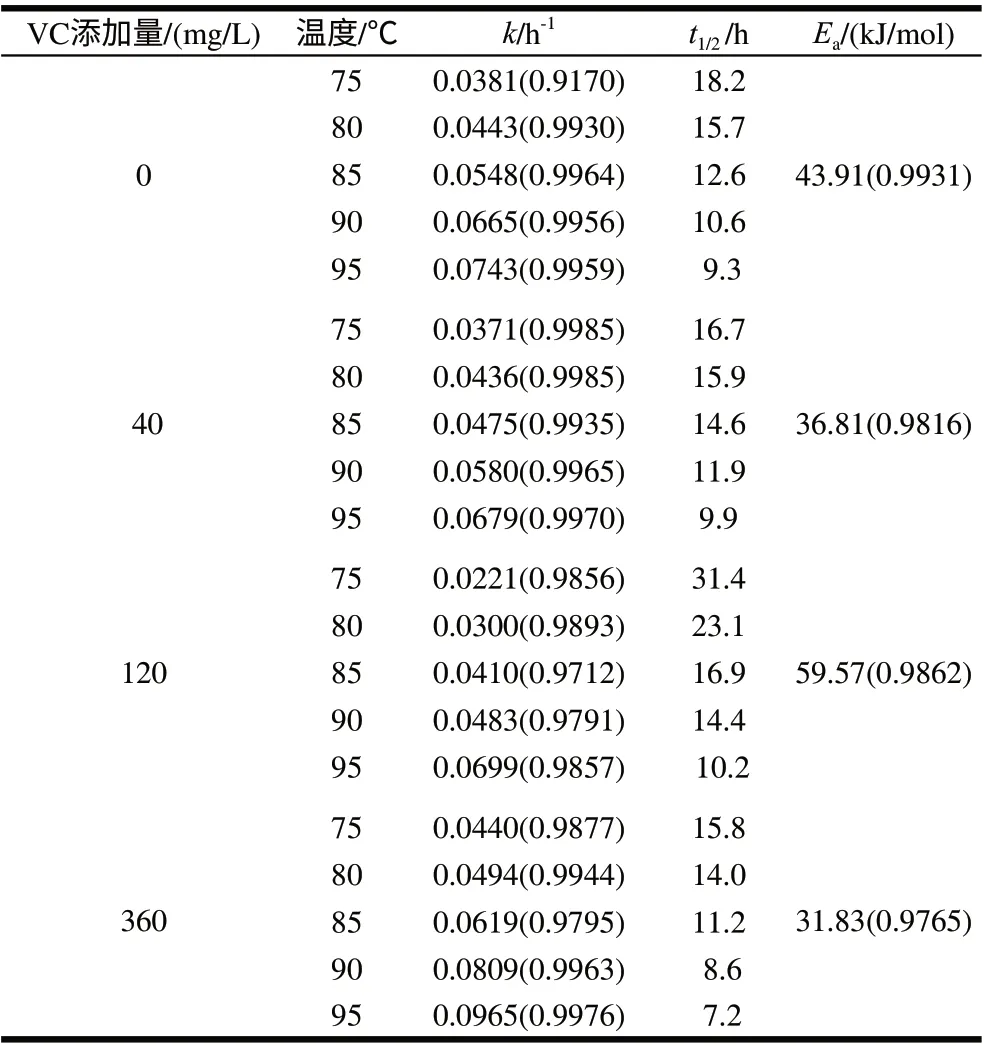
表 2 不同VC添加量下软饮料中胭脂萝卜红色素的热降解参数Table 2 Kinetic parameters for raddish red pigment in soft drink with various vitamin C concentrations at different heating temperatures
由图1、2可知,不同加热温度条件下,胭脂萝卜红色素在缓冲溶液中-ln(ρ/ρ0)与时间所得直线斜率明显小于饮料中-ln(ρ/ρ0)与时间所得直线斜率,即缓冲溶液中色素降解速率小于饮料中色素降解速率,可能是由于饮料中的VC、蔗糖等添加对其稳定性有较大影响;由图2可知,不同VC添加量对胭脂萝卜红色素的降解速率有一定影响,但胭脂萝卜红色素在软饮料模型中的热降解均符合一级动力学,随温度升高,胭脂萝卜红色素热降解速率增大。各温度下-ln(ρ/ρ0)与时间的线性关系拟合相关系数均大于0.95,结果见表2。有研究表明,VC对花色苷稳定性的影响与VC的质量浓度有关,热处理条件下,低质量浓度的VC能提高花色苷的稳定性,高质量浓度VC则能够加速花色苷降解[17-18]。研究证明,70~90℃范围内,添加360mg/L的抗坏血酸能显著促进血橙花色苷热降解[7]。80℃条件下,添加100mg/L的抗坏血酸使紫薯花色苷的活化能减小,热稳定性显著下降[19]。以lnk对1/T作线性回归,不同VC质量浓度下软饮料中胭脂萝卜红色素的活化能线性回归方程为:0mg/L时Y=5281.4X-5.4(R2=0.9931);40mg/L时Y=4434.6X-3.6 (R2=0.9816);120mg/L时Y=7164.9X-12.7(R2=0.9862);360mg/L时Y=3828.2X-7.9(R2=0.9765)。
由表2可知,当VC添加量为40mg/L和360mg/L时,色素热降解的活化能较小,稳定性最差;120mg/L时,胭脂萝卜红色素热降解的活化能最大,半衰期最长,即稳定性为最好。这说明,添加适量的VC,对提高色素稳定性有一定的作用,VC添加超过一定质量浓度范围,则会加速的色素的降解。
2.2 胭脂萝卜红色素贮藏过程中的降解动力学
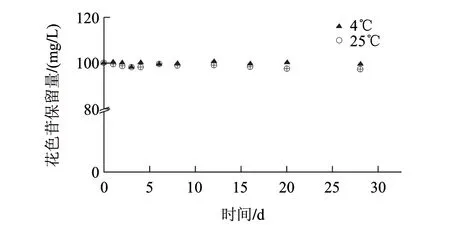
图3 4℃和25℃条件下柠檬酸缓冲溶液(0.1mol/L, pH3.0)中胭脂萝卜红色素的保留量Fig.3 Residual amounts of raddish red pigment in citric acid-sodium buffer during storage at 4 ℃ and 25 ℃
由图3可知,0.1mol/L、pH3.0柠檬酸-柠檬酸钠缓冲溶液中4、25℃贮藏条件下,胭脂萝卜红色素稳定性较好,4周之内仍能保持稳定。4℃条件下,胭脂萝卜红色素热降解符合零级动力学,其降解速率只与降解时间有关,与物质质量浓度无关。由表3可知,以不加VC的软饮料为例做对比,4℃条件下色素的半衰期为66.0d,25℃条件下色素半衰期为15d,25℃常温贮藏的降解半衰期明显小于4℃低温贮藏的降解半衰期。因此,该色素溶液在低温下保藏,其稳定性更好。
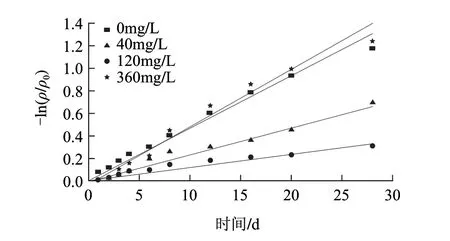
图 4 25℃条件下饮料中胭脂萝卜红色素的降解Fig.4 Degradation for raddish red pigment in soft drink during storage at 25 ℃
由图4可知,25℃条件下,胭脂萝卜红色素热降解符合一级动力学。由表3可知,其降解速率及半衰期如VC添加量为120mg/L时,半衰期最长,说明适量的VC添加,有利于胭脂萝卜红色素在25℃贮藏的稳定性。
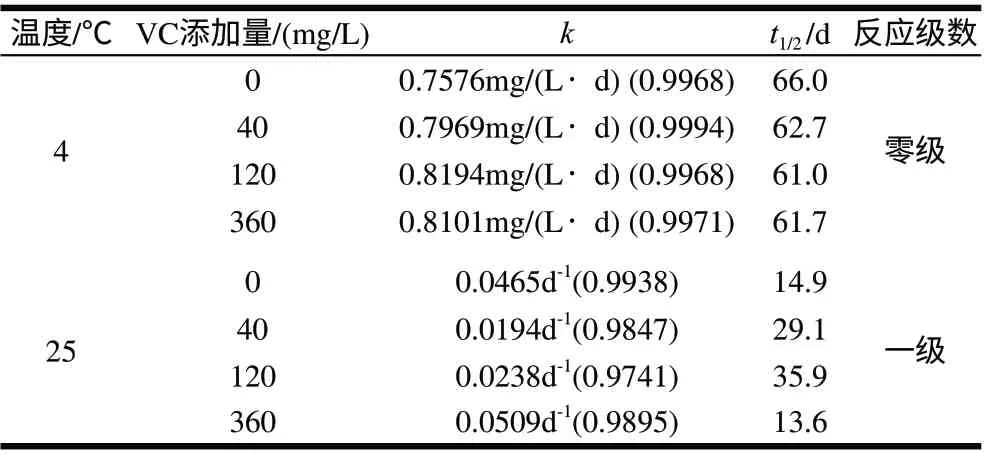
表 3 不同VC添加量胭脂萝卜色素在贮藏过程中的降解参数Table 3 Kinetic parameters for raddish red pigment in soft drink with various vitamin C concentrations
3 结 论
本实验对胭脂萝卜红色素加在缓冲溶液和软饮料中的降解进行了研究。在热处理条件下(75~95℃),其在不同溶液体系的降解均符合一级反应动力学模型,热处理条件下色素降解速率随温度升高而增大。当VC添加量为120mg/L时,溶液中色素降解速率最小,其活化能为59.57kJ/mol。色素溶液在4℃低温条件下贮藏,其降解动力学符合零级动力学,稳定性良好,VC质量浓度不对其稳定性产生影响;25℃条件下贮藏,其降解动力学符合一级动力学,且VC添加量对其稳定性的影响作用与高温处理情况下结果一致,即添加量为120mg/L时降解速率最小,色素稳定性最好,360mg/L时降解速率最大。因此,在工业运用中该色素适合低温贮藏,如在25℃常温条件下贮藏及75℃以上热处理时,添加适量VC能有效降低色素降解速率提高稳定性。
[1] 王晓梅, 徐为民, 郑永华. 红心萝卜花色苷稳定性的研究[J]. 食品科学, 2008, 29(7): 98-100.
[2] 凌关庭. 食品添加剂手册[M]. 3版. 北京: 化学工业出版社, 2008: 955-1012.
[3] VERBEYST L, OEY I, VANDER I, et al. Kinetic study on the thermal and pressure degradation of anthocyanins in straw berries[J]. Food Chemistry, 2010, 123(2): 269-274.
[4] BUCKOW R, KASTELL A, TEREFE N S, et al. Pressure and temperature effects on degradation kinetics and storage stability of total anthocyanins in blueberry juice[J]. Journal of Agricultural and Food Chemistry, 2010, 58(18): 10076-10084.
[5] HARBOURNE N, JACQUIER J C, MORGAN D J, et al. Determination of the degradation kinetics of anthocyanins in a model juice system using isothermal and non-isothermal methods[J]. Food Chemistry, 2008, 111(1): 204-208.
[6] PATRAS A, BRUNTONA N P, O’DONNELL C, et al. Effect of thermal processing on anthocyanin stability in foods: mechanisms and kinetics of degradation[J]. Trends in Food Science and Technology, 2010, 21(1): 3-11.
[7] CAO Shaoqian, LIU Liang, LU Qi, et al. Integrated effects of ascorbic acid, flavonoids and sugars on thermal degradation of anthocyanins in blood orange juice[J]. European Food Research Technology, 2009, 228(6): 975-983.
[8] WROLSTAD R E, GIUSTI M M, RODRIGUEZ-SAONA L E, et al. Anthocyanins from radishes and red-fleshed potatoes[M]// AMES J, MHOFMANN T F. Chemistry and physiology of selected food colorants. Washington, DC: American Chemical Society, 2001: 66-89.
[9] DYRBY M, WESTERGAARD N, STAPELFELDT H. Light and heat sensitivity of red cabbage extract in soft drink model systems[J]. Food Chemistry, 2001, 72(4): 431-437.
[10] WANG Weidong, XU Shiying. Degradation kinetics of anthocyanins in blackberry juice and concentrate[J]. Journal of Food Engineering, 2007, 82(3): 271-275.
[11] KIRA A, CEMEROGLU B. Degradation kinetics of anthocyanins in blood orange juice and concentrate[J]. Food Chemistry, 2003, 81(4): 583-587.
[12] VERBEYST L, OEY I, VANDER P I, et al. Kinetic study on the thermal and pressure degradation of anthocyanins in strawberries[J]. Food Chemistry, 2010, 123(2): 269-274.
[13] 董楠, 宋会歌, 赵国华, 等. 咖啡酸对胭脂萝卜红色素辅色作用及稳定性的影响[J]. 食品科学, 2011, 32(7): 61-64.
[14] ANTELO F S, COSTA A V, KALIL S J. Thermal degradation kinetics of the phycocyanin from Spirulina platensis[J]. Biochemical Engineering Journal, 2008, 41(1): 43-47.
[15] TIWARI B K, O’DONNELL C P, CULLEN P J. Effect of non-thermal processing technologies on the anthocyanin content of fruit juices[J]. Trends in Food Science and Technology, 2009, 20(3/4): 137-145.
[16] BUCKOW R, KASTELL A, TERE N S, et al. Pressure and temperature effects on degradation kinetics and storage stability of total anthocyanins in blueberry juice[J]. Journal of Agricultural and Food Chemistry, 2010, 58(18): 10076-10084.
[17] OZKAN M. Degradation of anthocyanins in sour cherry and pomegranate juices by hydrogen peroxide in the presence of added as corbic acid[J]. Food Chemistry, 2002, 78(4): 499-504.
[18] ROSSO V V D, MERCADANTE A Z. The high ascorbic acid content is the main cause of the low stability of anthocyanin extracts from acerola[J]. Food Chemistry, 2007, 103(3): 935-943.
[19] REYES L F, CISNEROS-ZEVALLOS L. Degradation kinetics and colour of anthocyanins in aqueous extracts of purple-and red-flesh potatoes (Solanum tuberosum L.)[J]. Food Chemistry, 2007, 100(3): 885-894.
