超高压和盐渍泡发处理海参的质构和功能成分比较研究
2013-08-07郝梦甄胡志和
郝梦甄,胡志和*
(天津市食品生物技术重点实验室,天津商业大学生物技术与食品科学学院,天津 300134)
海参(Stichopus japonicus)又名刺参、沙哩等,棘皮动物门,海参纲,是重要的海洋无脊椎动物,已有5000万年历史,种类有1200多种。我国海参主要分布在黄海、渤海海域和广东、广西及海南沿海,主要经济品种分别为刺参和梅花参,其中刺参是我国品质最好的海参种类之一[1]。研究已证明,海参体壁中含有海参多糖、海参皂苷、海参胶原蛋白、海参脑苷酯、神经节苷酯等多种生物活性物质[2],具有提高免疫功能、抗肿瘤、抗凝血、抗血栓、降血脂、抗衰老等多种生理功效[3-5]。目前海参的传统加工方法主要是将鲜海参制作成干参或盐渍参[6],大量的活性成分在加工过程中遭到破坏,变性和流失,还会产生不利于吸收和健康的毒素[7]。
超高压技术(ultra high-pressure,UHP)是一种新型的非热杀菌技术,起源于化工领域,超高压食品处理最大的特点是可以在室温或较低的温度下杀灭微生物、钝化酶,从而避免了由于高温处理导致食品营养的破坏或流失,以及食品色泽和风味的改变[8-11]。
本实验在之前研究超高压灭活海参自溶酶的条件基础上探讨了鲜海参,超高压处理海参及传统盐渍海参经泡发后海参三者的功能成分和4℃冷藏期间质构的差异,并探讨了与烫漂海参和超高压烫漂海参质构特性的比较,为鲜海参的超高压加工提供理论依据。
1 材料与方法
1.1 材料与试剂
鲜海参及盐渍海参购于烟台钰参堂。
L-羟脯氨酸、半胱氨酸、木瓜蛋白酶、EDTA 美国Sigma公司;甲醇(色谱纯) 天津市科密欧化学试剂有限公司;PMP衍生试剂(称取PMP0.871g,溶于10mL无水甲醇);水为双蒸水;其他试剂均为分析纯。
1.2 仪器与设备
HPP.L3-600/0.6超高压生物处理机 天津市华泰森森生物工程技术有限公司;Sigma 3-18k离心机 美国Sigma公司;电热恒温水槽 上海精宏实验设备有限公司;TU-1810紫外-可见分光光度计 北京普析通用仪器有限责任公司;UDK159全自动凯式定氮仪测定 北京盈盛恒泰科技有限责任公司;P/ACE MDQ 型毛细管电泳仪 美国贝克曼库尔公司;SK5200H 超声波清洗机 上海科导超声仪器有限公司;熔融石英毛细管(未涂层) 河北永年锐沣色谱器件有限公司;SMSTA.XTPlus质构仪 北京微讯超技仪器有限公司。
1.3 方法
1.3.1 原料处理
鲜海参处理:用剪刀从海参腹部剪开,取出肠后用清水冲洗内壁,再用纯净水冲洗2~3遍。高压处理鲜海参处理:600MPa、45℃条件下处理35min。烫漂海参处理:80℃烫漂2min。超高压烫漂海参处理:80℃烫漂2min后,采用HPP.L3-600/0.6超高压生物处理机在600MPa、45℃条件下处理35min。
盐渍海参泡发处理:干海参洗净后放入洁净水中4℃泡发48h,每天换水1次。泡完后的海参用剪刀将体壁内的筋剪断后放入沸水中煮30~45min,煮完后自然放凉继续放入4℃冰箱中泡发24h。泡完后拿出放入沸水中煮20min,自然放凉放入4℃冰箱泡发24h后即可。
1.3.2 质构特性测定
将处理后样品分别切成2cm×2cm×2cm的小块,用SMSTA.XTPlus质构仪的P50探头进行质构特性的测试。测试参数:测试前速率2mm/s,测试速率1mm/s,测试后速率1mm/s,触发值5g,距离4mm。海参质构特性主要以硬度、弹性、黏聚性和咀嚼性为指标进行评价。各指标的检测及计算参考Bourne[12]定义的各质构特性参数的计算方法。
1.3.3 功能成分含量测定
总蛋白、胶原蛋白和粗多糖含量测定前将鲜海参及不同处理方法的海参冷冻干燥。
1.3.3.1 总蛋白含量测定
参照国标GB 5009.5—2010《食品中蛋白质的测定》中第一法——凯氏定氮法,取冷冻干燥后样品0.5g加入消化液浓硫酸10mL及硫酸铜和硫酸钾的混合片剂消化后,使用全自动凯式定氮仪测定,记录消耗标准盐酸的体积(mL)。按照公式(1)计算海参体壁蛋白含量。
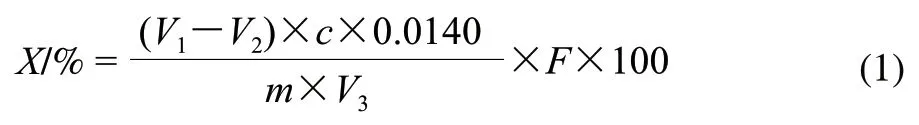
式中:X为试样中蛋白质的含量/%;V1为试液消耗盐酸标准滴定液的体积/mL;V2为试剂空白消耗盐酸标准滴定液的体积/mL;V3为吸取消化液浓硫酸的体积/mL;c为盐酸标准滴定液浓度/(mol/mL),实验为0.1108mol/mL;m为样品质量/g;F为氮换算为蛋白的系数,6.25。
1.3.3.2 胶原蛋白含量测定
胶原蛋白在氯化亚锡的盐酸溶液中水解,释放出羟脯氨酸,经氯胺T氧化,生成含有吡咯环的氧化物,然后用高氯酸破坏过量的氯胺T。羟脯氨酸氧化物与对二甲氨基苯甲醛反应生成红色的吡咯化合物,在波长560nm处测其吸光度,完成定量[13]。实验试剂的配制参照GB/T 9695.23—2008《肉与肉制品羟脯氨酸含量测定》。
标准曲线的绘制:分别吸取5μg/mL L-羟脯氨酸0、10、20、30、40、50、60、70、80mL于100mL容量瓶中,定容后分别取4mL于20mL具塞试管中,加入2mL氯胺T溶液,摇匀,静置20min后加入2mL显色剂,摇匀,60℃保温20min,冷却。560nm波长处测定绘制标准曲线,获得拟合方程为:y=4.523x-0.0961(R2=0.9963),式中,x为吸光度;y为L-羟脯氨酸质量浓度/(μg/mL)。
样品的消化:向100mL氯化亚锡溶液中加入1g样品,沸水浴回流6h,过滤至250mL容量瓶,用10mL 6mol/L盐酸冲洗沉淀,冷却,定容。吸取5~25mL水解液,调节pH值为8.0±0.2,过滤于250mL容量瓶中,用30mL水冲洗沉淀,定容。吸取样液4mL于20mL具塞试管中,按标准曲线步骤进行,同时作空白实验。按公式(2)[14]计算样品中胶原蛋白的含量。
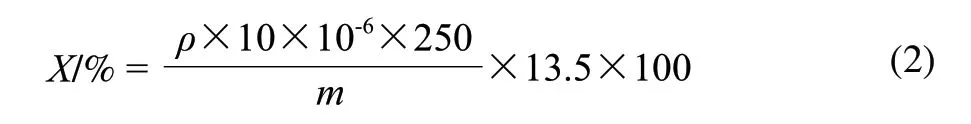
式中:X为样品(海参)中胶原蛋白的含量/%;ρ为从工作曲线中查得的测定液中羟脯氨酸的质量浓度/(μg/mL);m为称取样品的质量/g;250为干海参消化液的体积/mL;10为消化液稀释倍数;13.5为海参中胶原蛋白水解为羟脯氨酸的系数。
1.3.3.3 粗多糖的提取及含量测定
粗多糖的分离纯化[15-16]:样品于4℃丙酮中浸泡24h,烘干,向1g干物中加入30mL 0.1mol/L乙酸钾缓冲溶液、100mg木瓜蛋白酶、5mmol/L EDTA和5mmol/L半胱氨酸溶液,60℃水浴反应24h,离心去沉淀。上清液中加入2倍体积95%乙醇,4℃过夜,离心。沉淀用95%和无水乙醇洗涤,干燥后溶解,KOH溶液调pH值至9~10,加1/7体积30% H2O2,50℃反应4h,冷却,离心去沉淀。0℃条件下调pH2,离心去沉淀。加乙酸钾至浓度为1.5mol/L,4℃过夜,离心,沉淀用95%和无水乙醇洗涤,60℃干燥。
粗多糖纯度测定[17]:多糖纯度的测定采用苯酚-硫酸法测定提取的多糖中总多糖含量。原理:多糖在硫酸作用下,先水解成单糖,并迅速脱水生成糖醛衍生物,与苯酚反应显橙黄色,在490nm波长处有特征吸收。
标准曲线制作:标准葡萄糖20mg溶于水,定容至500mL,分别取该葡萄糖溶液0.4、0.6、0.8、1.0、1.2、1.4、1.6、1.8mL,加水至2mL,依次加入1mL 6%苯酚和5mL浓硫酸,混匀后静置20min显色,490nm波长处测定,获得拟合方程为:y=0.6855x+0.0138(R2=0.9956),式中,x为吸光度,y为葡萄糖质量浓度/(mg/mL)。按照公式(3)计算样品中多糖含量。

式中:ρ1为查标准曲线得葡萄糖质量浓度/(mg/mL);ρ2为粗糖溶液质量浓度/(mg/mL);C为鲜海参体壁提取出粗糖含量/%。
1.3.3.4 提取多糖的毛细管电泳
多糖的衍生化[18]:取海参多糖5mg放入安瓿瓶,加1.5mL 4mol/L的三氟乙酸(TFA),超声溶解,110℃水解6h后旋蒸至干,加少量无水甲醇,反复蒸干3次,加500μL水溶解。取水解液100μL,分别加入120μL 0.5mol/L PMP和100μL 0.3mol/L NaOH溶液,70℃水浴30min。冷却,加入100μL 0.3mol/L HCl溶液中和。然后加入500μL氯仿涡旋萃取,上层水相反复萃取3次,即得衍生化样品。吸取样品,0.45μm微孔滤膜滤过,进样,进行高效毛细管电泳(HPCE)分析。
电泳条件:毛细管为未涂层熔融石英管,总长度为60cm,有效长度(从进样端到检测器)51.5cm,内径50μm。采用压力自动进样,进样压力0.5psi,进样时间5s,温度25℃。运行电压为25kV。检测波长为214nm。每次进样前用6mol/L硼砂缓冲液冲洗毛细管3min。
2 结果与分析
2.1 不同海参冷藏期间质构特性变化
2.1.1 硬度变化
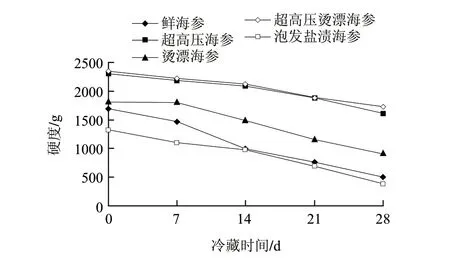
图 1 不同处理海参4℃冷藏期间硬度变化Fig.1 Change in hardness during cold storage of sea cucumber samples subjected to different treatments
硬度是表现海参肌肉软硬程度的一项重要性能指标,既可理解为是海参肉抵抗弹性变形、塑性变形或破坏的能力,也可表述为抵抗残余变形和反破坏的能力。由图1可知,超高压烫漂海参的初始硬度最大,这可能是由于胶原蛋白的热变性引起肌纤维收缩,进而增加肌肉的硬度,并且肌纤维的收缩程度由胶原间成熟而耐热的稳定性交联决定[19-20]。超高压海参的初始硬度比超高压烫漂海参小,这由于超高压处理对蛋白质结构的影响在一定程度上类似热处理等其他使蛋白质变性的加工方法,400MPa压力使海参蛋白质分子发生解聚[21],硬度下降。在后期冷藏期间超高压海参的硬度均比鲜海参的硬度高,这主要由于超高压杀灭了海参中微生物并抑制了海参中自溶酶的活性,前期研究发现在此超高压处理条件下海参中体壁粗酶酶活仅为处理前的19.28%,从而保持了其结构的稳定。在冷藏28d后超高压烫漂海参硬度1732.073g仍能保持很好的外观,而鲜海参从第7天已经开始发生明显自溶,到第28天时其硬度仅为505.123g,泡发盐渍海参硬度也仅为384.074g,这可能由于其中的微生物和自溶酶的共同作用导致,说明超高压烫漂能够延长鲜海参的冷藏时间。
2.1.2 弹性变化
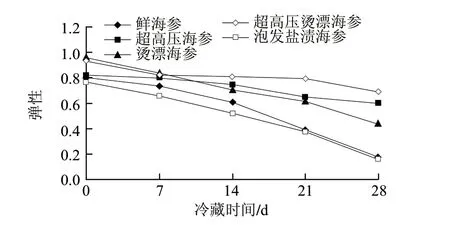
图 2 不同处理海参4℃冷藏期间弹性变化Fig.2 Change in springiness during cold storage of sea cucumber samples subjected to different treatments
弹性是反映海参受外力作用时变形后的恢复程度。肌肉弹性与肌肉间的结合力大小有关,肌肉间的结合力越大,即海参肉组织破坏程度越小,弹性越大。由图2可知,烫漂海参的弹性明显高于鲜海参,这是由于热加工使海参体积缩小,胶原纤维收缩使海参体内大量自由水排出,从而海参的组织结构更加紧致有弹性[22]。随着贮藏时间延长,由于海参体内微生物的作用以及内源酶的分解作用使胶原蛋白被降解,从而鲜海参、泡发盐渍海参及烫漂海参的弹性均明显下降,而超高压海参在贮藏第28天后弹性为0.598,超高压烫漂海参的弹性为0.689,避免了此变化的发生。
2.1.3 黏聚性变化
黏聚性是咀嚼海参肉时,海参肉抵抗受损并紧密连接使其保持完整的性质,同样反映样品内部黏合力。由图3可知,不同处理的海参在贮藏期间黏聚性的变化趋势与硬度及弹性的变化趋势一致,泡发盐渍海参的黏聚性最低且降低幅度最大,贮藏28d后其黏聚性降低了91.6%,这与其在加工过程中与质构有关的主要功能成分——胶原蛋白的流失有密切关系。同样,超高压海参和超高压烫漂海参的黏聚性在4℃冷藏期间降低幅度较小,在贮藏28d后黏聚性分别为0.304和0.344,仅比最初值分别降低了30.11%和33.97%。
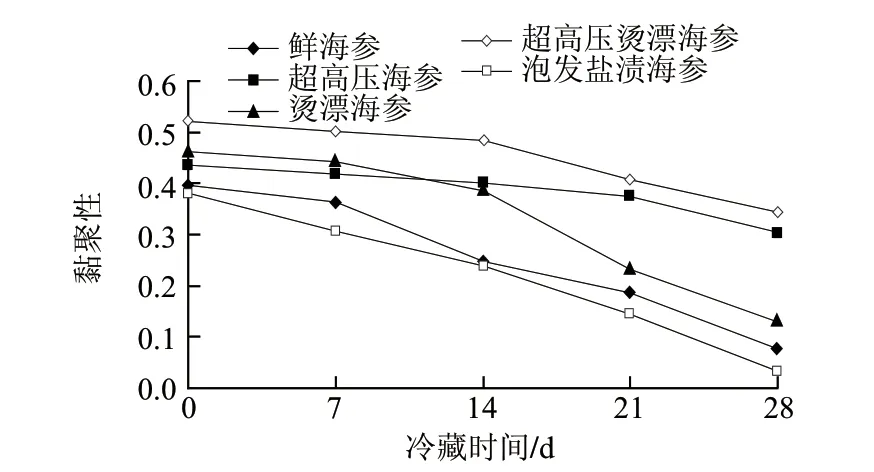
图 3 不同处理海参4℃冷藏期间黏聚性变化Fig.3 Change in cohesiveness during cold storage of sea cucumber samples subjected to different treatments
2.1.4 咀嚼度变化
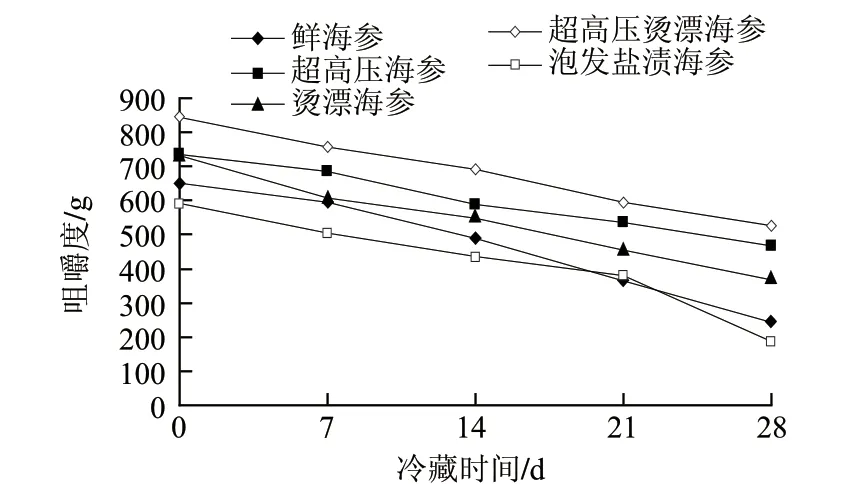
图 4 不同处理海参4℃冷藏期间咀嚼度变化Fig.4 Change in chewiness during cold storage of sea cucumber samples subjected to different treatments
咀嚼度是一项质地综合评价指标,摸拟海参肉样品咀嚼成吞咽时的稳定状态所需的能量,即所说的咬劲,是肌肉硬度、肌肉细胞间凝聚力、肌肉弹性等综合作用的结果。由图4可知,不同处理海参在4℃冷藏期间咀嚼度的变化趋势与硬度的变化趋势一致。超高压烫漂海参其咀嚼度明显高于其他处理方式的海参,这与超高压处理及适当热加工使海参胶原纤维的聚集有关,从而使其硬度增加,咀嚼度也随之增加。并且在贮藏期间这种特性被很好的保留,说明超高压烫漂处理能够改善海参的质构特征,延长其货架期。
因此,不同海参在4℃冷藏期间弹性,黏聚性和咀嚼度的变化规律与各自硬度的变化趋势一致,由于在海参冷藏过程中海参体壁内的水分不断渗出导致每种处理方式的硬度、弹性均有不同程度的下降。实验充分说明超高压烫漂处理能够延长鲜海参的冷藏。
2.2 不同海参功能成分含量的比较
由表1可知,总蛋白含量这与王哲平等[23]的研究成果接近,其他成分含量的差异与海参养殖区域及个体差异有关。经SPSS两两比较分析超高压处理的海参粗多糖含量与鲜海参中粗多糖含量差异不显著(P=0.182),超高压烫漂海参中胶原蛋白、海参多糖能够得到有效保留,含量分别为48.66%和1.25%,明显高于泡发盐渍海参中两者的含量。泡发盐渍海参粗多糖含量与鲜海参中粗多糖含量差异显著,说明超高压烫漂能够有效保留海参中提高免疫的功能成分海参多糖。

表 1 不同处理海参样品功能成分含量比较结果Table 1 Functional components of sea cucumber samples subjected to different treatments
2.3 不同海参多糖的毛细管电泳分析
2.3.1 最大吸收波长测定结果
由于提取的是海参中的粗多糖,因此对其衍生后产物的最大吸收波长进行测定,最大吸收波长扫描如图5所示。
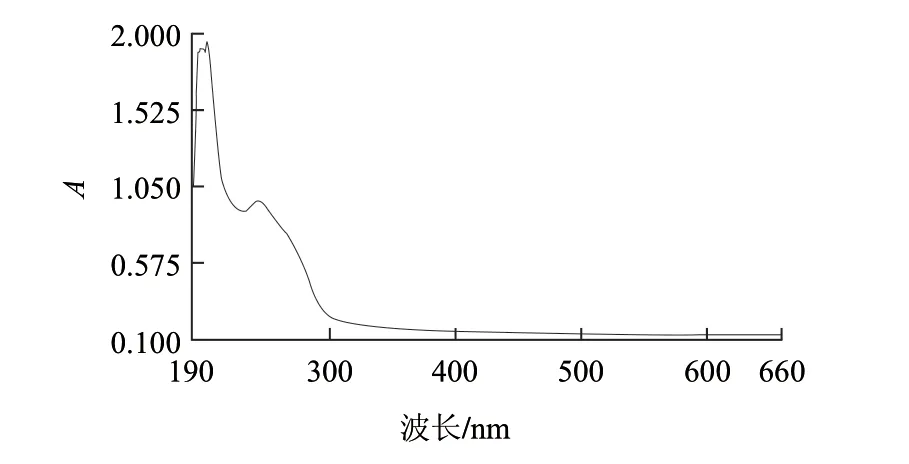
图 5 海参多糖最大吸收波长Fig.5 UV absorption spectrum of crude polysaccharides extracted from sea cucumber
由图5可知,扫描图中多糖吸收共出现4个峰值,分别为199、202、231、243nm,多糖对应的吸光度分别为1.91、1.95、0.89、0.96。毛细管电泳采用波长214nm,此波长与多糖的两个最大吸收波长202nm和199nm非常接近,因此结果可靠。
2.3.2 海参多糖毛细管电泳
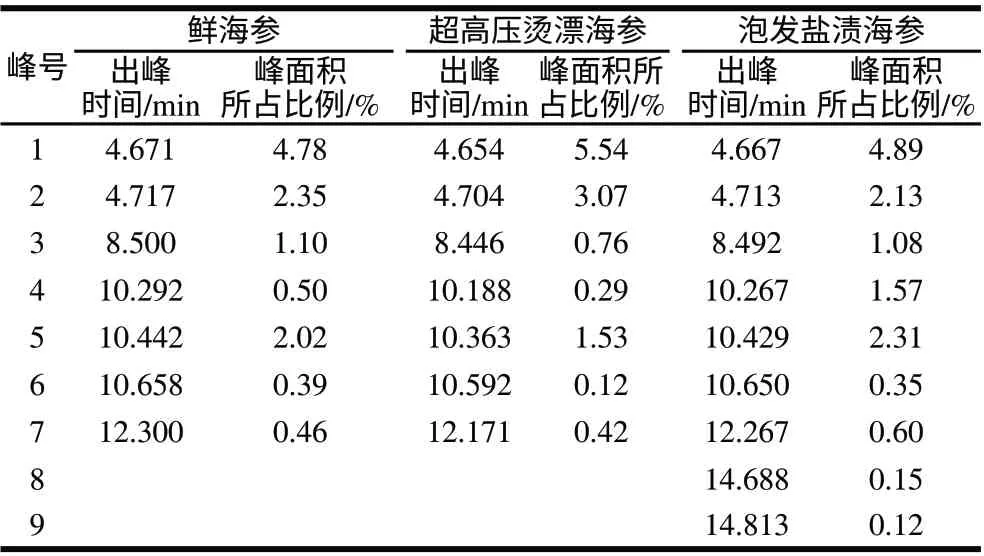
表 2 不同处理海参中单糖成分比较Table 2 Monosaccharide composition of sea cucumber samples subjected to different treatments
单糖成分含量可通过峰面积所占比例来表示,实验采用高效毛细管电泳仪自带分析软件32Karat7.0分析,3种海参多糖中主要单糖成分含量的比较结果如表2所示。海参多糖中两种主要单糖成分1和2的含量所占比例在超高压烫漂海参(5.54%)中明显高于鲜海参(4.78%)和泡发盐渍海参(4.89%)、鲜海参和超高压烫漂海参中主要单糖种类均为7种,然而泡发盐渍海参中单糖种类显示为9种,这可能由于盐渍海参工艺造成的或是其中的杂质成分。
3 结 论
超高压海参及超高压烫漂海参在质构特性明显优于鲜海参和泡发盐渍海参,并且在4℃冷藏时间超过28d,这与超高压能有效杀灭海参中微生物并且灭活海参自溶酶有关。然而鲜海参在7d后就有明显的自溶现象,质构特性已明显下降,泡发盐渍海参本身质构特性就比较差,在7d后同样会出现自溶现象。超高压烫漂海参的多糖含量与鲜海参没有差异,总蛋白和胶原蛋白含量及主要的单糖含量也明显高于泡发盐渍海参,说明超高压烫漂能有效保留海参中的功能成分,并且加工工艺简单,这为超高压技术在即食海参中的加工应用提供了参考。
[1] 李银塔, 李钰金, 陈英乡, 等. 即食鲜海参生产工艺研究[J]. 肉类研究, 2010, 24(6): 78-81.
[2] 宋迪, 吉爱国, 梁浩, 等. 刺参生物活性物质的研究进展[J]. 中国生化药物杂志, 2006, 27(5): 316-319.
[3] 谢永玲, 张明月, 张静, 等. 海参肽对小鼠的免疫调节作用[J]. 中国海洋药物杂志, 2009, 28(4): 43-45.
[4] 高森, 王静凤, 王玉明, 等. 冰岛刺参调节血脂及其作用机制[J]. 武汉大学学报: 理学版, 2009, 55(3): 324-328.
[5] 逄龙, 王静凤, 王玉明, 等. 北极刺参多糖、皂苷和胶原蛋白多肽对血管内皮细胞的保护作用[J]. 中国药科大学学报, 2007, 38(5): 437-441.
[6] 段续, 王辉, 任广跃, 等. 海参的干制技术及其研究进展[J]. 食品工业科技, 2012, 33(10): 427-431.
[7] SPILIMBERGO S, ELVASSORE N, BERTUCCO A. Microbial inactivation by high pressure[J]. Journal of Supercritical Fluids, 2002, 22: 55-63.
[8] KURAL A G, CHEN Haiqiang. Conditions for a 5-log reduction of Vibrio vulnificus in oysters through high hydrostatic pressure treatment[J]. International Journal of Food Microbiology, 2008, 122: 180-187.
[9] 胡飞华. 梅鱼鱼糜超高压凝胶化工艺及凝胶机理的研究[D]. 杭州: 浙江工商大学, 2010.
[10] 王瑞, 乔长晟, 贾鹏, 等. 生鲜毛蚶超高压杀菌工艺的研究[J]. 食品工业科技, 2007(1): 156-158.
[11] 张蕾, 陆海霞, 励建荣. 超高压处理对凡纳滨对虾品质的影响[J]. 食品研究与开发, 2010, 31(12): 1-6.
[12] BOURNE M C. Food texture and viscosity[M]. New York: Academic Press, 2002.
[13] 毕琳. 刺参(Stichopus japonicus)体壁胶原蛋白理化性质和生物活性研究[D]. 青岛: 中国海洋大学, 2006.
[14] SAITO M, KUNISAKI N, URANO N, et al. Collagen as the major edible component of sea cucumber (Stichopus japonicus)[J]. Food Chemistry and Toxicology, 2002, 67(4): 1319-1322.
[15] ALBANO R M, MOURAO P A S. Isolation, fractionation and preliminary characterization of a novel class of sulfated glycans from the tunic of Styela plicata(Chordata tunicata)[J]. Biol Chem, 1986, 261(2): 758-765.
[16] MOURAO P A S, BASTOS I G. Highly acidic glycans from sea cucumbers: isolation and fractionation of fucose-rich sulfated polysaccharides from the body wall of Ludwigothurea grisea[J]. Eur J Biochem, 1987, 166(3): 639-645.
[17] 张惟杰. 糖复合物生化研究技术[M]. 2版. 杭州: 浙江大学出版社, 1999: 11-12.
[18] 王金霞, 赵峡, 于广利, 等.柱前衍生高效液相色谱法分析海洋褐藻多糖药物的糖醛酸组成[J]. 分析化学, 2009, 37(5): 648-652.
[19] BURKE R M, MONAHAN F J. The tenderisation of shin beef using a citrus juice marinade[J]. Meat Science, 2003, 63(2): 161-168.
[20] AKTAS N, KAYA M. Influence of weak organic acids and salts on the denaturation characteristics of intramuscular connective tissue: a differential scanning calorimetry study[J]. Meat Science, 2001, 58(4): 413-419.
[21] 夏远景. 超高压食品处理工艺基础研究[D]. 大连: 大连理工大学, 2012.
[22] 董秀萍. 海参、扇贝和牡蛎的加工特性及其抗氧化活性肽的研究[D]. 镇江: 江苏大学, 2010.
[23] 王哲平, 刘淇, 曹荣, 等. 野生与养殖刺参营养成分的比较分析[J]. 南方水产科学, 2012, 8(2): 64-70.
