莲房黄酮微波辅助提取工艺优化及其抗氧化性能
2013-12-06陈红梅
陈红梅,谢 翎,2
(1.安庆师范学院生命科学学院,安徽安庆 246011;2.安徽农业大学微生物防治省重点实验室,安徽合肥230036)
莲(Nelumbium nuciferum)为睡莲科多年生草本植物,因具有可口的风味和较高的营养价值,深受人们喜爱,在我国广泛种植。莲有多个部位可以入药,包括荷花、荷叶、莲子、莲房、藕等,且药用价值不同[1-2]。莲房是莲的干燥成熟花托,又名莲蓬壳(lotus seed pod,LS),体轻,质疏松,味苦涩,归肝经,具有消瘀、止血、袪湿等功效[3]。经研究发现,莲房中富含多种化学成分,其中包括槲皮素、金丝桃苷、槲皮素-3-二葡萄糖苷等黄酮类化合物[4]。黄酮类化合物具有抗氧化、抗肿瘤、抗辐射、降血脂等作用[5],已被广泛应用于食品、卫生及化妆品行业中。目前对莲房多酚类物质研究较多,而对黄酮类化合物的研究却很少。莲房作为莲的非可食部分,一般采摘于立夏后,除少数被民间作为食物香料使用外,大部分均作为废弃物而被直接丢弃,不仅造成了极大的浪费,莲房较大的体积堆积在一起也对环境造成了严重的污染。提取黄酮类化合物最常用的方法有有机溶剂提取法、超声波辅助提取法和微波辅助提取法等,而用微波辅助提取莲房黄酮的文章几乎未见报道。本研究采用微波辅助提取法对莲房黄酮进行提取,并结合单因素实验和正交实验筛选出最佳的工艺条件。同时通过对莲房黄酮提取物的还原力、DPPH自由基清除率及羟基自由基清除率的测定,对莲房黄酮提取物抗氧化活性进行测定[6],以期为莲房的综合利用提供理论依据,也为天然抗氧化剂的开发提供新的资源。
1 材料与方法
1.1 材料与仪器
莲房 购于农贸市场;芦丁标准品 上海生化制品厂;1,1-二苯基苦基苯肼(DPPH) Sigma公司;硝酸铝、亚硝酸钠、无水乙醇、氢氧化钠、铁氰化钾、三氯化铁 均为分析纯。
UV-2000型紫外-可见分光光度计 上海尤尼柯公司;FA2004A型电子天平 上海精天电子仪器有限公司;HH-6型数显恒温水浴锅 常州国华电器有限公司;RE-52A型旋转蒸发仪 上海亚荣生化仪器厂;FW-100型高速粉碎机 上海楚定分析仪器有限公司。
1.2 实验方法
1.2.1 标准曲线的制作 准确称取芦丁标准品20mg,置于50mL容量瓶中,用70%乙醇溶解并定容,得到质量浓度为0.4mg/mL的标准溶液。精密吸取0、1.0、2.0、3.0、4.0、5.0mL标准溶液置于25mL容量瓶中,用70%乙醇补充至10mL,各加入5%的NaNO2溶液2mL,混匀,放置6min,再加入10%Al(NO3)3溶液2mL,混匀,放置6min,再各加入4%的NaOH溶液2mL,用70%乙醇定容至刻度,混匀,放置15min,在波长510nm处测定吸光度。以芦丁标准溶液的质量浓度(C:mg/mL)为横坐标,吸光度(A)为纵坐标,得到回归方程:A=0.2845C-0.2811,R2=0.9995。
1.2.2 莲房黄酮提取工艺及含量测定 准确称取莲房粉末5.0g放入磨口三角烧瓶中,加入一定体积一定浓度的乙醇溶液,在一定温度下回流提取一定时间,过滤,滤渣用石油醚脱色2次后再次过滤,所得滤渣用70%乙醇溶解并定容至50mL,作为待测液,按1.2.1进行操作,测定黄酮含量。
1.2.3 单因素实验 称取一定量的莲房粉末,以黄酮得率为考察指标,分别研究不同乙醇浓度、料液比、提取时间和微波功率对莲房黄酮得率的影响。
1.2.3.1 乙醇浓度对浸提效果的影响 称取烘干至恒重的莲房粉末5.0g,按料液比1∶10的比例分别加入质量分数为40%、50%、60%、70%、80%、90%的乙醇溶液,在微波功率200W的条件下,提取80s,研究不同乙醇浓度对莲房黄酮得率的影响。
1.2.3.2 料液比对浸提效果的影响 称取烘干至恒重的莲房粉末5.0g,分别按料液比1∶5、1∶10、1∶15、1∶20、1∶25的比例加入质量分数为70%的乙醇溶液,在微波功率200W的条件下,提取80s,研究不同料液比对莲房黄酮得率的影响。
1.2.3.3 提取时间对浸提效果的影响 称取烘干至恒重的莲房粉末5.0g,按料液比1∶15的比例加入质量分数为70%的乙醇溶液,在微波功率200W的条件下,分别提取20、40、60、80、100、120、140s,研究不同提取时间对莲房黄酮得率的影响。
1.2.3.4 微波功率对浸提效果的影响 称取烘干至恒重的莲房粉末5.0g,按料液比1∶15的比例加入质量分数为70%的乙醇溶液,分别在微波功率100、200、300、400、500、600W的条件下,提取100s,研究不同微波功率对莲房黄酮得率的影响。
1.2.4 正交实验设计 在单因素实验的基础上,选择乙醇浓度、料液比、提取时间和提取温度四个因素,以莲房黄酮得率为指标,进行L9(34)正交实验,因素水平见表1。
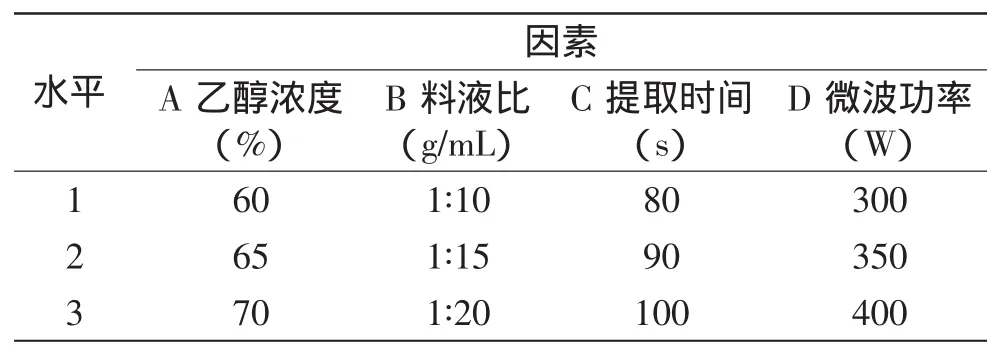
表1L9(34)正交实验因素水平表Table 1Factors and levels of L9(34)orthogonal design
1.2.5 莲房黄酮提取物抗氧化性能测定
1.2.5.1 还原力的测定[7-8]分别配制0.05、0.1、0.2、0.3、0.4mg/mL质量浓度的样品溶液,取1.0mL样品溶液置于试管中,再加入pH6.6的磷酸盐缓冲溶液1.5mL和1%铁氰化钾溶液1.5mL,充分混匀,置于50℃恒温水浴锅中保温30min,冷却后加入三氯乙酸1mL,充分振荡后,于4500r/min下离心10min。取上清液1mL加入1mL 0.1%FeCl3溶液和2mL蒸馏水混匀,静置10min,在波长700nm处测定其吸光度值,以蒸馏水为空白。吸光度值越大,样品的还原力越强。另以VC作阳性对照。
1.2.5.2 DPPH自由基清除率[9-10]的测定 分别配制0.05、0.1、0.2、0.3、0.4mg/mL质量浓度的样品溶液,取0.3mL样品溶液同2.7mL 0.1mmol/L的DPPH甲醇溶液充分混匀,在室温下反应2h后在517nm波长处测定吸光度值,未加入样品的DPPH甲醇溶液为空白。同时,以VC和BHT作阳性对照。样液对DPPH自由基的清除率按式(1)计算。
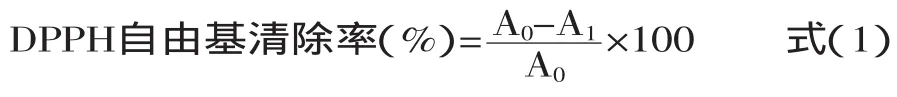
式中:A0为空白吸光度值;A1为样品溶液吸光度值。
1.2.5.3 羟基自由基(·OH)清除率[11-12]的测定 分别配制0.05、0.1、0.2、0.3、0.4mg/mL质量浓度的样品溶液,吸取1.0mL置于试管中,加入1.0mL 5mmol/L的水杨酸溶液和1.0mL 5mmol/L的FeSO4溶液,再加入2.0mL蒸馏水,充分混匀后加入1.0mL 5mmol/L的H2O2,在37℃水浴中恒温反应30min后,于510nm处测定其吸光度值,以蒸馏水作空白,同时以VC作阳性对照。样液对羟基自由基(·OH)的清除率按式(2)计算。
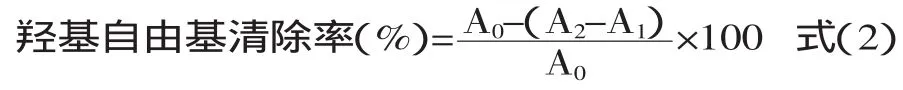
式中:A0为空白吸光度值;A2为加入黄酮溶液后的吸光度值;A1为不加H2O2的黄酮溶液吸光度值。
2 结果与讨论
2.1 单因素实验
2.1.1 乙醇浓度对莲房黄酮得率的影响 结果见图1,由图1可以看出,随着乙醇浓度的增加,莲房黄酮得率也在增加。在乙醇浓度为70%时,黄酮得率达到最大。进一步增加乙醇浓度,黄酮得率反而下降。这主要是因为,随着乙醇浓度的增加,也增加了一些脂溶性物质的溶出度,影响了莲房黄酮得率。所以,选择质量分数为70%的乙醇溶液作为提取溶剂。
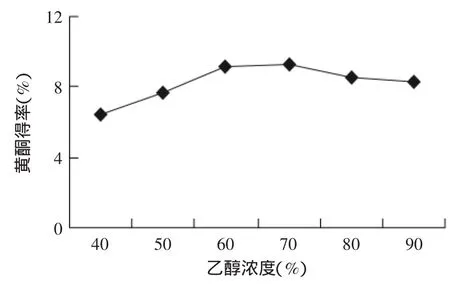
图1 乙醇浓度对黄酮得率的影响Fig.1 Effect of ethanol concentration on flavonoid yield
2.1.2 料液比对莲房黄酮得率的影响 结果见图2,由图2可以看出,随着料液比的减小,莲房黄酮得率也在逐渐增加,但当料液比达到1∶20时,继续减小料液比,莲房黄酮得率增加缓慢。考虑到成本和后续操作,选择料液比为1∶15比较合适。
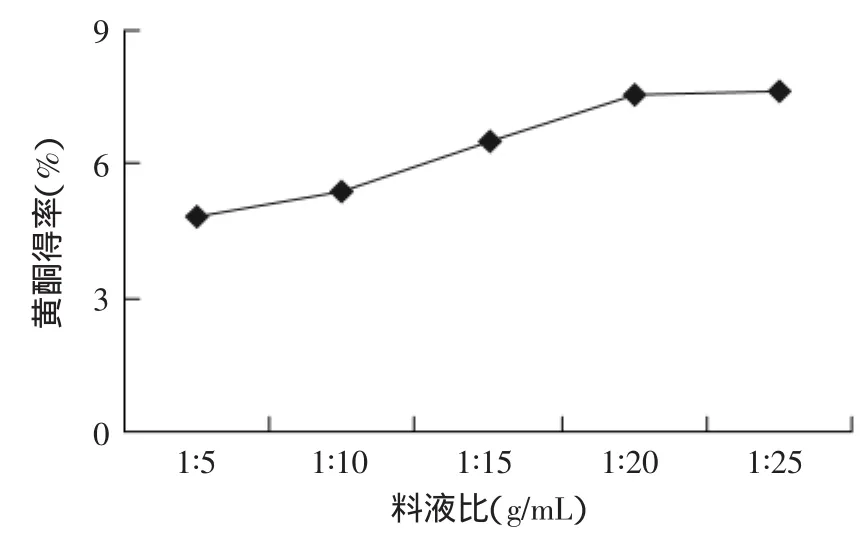
图2 料液比对黄酮得率的影响Fig.2 Effect of material-solvent ratio on flavonoid yield
2.1.3 提取时间对莲房黄酮得率的影响 结果见图3,由图3可以看出,提取时间在由20s上升到80s这段区间,莲房黄酮得率上升也比较快;提取时间进一步升高后,黄酮得率也在增加,但增加的速率很缓慢,达到120s时,黄酮得率几乎不再增加,这主要是因为提取时间达到一定值后,莲房黄酮提取物已基本全部溶出,因此选择提取时间为100s。
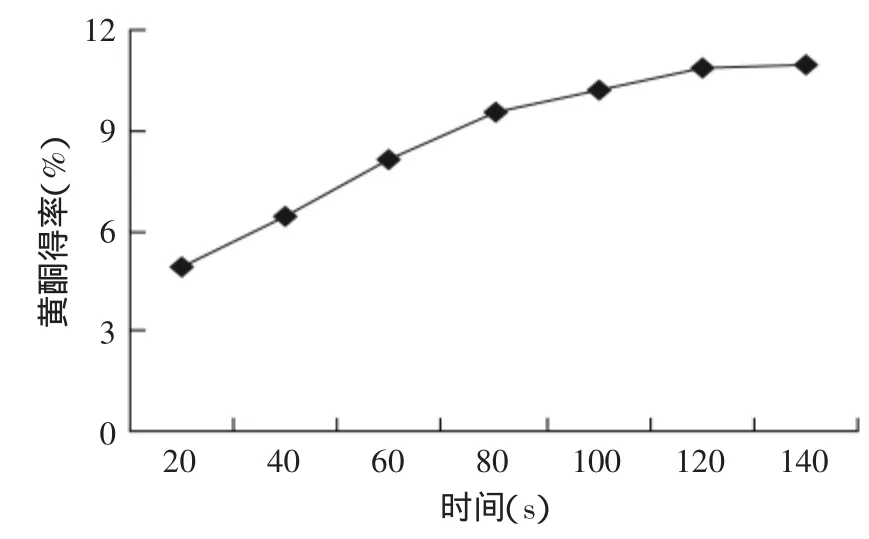
图3 提取时间对黄酮得率的影响Fig.3 Effect of extraction time on flavonoid yield
2.1.4 微波功率对莲房黄酮得率的影响 结果见图4,由图4可以看出,当微波功率逐渐升高时,黄酮得率也呈增加趋势;当微波功率达到400W后再增加功率,黄酮得率呈缓慢下降趋势。这主要是因为,随着微波功率的升高,使得温度也升高,黄酮分子运动加速,能较快的从细胞转移至溶液中;但如果微波功率过高,也使得杂质的溶出量增多,影响黄酮的得率。
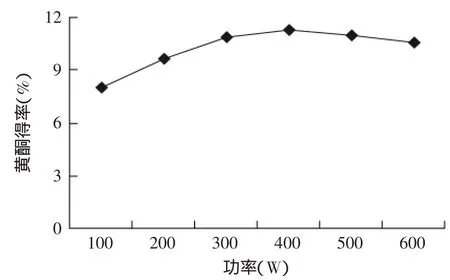
图4 微波功率对黄酮得率的影响Fig.4 Effect of microwave power on flavonoid yield
2.2 正交实验结果
为综合考虑各因素相互作用对莲房黄酮得率的影响,在单因素实验的基础上进行四因素三水平的正交实验,结果如表2所示。由极差分析表明,RA>RD>RC>RB,即对莲房黄酮得率影响的主次顺序依次为:乙醇浓度>微波功率>提取时间>料液比。表3方差分析结果,FB<FC<FD<FA<F0.05=4.460,表明各因素对莲房黄酮得率的影响均不显著。最佳提取工艺条件为A3B2C3D2,即乙醇浓度为70%,料液比为1∶15,提取时间为100s,微波功率为350W,在此条件下,经平行实验验证(n=5),莲房黄酮得率为11.42%。

表2 正交实验设计与结果Table 2 Design and results of orthogonal experiment
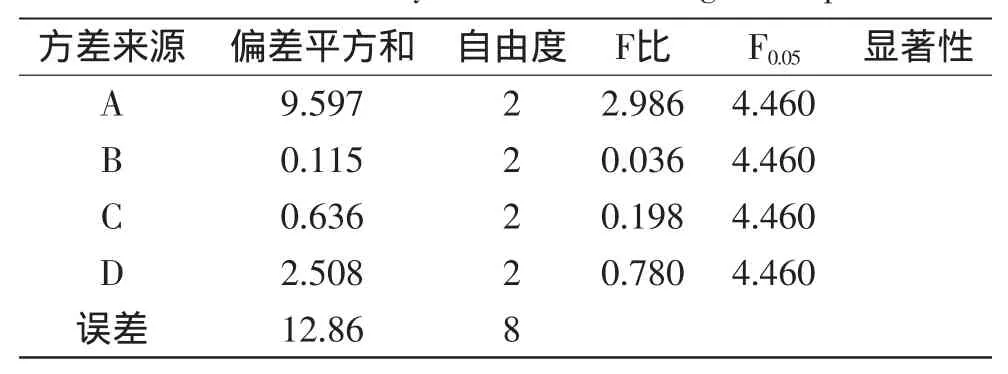
表3 正交实验方差分析结果Table 3 Variance analysis results of orthogonal experiment
2.3 莲房黄酮提取物抗氧化性能研究
2.3.1 莲房黄酮提取物的还原力 反应体系中,吸光度值的变化能反映出样品还原力的高低,吸光度值越大表明样品的还原力越强[13]。由图5可知,随着莲房黄酮提取物质量溶液的升高,它的还原力也在不断增强,并且随着浓度越来越高,还原力增加的趋势也在加大。当莲房黄酮提取液质量浓度为0.3mg/mL时,它的还原力与VC的还原力相当。整体来说,莲房黄酮提取液的还原力不如VC的还原力。
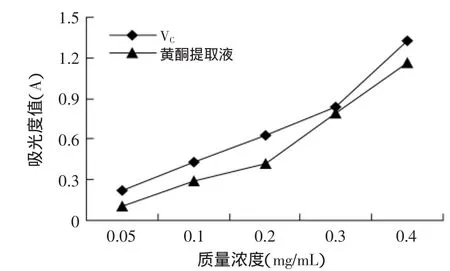
图5 莲房黄酮提取液的还原力Fig.5 Total reduction of flavonoid
2.3.2 莲房黄酮提取物对DPPH自由基的清除率 由图6可知,莲房黄酮提取液质量浓度由0.05mg/mL增加至0.3mg/mL时,它对DPPH·的清除率增加也较快;随着浓度的进一步升高,对DPPH·的清除率也在增大,但此时增长速率较慢。对照品VC和BHT对DPPH·的清除率也均随着质量浓度的增加而增大。黄酮提取液对DPPH·的清除率与VC相比,不如VC对DPPH·的清除效果明显。与BHT相比,当黄酮提取液质量浓度比较小时,对DPPH·的清除率不如BHT;但当黄酮提取液质量浓度达到0.3mg/mL后,它对DPPH·的清除率与BHT对DPPH·的清除率相当。

图6 莲房黄酮提取液对DPPH自由基的清除作用Fig.6 Scavenging activity of flavonoid on the DPPH free radical
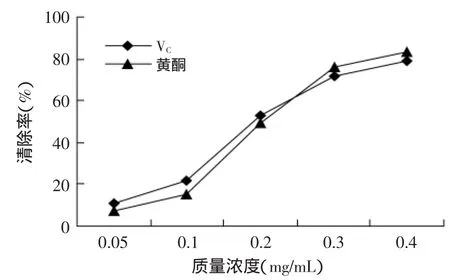
图7 莲房黄酮提取液对羟基自由基的清除作用Fig.7 Scavenging activity of flavonoid on the hydroxyl free radical
2.3.3 莲房黄酮提取物对羟基自由基清除率 由图7可以看出,莲房黄酮提取液具有一定的清除羟基自由基的作用,随着黄酮提取液质量浓度的增加,对羟基自由基的清除率也在增强。对照品VC对羟基自由基的清除率也随着其质量浓度的增加而升高,在质量浓度较低时,莲房黄酮提取液清除羟基自由基的效果不如VC,但当质量浓度达到0.3mg/mL时,发现莲房黄酮提取液对羟基自由基的清除能力大于VC的清除能力。
3 结论
研究了微波辅助提取莲房黄酮的工艺,结果表明影响莲房黄酮得率的主要因素是乙醇浓度,其次是微波功率和提取时间,料液比的影响最小。经正交实验优化后的工艺参数为:乙醇浓度为70%,料液比为1∶15,提取时间为100s,微波功率为350W,在此条件下,莲房黄酮得率为11.42%。微波辅助提取法可以通过高能作用促进目的物从溶质中的溶出,具有高效、操作简单、用时短、产率高、杂物少等特点,有利于莲房黄酮的提取,可以成为提取莲房黄酮的首选方法之一。
样品抗氧化性能评价方法有很多种,还原力与抗氧化能力存在密切的关系,还原力越强,表现出的抗氧化能力也就越强[14-15]。DPPH自由基因为操作简便、快速,广泛应用于抗氧化活性评价。羟基自由基在生物体内对机体的危害很大,是较强的氧化剂。抗氧化实验表明,莲房黄酮提取物具有较强的还原力,还原力随着黄酮提取物质量浓度的增加而增强。莲房黄酮提取物对DPPH自由基和羟基自由基均有一定的清除率,但清除效果不一样。莲房黄酮提取物对DPPH自由基的清除能力不如同质量浓度的BHT和VC,但莲房黄酮提取物对羟基自由基的清除能力与同质量浓度的VC相当,甚至在质量浓度较高时,超过VC。这可能是因为莲房黄酮提取物对不同的自由基表现的敏感性不同。总的来说,莲房黄酮提取物具有较强的抗氧化活性,可以作为天然氧化剂的潜在来源。
[1]SRIDHAR KR,BHAT R.Lotus:a potential nutracoutical source[J].Journal of Agricultural Technology,2007,3(1):143-155.
[2]MUKHERJEE PK,DAS J,SAHA K,et al.Diuretic activity of extract of therhizomes of Nelumbo nucifera Gaertn[J].Phytotherapy Research,1996(10):424-425.
[3]国家药典委员会.中华人民共和国药典:一部[M].北京:中国医药科技出版社,2010:257.
[4]国家中医药管理局.中华本草[M].第八卷.上海:上海科学技术出版社,1999:405,333.
[5]STANISLAW Burda,WIESLAW Oleszek.Antioxident and antiradical activities of flavonoids[J].Journal of Agricultural and Food Chemistry,2001,49(6):2774-2779.
[6]MAYACHIEW P,DEVAHASTIN S.Antimicrobial and antioxidant activities of Indian gooseberry and galangal extracts[J].LWT-Food Science and Technology,2008,41(7):1153-1159.
[7]APATI P,SZENTMIHALYI K,KRISTO S T,et al.Herbal remedies of Solidago-correlation of phytochemical characteristics and antioxidantproperties[J].JournalofPharmaceutical&Biomedical Analysis,2003,32(4):1045-1053.
[8]吕英华,苏平,那宇,等.桑椹色素体外抗氧化能力研究[J].浙江大学学报,2007,33(1):102-107.
[9]朱艳华,谭军.玉米多肽抗氧化作用的研究[J].中国粮油学报,2008,23(1):36-43.
[10]HATANO T,KAGAWA H,YASUHARA T,et al.Two new flavonoids and other constituents in licorice root:their relative astringency and scavenging effects[J].Chemical and Pharmaceutical Bulletin,1988,36(6):2090-2097.
[11]莫开菊,柳对,程超.生姜黄酮的抗氧化活性研究[J].食品科学,2006,27(9):110-115.
[12]刘玉芬,夏海涛.响应面法优化碱蒿黄酮提取工艺及其体外抗氧化作用[J].食品科学,2012,33(12):63-68.
[13]LIU J,WANG C N,WANG Z Z,et al.The antioxidant and free-radical scavenging activities of extract and fractions from corn silk(Zea mays L.) and related flavone glycosides[J].Food Chemistry,2011,126(1):261-269.
[14]SUN L J, ZHANG J B, LU X Y, et al.Evaluation to the antioxidant activity of total flavonoids extract from persimmon(Diospyros kaki L.) leaves[J].Food and Chemical Toxicology,2011,49(10):2689-2696.
[15]BERTONCELJJ,DOBERSEK U,JAMNIK M,et al.Evaluation of the phenolic content,antioxidant activity and colour of Slovenian honey[J].Food Chemistry,2007,105(2):822-828.
