小黑豆乳清蛋白和水解多肽对小鼠急性肝损伤的保护作用
2013-08-07王常青于书佳连伟帅
樊 迎,王常青*,王 菲,于书佳,连伟帅,原 敏
(山西大学生命科学学院,山西 太原 030006)
黑豆(Glycine soja Sieb.et Zucc)异名乌豆、冬豆子,系豆科植物大豆的干燥种子,按其颗粒大小可分为大黑豆和小黑豆两种,小黑豆的主要产区在山西、陕西、宁夏等省份及黄土高原地区[1]。其蛋白质含量高达48%以上,居豆类之首。小黑豆乳清蛋白(small black beans whey protein,SBWP)存在于加工黑豆分离蛋白和豆制品过程中排放的废水中,初步估算,每生产1t的分离蛋白会排放20~30m3的乳清废水。近年来已有关于大豆乳清蛋白抗肿瘤和大豆多肽抗疲劳和保肝的报道[2-3],但是尚未见到SBWP以及小黑豆乳清水解多肽(small black beans whey peptides,SBWPE)抗肝损伤作用的研究。分析表明,本实验所用的SBWP和SBWPE的氨基酸组成基本符合联合国粮农组织/世界卫生组织(FAO/WHO)颁布的人体氨基酸需求模式[4]。因此,研究小黑豆乳清蛋白和水解多肽的保健功能,不但对减少废水排放和环境保护有实际意义,而且可以为小黑豆药物和功能食品的开发提供依据。
化学性肝损伤是由摄入的化学毒物或药物在体内代谢或转化所导致的肝脏慢性或急性损伤,据国内多家医院统计数据,每年因肝损伤住院的患者占急性肝炎患者的10%,且呈逐年上升趋势[5],因而天然提取物开发保肝食品和药品已成为研究的热点。本实验以CCl4诱导的小鼠急性肝损伤模型为对象,研究探讨SBWP和SBWPE对急性肝损伤的保护作用,为小黑豆乳清的开发提供参考。
1 材料与方法
1.1 材料与试剂
实验所用7周龄的昆明种雄性小鼠(SPF级,体质量22~25g),由山西医科大学动物中心提供。
本研究所用SBWP由本实验室用碱溶酸沉法提取[6];经检测,该蛋白的干燥物中粗蛋白含量为47.3%;SBWPE采用537酸性蛋白酶水解SBWP得到,其中分子质量在3000u左右的多肽占总肽的85%。
谷草转氨酶(AST)、谷丙转氨酶(ALT)、丙二醛(MDA)和甘油三酯(TG)试剂盒 南京建成生物工程研究所。
1.2 仪器与设备
TGL-16G型台式离心机 上海安亭科学仪器厂;TG16A-WS台式高速离心机 湖南赛特湘仪离心机仪器有限公司;MR1822高速冷冻离心机 法国Jouan公司;Lecia RM2255轮转式切片机 德国Leica仪器公司;体视显微镜 上海光学仪器厂;显微电子摄像机 杭州科艺科技公司;Spectramax M5酶标仪 天津泰科嘉华金属贸易有限公司;Olympus BX51显微照相仪 日本奥林巴斯公司。
1.3 方法
1.3.1 动物饲养与模型建立
实验小鼠经适应性喂养后,随机分为基础组、模型组及SBWP高、低剂量组和SBWPE高、低剂量组6组。基础组和模型组喂食基础饲料,其配方为:面粉与麸皮各10%、玉米面34%、高粱面14.5%、豆饼粉20%、植物油1.5%、鱼粉5%、骨粉2%、食盐、干酵母、鱼油乳液各1%,VB2加入量为60mg/kg饲料;SBWP与SBWPE高、低剂量组的饲料是在基础饲料中分别按36g/kg饲料和12g/kg饲料的量加入相应受试物,每只动物的日投食量均为5g,若动物体质量以30g/只计算,则相当于日摄入SBWP与SBWPE 0.18g和0.06g,实验期为30d。各组动物自由饮水,于实验第30天,各组动物称质量后禁食16h,模型组和各剂量组动物灌胃5mL/kg的1% CCl4溶液,基础组灌胃等量的生理盐水;24h后处死动物,测定各项生化指标并进行肝脏组织学与形态学观察。
1.3.2 血清与肝脏中生化指标测定方法
实验结束后,动物摘眼球取血,冷冻离心分离血清,按照试剂盒的要求测定血清AST和ALT的活力单位数;之后颈椎脱臼处死小鼠,解剖、称取一定质量的肝脏,用4℃的生理盐水洗去污血和杂物,加入肝脏质量10倍体积的生理盐水,在冰浴中充分研磨成细浆,再以3000r/min离心取上清液,按照试剂盒的方法测定肝匀浆中MDA含量和TG含量;用Folin-酚法测定肝蛋白含量[7];用5,5-二硫代双(2-硝基苯甲酸)(TDNB)法测定肝脏GSH含量[8]。
1.3.3 肝脏形态学和组织学观察与分析
取新鲜肝脏,在体视显微镜下观察形态变化,并用100倍电子摄像机摄像。取小鼠肝左叶相同部位组织,经10%福尔马林固定、石蜡包埋及二甲苯透明后切片,经HE染色,光镜下观测肝细胞的结构。
1.4 统计分析
实验数据使用SPSS18.0软件处理,组间差异采用t检验。
2 结果与分析
2.1 实验过程中各组动物的体质量变化
表 1 实验动物的体质量变化及动态分析(±s,n=10)Table 1 Body weight change and dynamic analysis of experimental mice (±s,n=10)
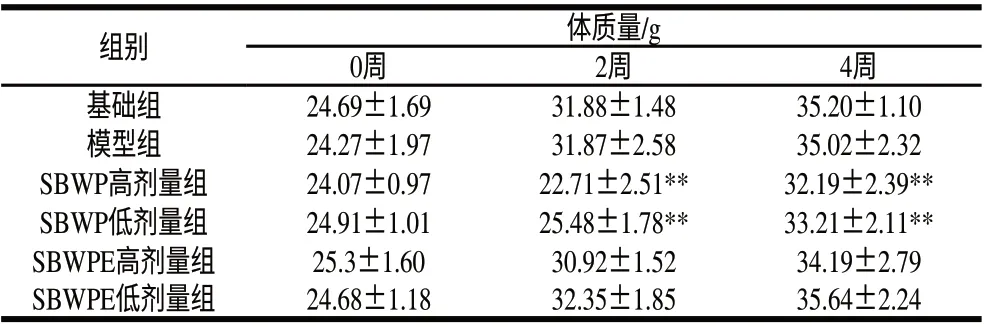
表 1 实验动物的体质量变化及动态分析(±s,n=10)Table 1 Body weight change and dynamic analysis of experimental mice (±s,n=10)
注: *.与基础组比较,差异显著(P <0.05);**.与基础组比较,差异极显著(P <0.01)。
组别 体质量/g 0周2周4周基础组24.69±1.6931.88±1.4835.20±1.10模型组24.27±1.9731.87±2.5835.02±2.32 SBWP高剂量组24.07±0.9722.71±2.51**32.19±2.39**SBWP低剂量组24.91±1.0125.48±1.78**33.21±2.11**SBWPE高剂量组25.3±1.6030.92±1.5234.19±2.79 SBWPE低剂量组24.68±1.1832.35±1.8535.64±2.24
由表1可见,实验开始时各组动物体质量基本相同;实验第2~4周,SBWP高、低剂量组小鼠与同期基础组和模型组比,体质量偏低,且差异极显著(P<0.01),SBWPE组无体质量减轻现象。可能是因为乳清蛋白中的胰蛋白酶抑制剂降低了动物对蛋白质的消化和吸收利用所导致[9]。
2.2 SBWP和SBWPE对血清ALT、AST活力的影响
表 2 SBWP与SBWPE对CCl4肝损伤小鼠血清ALT、AST活力单位数的影响(±s,n=10)Table 2 Effects of SBWP and SBWPE on ALT and AST activities in CCl4-induced liver injury in mice (±s,n=10)
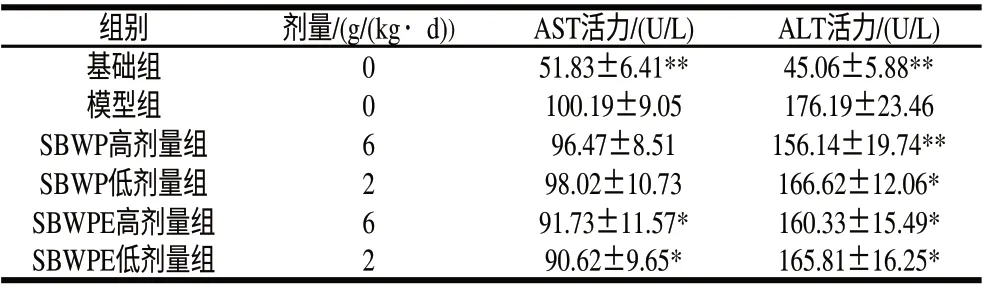
表 2 SBWP与SBWPE对CCl4肝损伤小鼠血清ALT、AST活力单位数的影响(±s,n=10)Table 2 Effects of SBWP and SBWPE on ALT and AST activities in CCl4-induced liver injury in mice (±s,n=10)
注: *.与模型组比较,差异显著(P <0.05);**.与模型组比较,差异极显著(P <0.01)。下同。
组别 剂量/(g/(kg·d))AST活力/(U/L)ALT活力/(U/L)基础组051.83±6.41**45.06±5.88**模型组0100.19±9.05176.19±23.46 SBWP高剂量组696.47±8.51156.14±19.74**SBWP低剂量组298.02±10.73166.62±12.06*SBWPE高剂量组691.73±11.57*160.33±15.49*SBWPE低剂量组290.62±9.65*165.81±16.25*
由表2可知,与基础组相比,模型组小鼠血清的AST、ALT活力极显著升高(P<0.01),说明肝损伤建模成功。与模型组比较,SBWP和SBWPE的高、低剂量组均可以明显降低ALT水平(P<0.05或P<0.01);相对于AST来说,SBWPE的高、低剂量组均有显著降低(P<0.05),而SBWP各组均无明显降低。说明SBWP和SBWPE对CCl4型肝损伤模型小鼠ALT功能的保护有积极作用,但对于AST的降低作用尚不一致。
2.3 SBWP和SBWPE对小鼠肝脏TG、MDA、GSH含量的影响
表 3 SBWP与SBWPE对CCl4肝损伤小鼠肝脏TG、MDA和GSH含量的影响(±s,n=10)Table 3 Effects of SBWP and SBWPE on TG, MDA and GSH contents in CCl4-induced liver injury mouse liver (±s,n=10)
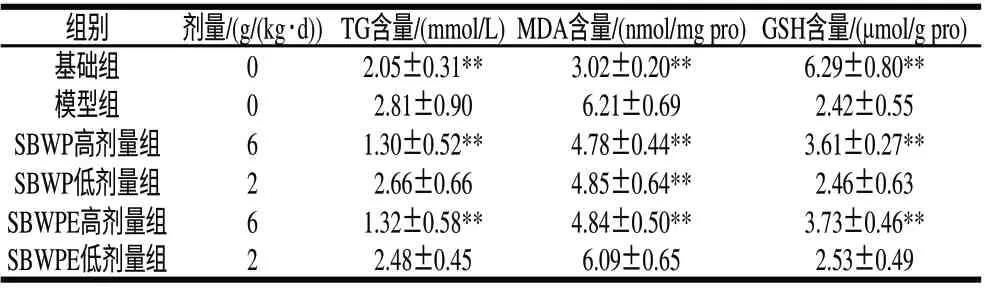
表 3 SBWP与SBWPE对CCl4肝损伤小鼠肝脏TG、MDA和GSH含量的影响(±s,n=10)Table 3 Effects of SBWP and SBWPE on TG, MDA and GSH contents in CCl4-induced liver injury mouse liver (±s,n=10)
组别 剂量/(g/(kg·d)) TG含量/(mmol/L) MDA含量/(nmol/mg pro) GSH含量/(μmol/g pro)基础组02.05±0.31**3.02±0.20**6.29±0.80**模型组02.81±0.906.21±0.692.42±0.55 SBWP高剂量组61.30±0.52**4.78±0.44**3.61±0.27**SBWP低剂量组22.66±0.664.85±0.64**2.46±0.63 SBWPE高剂量组61.32±0.58**4.84±0.50**3.73±0.46**SBWPE低剂量组22.48±0.456.09±0.652.53±0.49
由表3可见,小鼠CCl4灌胃24h后,模型组肝TG、MDA的含量较基础组明显升高,GSH含量极显著降低(P<0.01),说明急性肝损伤建模成功。SBWP和SBWPE高剂量组的TG、MDA和GSH含量与模型组相比均有极显著的改善(P<0.01),而在低剂量SBWP和SBWPE实验组中,除SBWP有降低MDA效果外(P<0.01),其他各项指标与模型组相比均无明显变化。提示饲料中加入量为36g/kg的小黑豆乳清蛋白和水解多肽能显著抑制TG和MDA产物的生成,提高抗氧化物质GSH的含量;而12g/kg的加入量对降低肝脏TG和提高GSH作用不明显。
2.4 SBWP和SBWPE对小鼠肝脏形态学的影响
2.4.1 肝脏形态学观察
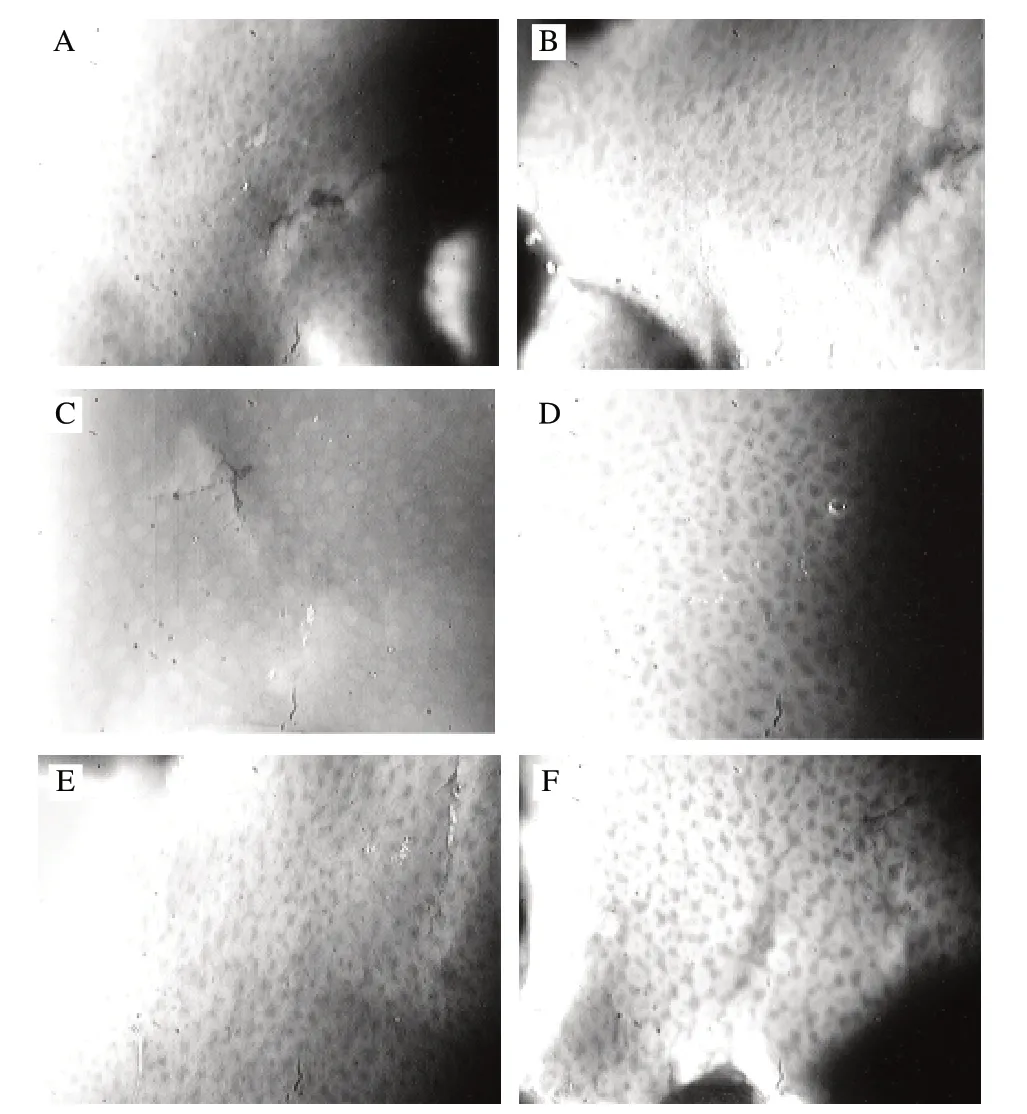
图 1 CCl4肝损伤小鼠肝脏形态学比较 (×100)Fig.1 Morphology of hepatic injury in CCl4-induced mice administered with SBWP and SBWPE at various dosages(×100)
显微(图1)观察可以看到,基础组肝脏呈暗红色,肝细胞表面光滑,质地柔软,无脂肪滴。模型组肝脏表面呈粗糙的沙粒状,颜色泛白无光泽且有变性脂肪滴溢出,组织很脆且很易出血、边缘外翻[10]。SBWP高剂量组和SBWPE高剂量组的肝脏与基础组动物肝脏很相近,表面呈暗红色;SBWP低剂量组和SBWPE低剂量组的小鼠肝脏颜色也比较暗淡、呈细小颗粒状和轻微的变性脂肪滴,与模型组的肝脏形态相近,但较模型组有改善。可以看出SBWP和SBWPE对由CCl4引起的急性肝损伤有明显的改善作用,且呈一定的量效关系。
2.4.2 肝组织学分析
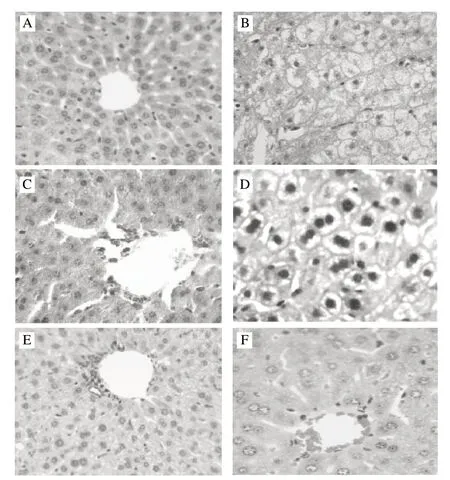
图 2 小鼠肝组织形态学变化 (×400)Fig.2 Histological changes of liver in mice (×400)
肝组织切片(图2)可见,基础组小鼠的肝细胞大小均匀、整齐,肝小叶轮廓清晰,细胞分界清,细胞核圆而清晰,胞质丰富,未见细胞变性和异常。模型组肝细胞严重损伤,正常组织结构明显消失,小叶界限不清,细胞索紊乱,大部分肝窦消失,肝细胞广泛性水样变性,核膜皱缩,有破碎的核,可见点状坏死甚至崩裂[11-12],可见急性肝损伤建模成功。SBWP和SBWPE高、低剂量组的肝细胞坏死、气球样变、水样变性和胞浆凝聚等病变情况都较模型组有不同程度减轻,其中以SBWP高剂量组的情况为最好,接近于基础组。可见,SBWP和SBWPE这两种物质及剂量的不同对CCl4急性肝损伤的保护效果有所不同:SBWP对修复肝脏组织结构效果比较明显,SBWPE对于保护肝细胞膜以及亚细胞器的结构完整效果更明显,且均是高剂量组的肝细胞比低剂量组的更接近正常。
3 讨 论
用CCl4诱导的急性肝损伤是肝损伤的一种常用模型,用来检测或研究药物或其他物质对肝损伤的保护作用。CCl4进入体内活化生成三氯甲基自由基和过氧自由基,攻击肝脏细胞膜上的磷脂分子,使得细胞膜、内质网膜发生氯烷化和脂质过氧化,因而造成TG含量升高、GSH含量降低、MDA含量升高和代谢紊乱;CCl4代谢产物还会破坏肝细胞膜结构和功能的完整性,致使ALT、AST渗漏入血、活力升高。而有保肝作用的活性物质可以通过抗氧化和清除自由基,使CCl4肝损伤模型动物的生化指标和病变肝脏得到纠正[13-14]。从抗氧化指标看,无论SBWP还是SBWPE,均为6g/(kg·d)剂量组优于2g/(kg·d)剂量组,说明两者的抗氧化效果在此剂量范围内存在效量关系;肝组织学和形态学检测也说明,SBWP和SBWPE高剂量组对CCl4型小鼠急性肝损伤的保护作用优于低剂量组,其恢复效果与抗氧化效果基本一致。由此可见,小黑豆乳清蛋白和水解多肽可能是通过抗脂质过氧化作用来促进肝细胞的再生和修复,并体现其保肝作用的[15]。本研究发现,SBWP和SBWPE对降低ALT效果显著,而SBWP对AST的效果不明显,原因可能是ALT主要分布在肝细胞浆,而AST主要分布在肝细胞的线粒体中,SBWP修复受损肝细胞线粒体的作用不如在细胞浆中明显,使受损线粒体中大量AST溶出[16],其机制还有待进一步研究。
[1] 杨卫民. 黑豆种质检验及生化质量指标的评价[J]. 中国种业, 2010, 7(10): 61-64.
[2] 刘娜, 李湘浓, 刘忆冰, 等. 大豆寡肽抗疲劳作用的实验研究[J]. 中国实验诊断学, 2010, 14(2): 201-203.
[3] 戚颖欣, 孟军, 曹柏营, 等. 大豆多肽对小鼠急性肝损伤保护作用的研究[J]. 食品科学, 2009, 30(21): 377-379.
[4] 常汝镇. 中国黑豆资源及其营养和药用价值[J]. 中国食物与营养, 1998, 11(5): 38-39.
[5] 许建明. 急性药物性肝损伤[J]. 解放军保健医学杂志, 2007, 9(3): 135-139.
[6] 李清云, 王常青. 小黑豆分离蛋白的制取与分析[J]. 农产品加工, 2007, 2(3): 65-67.
[7] 张龙翔, 张庭芳, 李令媛. 生物化学实验技术和方法[M]. 北京: 高等教育出版社, 1997: 153-156.
[8] 中华人民共和国. 保健食品检验与评价技术规范[M]. 北京: 清华同方出版社, 2003: 137-138.
[9] 张宁, 王凤山. 胰蛋白酶抑制剂研究概况[J]. 中国生化药物杂志, 2009, 8(2): 115-117.
[10] 王丽霞, 刘景彬, 张国蓉, 等. 多肽-Fe对小鼠急性肝损伤保护作用的研究[J]. 营养学报, 2007, 29(4): 385-392.
[11] CHOI Youyoung, OSADA Kyoichi, ITO Yoshiaki, et al. Effects of dietary protein of korean foxtail millet on plasma adiponectin, HDLcholesterol, and insulin levels in genetically type 2 diabetic mice[J]. Biosci Biotechnol Biochem, 2005, 69(1): 31-37.
[12] 江德乐, 江清国. 新编肝胆病诊疗学[M]. 北京: 中国科学技术出版社, 2003: 106-108.
[13] RECKNAGEL R O, GLENDE E A, DOLAK J A, et al. Mechanisms of carbon tetrachloride toxicity[J]. Pharmacol Ther, 1989, 43(1): 139-154.
[14] LESAGE G D, BENEDET TI A, GLASER S, et al. Acute carbon tet rat chloride feeding selectively damages large, but not small, cholangiocytes from normal rat liver[J]. Hepatology, 1999, 29(2): 307-319.
[15] CHOI I, KANG H S, YANG Y, et al. IL-6 induces hepatic inflammation and collagen synthesis in vivo[J]. Clin Exp Immunol, 1994, 95(3): 530-535.
[16] 马晓莉, 胡建国. 血清胆碱脂酶AST/ALT测定在肝病患者中的临床诊断价值[J]. 宁夏医学杂志, 2010, 32(3): 231-233.
