薏米酒发酵前淀粉液化及糖化条件的优化
2013-08-07郭克娜姜璐璐阚建全
郭克娜,姜璐璐,阚建全,,*
(1.西南大学食品科学学院,重庆 400716;2.重庆市特色食品工程技术研究中心,重庆 400716)
薏米(Coix lachryma-jobi),又名薏苡仁、苡米、米仁,是我国民间传统的中药,也是一种膳食佳品。《本草纲目》谓其“健脾益胃、补肺清热、祛风胜湿、养颜驻容、轻身延年”。大量研究报道表明,薏仁提取物薏仁油、薏仁酯、薏仁多糖等有很强的生物活性,如健胃、消炎、利尿、止痛、降血糖、抗癌等[1-7]。近年来随着保健食品的风行,国外特别是日本对薏米进行了较为深入的研究和开发。但是虽然以薏米为原料的营养食品、药膳佳肴层出不穷,但对薏米酒的研究和生产却少见报道。主要由于薏米淀粉颗粒较大,且不易α化[8-9],如果不将薏米淀粉进行充分液化和糖化就进行酒精发酵,再加上薏米本身的特殊气味,研制出的薏米酒往往因为感官质量上的缺陷不能被大多数消费者所接受,因此无法实现商业化生产。所以在酒精发酵之前,对薏米原料的液化和糖化工艺进行研究,保证薏米酒发酵的品质与稳定性就显得非常重要。本实验通过对薏米淀粉进行水解,研究液化和糖化工艺的最优条件,旨在为后期薏米的酒精发酵提供数据。
1 材料与方法
1.1 材料与试剂
薏米,市售,选用颗粒饱满,无发黄无霉变的薏米,在高速粉碎机中粉碎后过40目标准筛,备用。
α-淀粉酶(酶活力3700U/g)、糖化酶(酶活力10万U/g) 北京奥博星生物技术有限公司;其余试剂均为分析纯。
1.2 薏米淀粉水解工艺流程
1.2.1 液化工艺流程
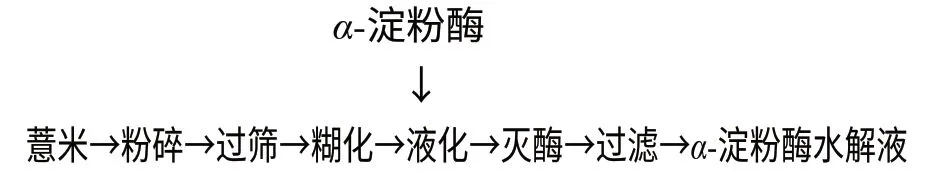
1.2.2 糖化工艺流程
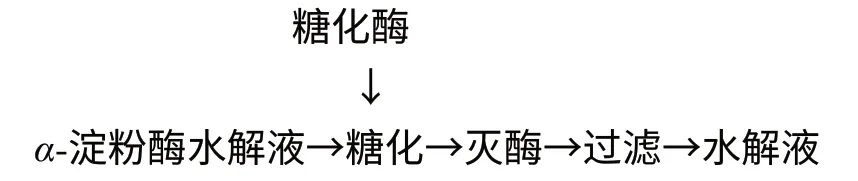
1.3 分析方法
1.3.1 薏米主要成分的测定方法
淀粉:酸水解法[10];粗蛋白:微量凯氏定氮法[10];粗脂肪:索氏抽提法[10];粗多糖:比色法[10];水分测定:卡尔·费休法[10]。
1.3.2 水解液相关指标的测定方法
还原糖(以葡萄糖计)测定:斐林试剂法[10];溶液相对密度:密度计法;DE值[11]:又叫葡萄糖当量值,是还原糖(以葡萄糖计)占溶液中干物质的百分比,计算公式如下:

1.3.3 薏米淀粉液化工艺试验设计[12-19]
将薏米粉按料液比1:10(m/V)糊化后,进行液化工艺的优化。单因素试验基本条件定为α-淀粉酶添加量1%、pH 6.5、温度70℃、液化时间3h。改变其中一个条件,固定其他条件以分析各因素对液化效果的影响。各因素梯度分别为α-淀粉酶添加量0.25%、0.5%、1%、1.5%、2%、2.5%;pH 5.0、5.5、6.0、6.5、7.0、8.0;温度55、60、65、70、75、80℃;液化时间1.0、1.5、2.0、2.5、3.0、3.5h。
通过单因素试验确定4个因素的合适水平范围,再选取L9(34)正交表,以液化DE值为考核指标,设计了四因素三水平的正交试验,以确定液化最优条件组合。以上试验每个处理重复3次,结果取平均值。
1.3.4 薏米淀粉糖化工艺试验设计
在最佳液化工艺条件下进行糖化工艺的优化。单因素基本条件设定为糖化时间3h、糖化酶添加量1%、温度60℃、pH4.5。改变其中一个条件,固定其他条件以分析各因素对糖化效果的影响。各因素梯度分别为糖化时间1.0、1.5、2.0、2.5、3.0、3.5h;糖化酶添加量0.25%、0.5%、1.0%、1.5%、2.0%、2.5%;温度45、50、55、60、65、70℃;pH 3.5、4.0、4.5、5.0、5.5、6.0。
在单因素试验的基础上,选取L9(34)正交表,以糖化DE值为考核指标,设计了四因素三水平的正交试验,以确定糖化最优条件组合。以上试验每个处理重复3次,结果取平均值。
1.4 数据分析处理方法
采用Origin Lab Origin Pro v7.5软件进行数据制图和统计分析。
2 结果与分析
2.1 薏米主要成分的分析结果
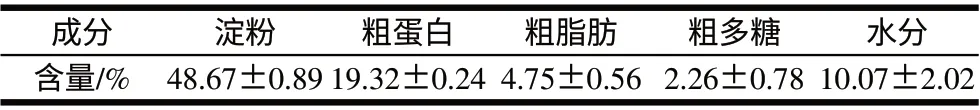
表 1 薏米主要成分Table 1 Major components of coixseeds
由表1可知,薏米中含量最高的成分是淀粉,此外薏米是禾本科一年生草本植物中蛋白质及脂肪含量较高的一类,其蛋白质含量比稻米约高出2倍[4],脂肪含量是稻米的6倍左右。而薏米中重要的生理活性成分薏仁多糖的含量也非常可观。
2.2 薏米淀粉液化最佳工艺条件的确定
2.2.1 α-淀粉酶添加量对液化液DE值的影响
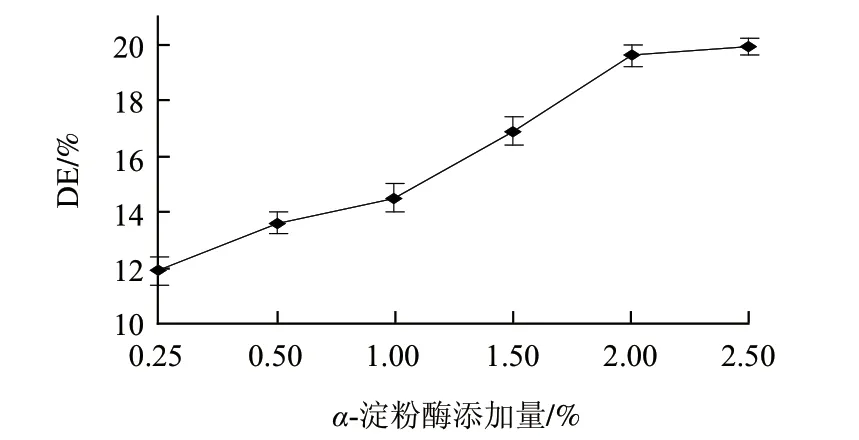
图 1 α-淀粉酶添加量对液化液DE值的影响Fig.1 Effect of α-amylase amount on DE of liquefaction
由图1可知,随着α-淀粉酶添加量增加,DE值迅速升高;但当加酶量大于2.00%时,DE值基本趋于稳定。这是由于加酶量小于2.00%时,底物质量浓度大于淀粉酶的质量浓度,反应速率受加酶量的影响较大,DE值随着加酶量的增加而快速增大;加酶量大于2.00%时,随着酶质量浓度逐渐增大,一部分酶分子没有机会和底物接触,致使水解液DE值基本不再变化。考虑到成本因素,选取2.00%为较优的α-淀粉酶添加量。
2.2.2 pH值对液化液DE值的影响
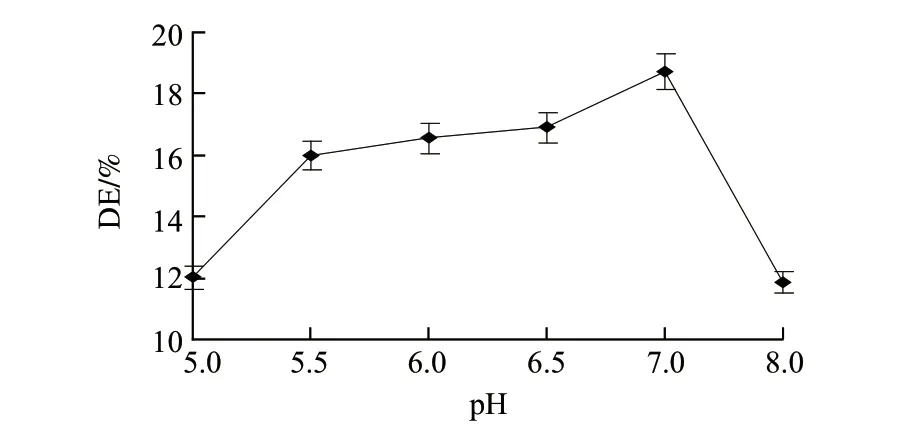
图 2 pH值对液化液DE值的影响Fig.2 Effect of pH on DE of liquefaction
由图2可知,水解液DE值随着pH值的增大先升高后降低,pH值在7左右,即薏米糊化后在自然状态下液化时DE值最大,达到18.72%。因为pH值会影响酶分子构象的稳定性和极性基团的解离状态,从而影响酶分子的构象以及酶与底物的结合力和催化能力[20]。α-淀粉酶最适作用pH值为6.0~7.0,在这个pH值范围内,α-淀粉酶才能很好的发挥作用。水解液过酸或过碱都会影响其稳定性,导致酶活性降低甚至失去活性。因此,较优的液化pH值为7.0左右。
2.2.3 液化温度对液化液DE值的影响
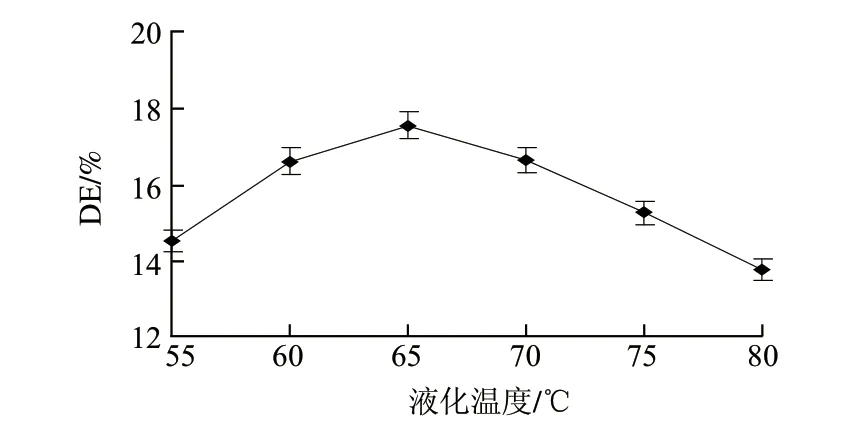
图 3 液化温度对液化液DE值的影响Fig.3 Effect of temperature on DE of liquefaction
由图3可知,水解液DE值随着温度的升高先增大后降低,温度为65℃时DE值最大,达到17.49%。液化温度同时影响化学反应速率和酶的活性,当温度小于65℃时,随着温度的升高,单位时间内酶分子与底物间的有效碰撞次数增加,液化反应速率加快;而当温度超过65℃时,随着温度的继续升高,α-淀粉酶变性失活,液化反应速率迅速下降。因此,液化的较优温度在65℃左右。
2.2.4 液化时间对液化液DE值的影响
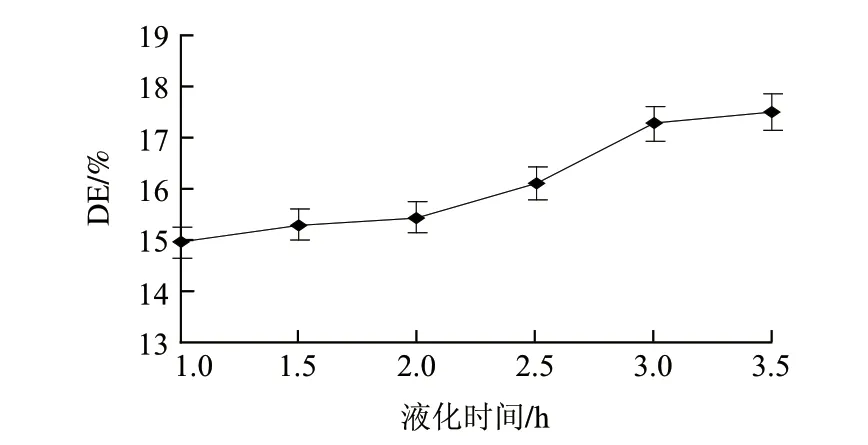
图 4 液化时间对液化液DE值的影响Fig.4 Effect of liquefaction time on DE of liquefaction
由图4可知,随着液化时间的延长,水解液DE值逐渐增大,在3h之前增加很快,然后趋于稳定。淀粉的液化分两个阶段,开始时α-淀粉酶首先使直链淀粉快速降解,产生寡糖,使溶液黏度快速下降;然后作用于支链淀粉产生葡萄糖、麦芽糖和一系列α-限制糊精,同时使寡糖缓慢水解成葡萄糖和麦芽糖,从而使淀粉液化。后一阶段反应速率比前一阶段要慢得多,这可能是导致液化3h后DE值趋于稳定的主要原因。另外,随着水解程度的加深,α-1,4-糖苷键减少,淀粉中存在的α-1,6-糖苷键影响了α-淀粉酶的水解速度,同时不断积累的酶解产物也会抑制酶的活性,使水解逐渐变慢。为了节约时间以提高效率,确定液化时间为3h。
2.2.5 薏米淀粉液化的正交试验
在单因素试验的基础上,选取L9(34)正交表进行正交试验,结果见表2。
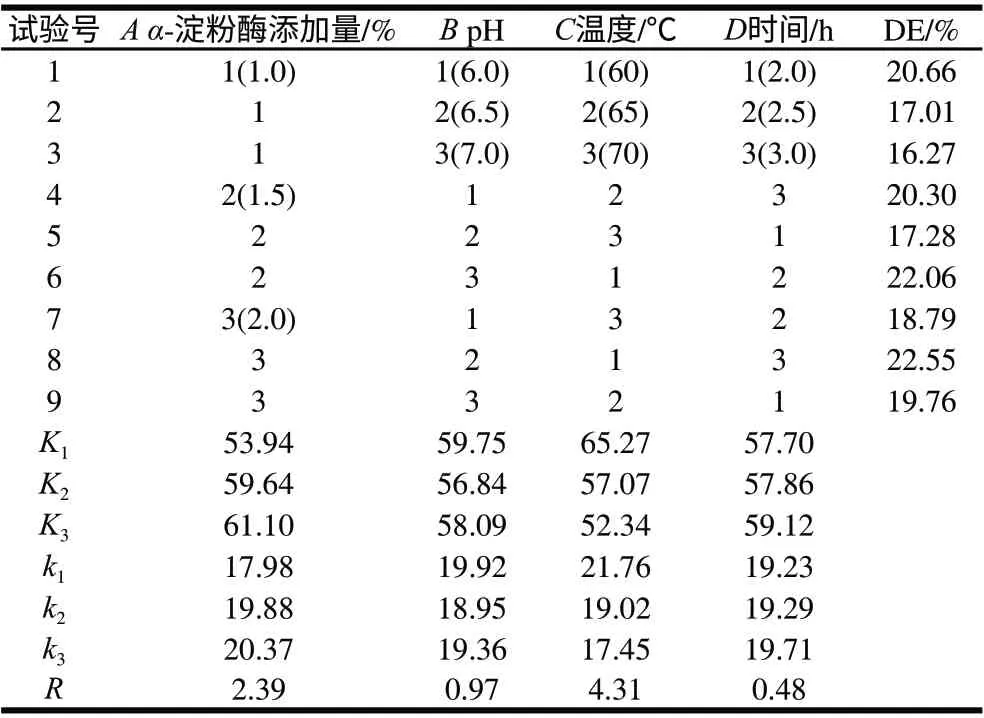
表 2 薏米淀粉液化条件优化L9(34)正交试验结果Table 2 Orthogonal tests of liquefaction of coixseed starch
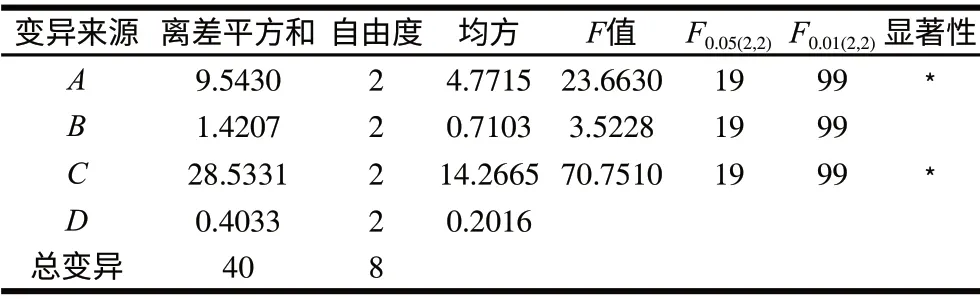
表 3 薏米淀粉液化正交试验结果方差分析Table 3 Analysis of variance for liquefaction of coixseed starch
由表2可知,各因素对液化液DE值都有影响,其影响主次顺序为:温度>α-淀粉酶添加量>pH值>时间。由表3方差分析可知,α-淀粉酶添加量和温度对液化效果有显著影响;pH值和液化时间对液化效果影响不显著。由此可得出最佳组合为A3B1C1D3,但此组并未出现在试验组中,故进行了验证实验,得出该条件下水解液DE值为22.12%,低于试验组中液化DE值最高的组合,故确定液化最优水平组合为A3B2C1D3,即α-淀粉酶用量2.0%、pH 6.5、温度60℃、液化时间3.0h。
2.3 薏米淀粉糖化最佳工艺条件的确定
2.3.1 糖化时间对糖化液DE值的影响
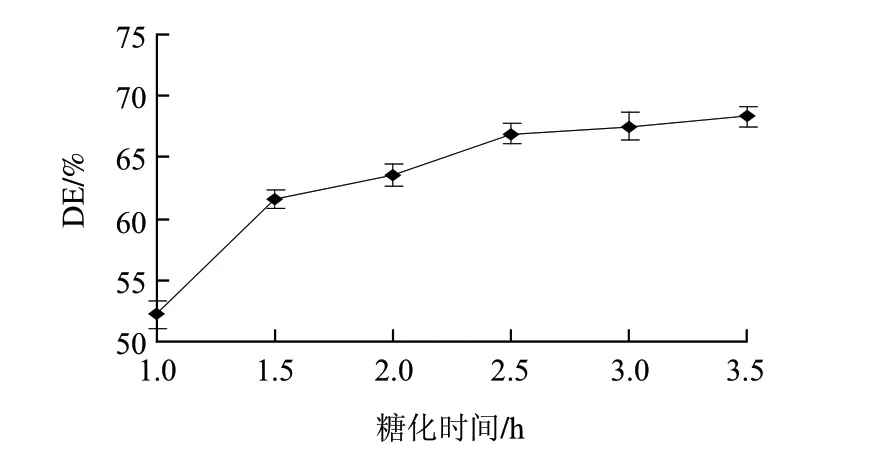
图 5 糖化时间对糖化液DE值的影响Fig.5 Effect of saccharification time on DE of saccharification
由图5可知,2.5h之前糖化液DE值随着糖化时间的延长逐渐升高,2.5h之后趋于平缓。这是因为糖化反应刚开始时,底物的浓度较高,反应速度受时间的影响较大;随着反应的进行底物浓度逐渐降低,反应速率也随之降低,2.5h后DE值无显著变化(P>0.05)。综合考虑糖化效果和生产效率,选取2.5h为较优糖化时间。
2.3.2 糖化酶添加量对糖化液DE值的影响
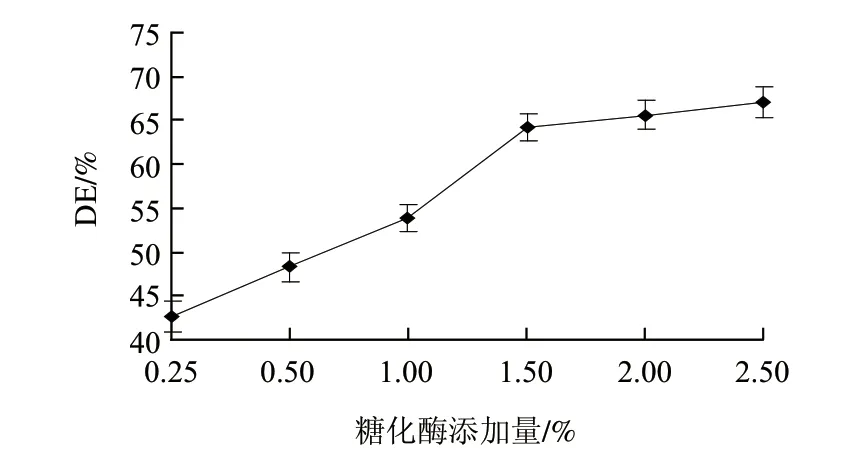
图 6 糖化酶添加量对糖化液DE值的影响Fig.6 Effect of glucoamylase amount on DE of saccharification
由图6可知,加酶量小于1.5%,水解速度随酶用量的增加而升高;加酶量大于1.5%时,糖化DE值变化不大(P>0.05)。考虑到成本因素,选取1.5%为较优的糖化酶添加量。
2.3.3 糖化温度对糖化液DE值的影响
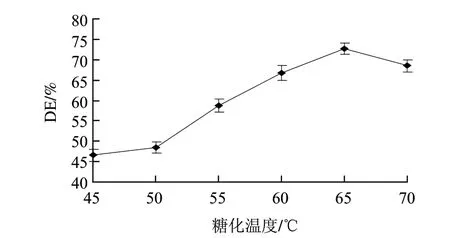
图 7 糖化温度对糖化液DE值的影响Fig.7 Effect of temperature on DE of saccharification
由图7可知,水解液DE值随着温度的升高先升高后降低,温度为65℃时达到最大值。这是因为糖化酶在室温至65℃内起糖化作用;超过65℃糖化酶失活严重。因此,较优的糖化温度为65℃。
2.3.4 pH值对糖化液DE值的影响
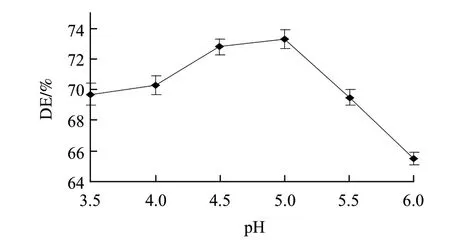
图 8 pH值对糖化液DE值的影响Fig.8 Effect of pH on DE of saccharification
由图8可知,随着pH值的增大,水解液DE值先升高后降低,pH值为5时DE值达到最大73.3%,随后迅速下降。原因是糖化酶的最适作用pH值为4.0~4.5,pH值过大或过小都会导致酶蛋白变性,从而影响酶分子与底物分子的结合和催化,最终影响水解速率。因此,确定糖化pH值为5.0。
2.3.5 薏米淀粉糖化的正交试验优化
在单因素试验的基础上,选取L9(34)正交表进行正交试验,结果见表4。
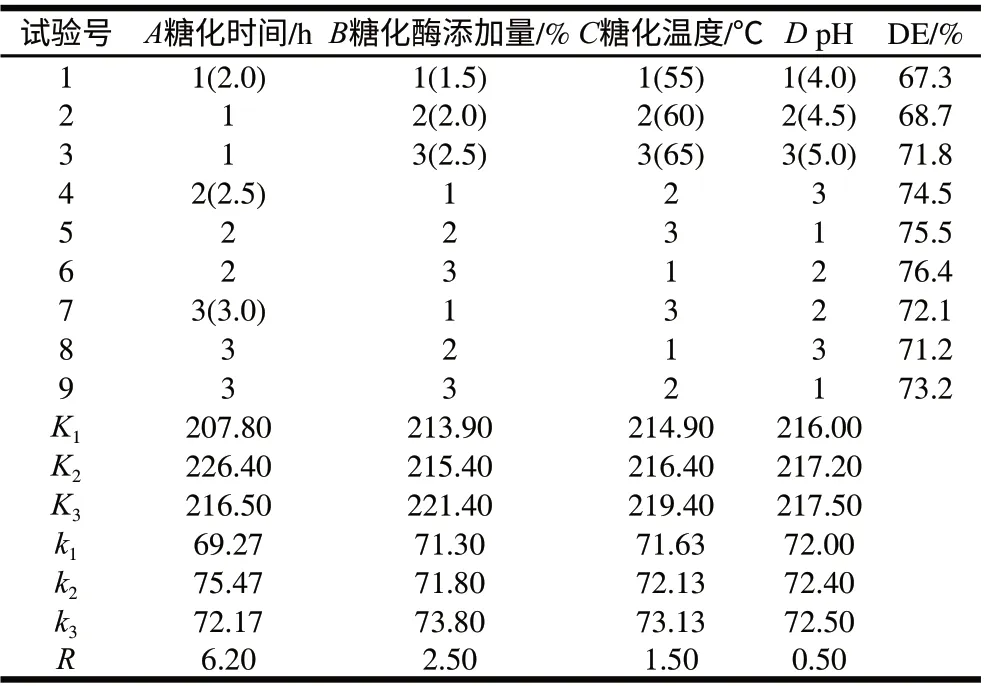
表 4 薏米淀粉糖化条件优化L9(34)正交试验与结果Table 4 Orthogonal tests of saccharification of coixseed starch
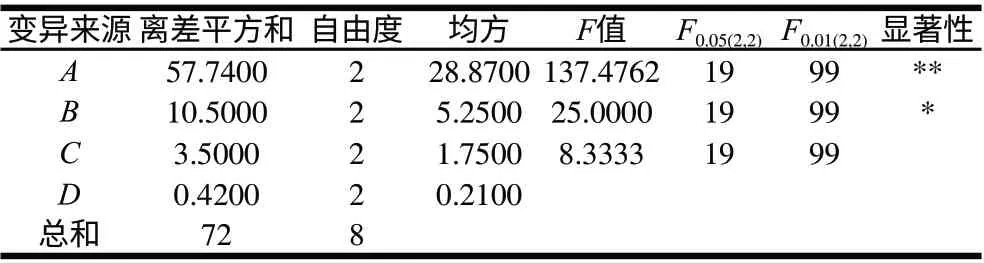
表 5 薏米淀粉糖化正交试验结果方差分析Table 5 Analysis of variance for saccharification of coixseed starch
由表4可知,各因素对糖化DE值影响主次顺序为:时间>糖化酶加酶量>温度>pH值。由表5方差分析可知,时间对糖化效果有极显著影响,而糖化酶的添加量对糖化效果有显著影响。由此可得出最佳组合为A2B3C3D3,但此组并未出现在试验组中,故进行了验证实验,得出该条件下水解液DE值为75.7%,低于试验组中糖化DE值最高的组合,故确定糖化最优水平组合为A2B3C1D2,即糖化时间2.5h、糖化酶添加量2.5%、温度55℃、pH4.5。在此最优水平组合下得到的最终水解液中还原糖含量和DE值分别为6.87g/100mL和76.4%。
3 结 论
本实验对薏米酒精发酵之前的液化和糖化工艺进行了研究,确定最佳液化工艺条件为:α-淀粉酶添加量2.0%、pH6.5、液化温度60℃、液化时间3.0h,此时液化液的DE值为22.55%,过滤后水解液澄清透明,色泽浅黄,不黏稠。在此条件下液化后的料液,再加入糖化酶进行糖化的最佳工艺参数为:糖化时间2.5h、糖化酶加酶量2.5%、糖化温度55℃、pH4.5,最终水解液中还原糖含量和DE值分别为6.87g/100mL和76.4%。为后续薏米酒精发酵的研究提供数据基础。
[1] KUO C C, SHIH M C, KUO Y H, et al. Antagonism of free-radicalinduced damage of adlay seed and its antiproliferative effect in human histolytic lymphoma U937 monocytic cells[J]. Journal of Agricultural and Food Chemistry, 2001, 49: 1564-1570.
[2] PENG Hailong, XIONG Hua, WANG Shenqi, et al. Soluble starchbased biodegradable and microporous microspheres as potential adsorbent for stabilisation and controlled release of coix seed oil[J]. European Food Research and Technology, 2011, 232(4): 693-702.
[3] MITSUHIRO N, ATSUKO M. Antitumor components isolated from the Chinese herbal medicine Coix lachryma-jobi[J]. Planta Medica, 1994, 60: 356-357.
[4] 高建华, 宁正祥, 罗尧晶. 苡仁营养成分的研究[J]. 食品研究与开发, 2006, 27(7): 174-176.
[5] HUANG S L, CHIANG W. Composition of the different fractions of adlay seed and the demutagenic effect of their HFD + ACE tone extract[J]. Journal of Food Science, 1999, 26: 121-130.
[6] HARUKI Y, SHUICHI Y, HIROAKI K, et al. Water-solble glucans from the seeds of Coix lachryma-jobi[J]. Phytochemistry, 1986, 25(1): 129-132.
[7] NAGAO T, OTSUKA H, KOHDA H, et al. Benzoxazinones from Coix lachryma-jobi var. ma-yuen[J]. Phytochemistry, 1985, 24: 2959-2962.
[8] 杜双奎, 马静, 于修烛, 等. 薏米淀粉特性研究[J]. 中国粮油学报, 2008, 23(1): 61-65.
[9] 吴雪辉, 何淑华, 谢炜琴. 薏米淀粉的颗粒结构与性质研究[J]. 中国粮油学报, 2004, 19(3): 36-37.
[10] 大连轻工业学院, 华南理工大学, 郑州轻工业学院, 等. 食品分析[M]. 北京: 中国轻工业出版社, 1994.
[11] 姜锡瑞, 段钢. 新编酶制剂实用技术手册[M]. 北京: 中国轻工业出版社, 2002.
[12] 伍时华, 蒋常德, 易弋, 等. 木薯酒精浓醪发酵中液化条件的优化[J]. 食品科学, 2007, 28(10): 381-383.
[13] 谢主兰, 吴雪辉. 板粟深加工中淀粉的酶水解研究[J]. 食品科学, 2003, 24(10): 62-66.
[14] 钟浩, 谭兴和, 熊兴耀, 等. 双酶法液化及糖化马铃薯干粉工艺的研究[J]. 食品研究与开发, 2009, 30(1): 8-12.
[15] 陈辉, 林亲录, 田蔚, 等. 大米淀粉酶法液化工艺的研究[J]. 粮食与食品工业, 2008, 15(4): 31-33.
[16] 李次力, 缪铭. 酶解甜玉米糖化液开发营养性饮料的研究[J]. 食品科学, 2005, 26(5): 175-178.
[17] 乔聚林, 刘传富, 左进华, 等. 糯米稠酒生产中液化条件的研究[J]. 食品工业科技, 2009(3): 234-236.
[18] 刘钟栋, 高莉, 王艳丽, 等. 小麦淀粉液化工艺优化与液化淀粉纳米结构研究[J]. 农业机械学报, 2008, 39(1): 88-90.
[19] 秦捷, 姚茂君. 凉薯液化糖化工艺[J]. 食品研究与开发, 2010, 31(10): 117-120.
[20] 郭勇. 酶工程[M]. 北京: 科学出版社, 2009.
