新型生物防腐剂——多聚阳离子抗菌肽在毕赤酵母中的表达
2013-08-07周晓宏
李 青,周晓宏
(北京理工大学生命学院,北京 100081)
食品防腐剂在食品的生产、运输和贮存过程中对防止食品腐败、保障食品质量具有非常重要的作用。我国目前食品生产中使用的防腐剂绝大多数都是人工合成的,然而长时间的摄入,可能存在潜在的食品安全隐患;另一方面,滥用非食用物质或超量超范围使用食品防腐剂用于食品防腐的现象还时有发生,引起了严重的食品安全事件。解决食品安全问题除了制定严格的政策法规和加强食品安全监管之外,开发天然、安全、高效、耐热的食品防腐剂是解决我国食品安全的重要举措。
抗菌肽是生物体内经诱导产生的一种具有抗菌活性的小分子多肽,多数具有碱性、带正电荷、抑菌效率高的特点,是构成宿主防御细菌、真菌等入侵的重要分子屏障[1-2]。1975年Boman等[3]从注射了大肠杆菌的美国天蚕蛹中分离得到了被命名为天蚕素(cecropins)的抗菌活性肽,同时还完成了这种抗菌肽的氨基酸序列测定,自此揭开了人们对抗菌肽研究的序幕。目前大多数抗菌肽应用于医药领域,而用于食品防腐剂领域的只有乳酸链球菌素和ε-多聚赖氨酸。乳酸链菌素存在不耐热的问题,且对G-菌抑菌效果不佳;多聚赖氨酸不能被胃肠道消化,进入肠道可能会抑制肠道中的正常菌群。前者属于两亲型阳离子抗菌肽,而后者属于单一阳离子抗菌肽。由于两者均作用于带负电荷的细菌磷脂双分子层细胞膜保守结构,因而细菌很难通过改变细胞膜的结构而产生抗性[4-5]。多聚阳离子抗菌肽的抑菌作用不依赖于空间三维结构,具有很强的耐热性,对G+菌和G-菌都有较好的抑菌作用,具有广谱性[6]。单一阳离子抗菌肽主要由多聚碱性必需氨基酸赖氨酸和精氨酸以及半必需氨基酸组氨酸组成,如果合成由碱性氨基酸通过α-氨基连接而成的多肽,则进入人体消化道后可被胰蛋白酶解形成必需与半必需氨基酸,还具有营养作用。因此,合成由精氨酸、赖氨酸、组氨酸3种碱性氨基酸组成的新型的α-多聚阳离子抗菌肽用于食品防腐,将具有耐热、高效、广谱、不易耐药、营养、天然和安全的特点。
目前国内外已有采用基因工程的方法制备两亲型抗菌肽的报道[7-8],由于抗菌肽通常带有阳离子正电荷,与带有阴离子的DNA可能发生相互作用,具有一定的细胞毒性,因此通常采用融合蛋白的形式进行表达[9-10]。这些相关报道主要侧重于基础研究或制药技术开发,没有单一的α-多聚阳离子抗菌肽食品防腐剂基因工程技术的研究报道。由于大肠杆菌不是食品安全菌,所以采用毕赤酵母Pichia pastoris表达体系对单一的多聚阳离子抗菌肽进行表达。毕赤酵母表达系统作为一种真核的表达系统,具有乙醇氧化酶AOX1基因启动子,这是目前最强、调控机理最严格的启动子之一[11-12],一般外源蛋白基因整合到毕赤酵母染色体上,随染色体复制而复制,不易丢失,所以外源蛋白基因遗传稳定,操作也较为简单。
本研究通过人工合成多聚阳离子肽与多聚阴离子肽融合基因,转化毕赤酵母,表达抗菌肽融合肽,并采用胃蛋白酶拆分,使融合肽多聚阳离子肽与多聚阴离子肽分离,为生产新型食品生物防腐剂多聚阳离子抗菌肽提供参考。
1 材料与方法
1.1 菌株与质粒
毕赤酵母GS115菌株 美国Invitrogen公司;枯草芽孢杆菌,为本实验室分离自腐败变质肉类。
YPD培养基:酵母提取物10g/L、蛋白胨20g/L、葡萄糖20g/L;BMGY培养基:酵母提取物10g/L、蛋白胨20g/L、磷酸盐缓冲液100mmol/L、YNB 13.4g/L、生物素4×10-5g/L、甘油10g/L,pH 6.0;BMMY培养基:5g/L过滤除菌的甲醇替代BMGY的10g/L甘油。最小葡萄糖(minimum dextrose,MD)平板:YNB 13.4g/L、生物素4×10-5g/L、葡萄糖20g/L、琼脂粉15g/L。培养基的配制方法参考美国Invitrogen公司的Easyselect Pichia Expression Kit说明书。
1.2 试剂
E. coli DH5α、质粒pPIC9基因序列及引物,由美国Invitrogen公司合成,1kb DNA Marker和 DNA Marker Ⅶ北京庄盟生物基因科技公司;超低分子质量蛋白Marker北京索莱宝科技公司;Taq酶 日本TaKaRa公司;限制性内切酶SalⅠ 美国NEB公司;Tricine、山梨醇 美国Sigma公司;质粒提取试剂盒 百泰克公司;其他试剂均为进口或国产分析纯。
1.3 方法
1.3.1 融合肽基因合成
设计一段60个氨基酸残基的融合肽,N端为酸性氨基酸,C端为碱性氨基酸,中间设置了胃蛋白酶酶切位点疏水性氨基酸(酪氨酸、苯丙氨酸),增加酸性多肽序列是为了中和碱性多肽序列,以免表达后产生细胞毒性。序列如下:EDEDQESEDNDESEEDDDEEDEDDQEDEDFYR RHRRKHRRRKKHRRKKHRRRKHHRKHRR。
根据毕赤酵母密码子偏好性[13],设计这60个氨基酸融合肽的基因序列:5’-GAAGAUGAGGACCAGGAGUC CGAAGACAAUGAUGAAUCUGAGGAGGACGAUGACGAAGAAGAUGAAGACGAUCAAGAGGAUGAGGACU UCUACAGAAGGCAUAGACGUAAGCAUCGUAGACG UAAGAAGCAUAGACGUAAGAAACAUAGGAGGCGC AAGCACCACAGAAAGCACAGACGU-3’,其中N端为酸性氨基酸,C端为碱性氨基酸。
对所需合成的目的基因全序列进行分析,检查基因内部有无特别复杂二级结构和重复序列,将序列提交美国Invitrogen公司合成。
首先根据基因序列分析的结果,分别进行单链Oligo的设计及合成,然后利用PCR将合成的Oligo拼接目的基因片段。PCR产物凝胶电泳,割胶回收约180bp目的条带。将上一步回收好的片段连接入pMD-18T载体16℃连接1h将连接产物转化至感受态细胞DH5α。挑取平板上的单克隆接种于4mL氨苄LB培养基中,37℃摇床过夜培养;质粒抽提后测序验证。
1.3.2 构建重组表达质粒载体
根据目的基因序列,设计1对PCR扩增引物,并在序列的5’端添加限制性酶切位点EcoRⅠ(GAATTC),在序列的3’端添加NotⅠ位点(GCGGCCGC),为了保证密码框的正确,加入保护碱基。引物:P1:5’-CCGGAATTCG AAGATGAGGACCAGGAGTCCG-3’,P2:5’-ATAAGA ATGCGGCCGCACGTCTGTGCTTTCTGTGGTGC-3’。
电泳回收约200bp条带;用EcoRⅠ和NotⅠ双酶切回收的目的片段,37℃酶切1h后过柱回收。用EcoRⅠ和NotⅠ双酶切pPIC9载体37℃酶切2h后电泳回收;连接酶切后片段及载体,16℃连接1h后转化到E. coli DH5α感受态细胞。
将含有质粒的E. coli DH5α按1%接种到10mL LB液体培养基(含50μg/mL Amp)中,37℃振荡培养约12h至对数生长后期。提取质粒,0.8%琼脂糖电泳。测序验证重组克隆中插入片段的序列信息。
1.3.3 毕赤酵母GS115生长曲线测定
挑取GS115单菌落,接种在含有5mL YPD液体培养基中,30℃、170r/min振荡过夜。取100μL培养物接种至含有100mL YPD培养基的250mL三角摇瓶中,30℃、170r/min培养,每隔2h取样测定菌液OD600nm值,绘制毕赤酵母生长曲线。取不同生长时期的酵母细胞用于下述感受态细胞的制备及电转化。
1.3.4 毕赤酵母GS115感受态制备
取不同生长时期的酵母菌液转入50mL离心管,4℃、1500×g离心5min,弃上清;50mL冰预冷无菌水重悬,4℃、1500×g离心5min,弃上清;25mL冰预冷无菌水重悬,4℃、1500×g离心5min,弃上清;5mL 1mol/L冰预冷山梨醇重悬,4℃、1500×g离心5min,弃上清;约400~500μL 1mol/L冰预冷山梨醇重悬,每管80~100μL分装,感受态细胞保存在-20℃冰箱,大约1周内可用[14]。
1.3.5 目的基因电击转化GS115
取10μL经SalⅠ单酶切处理的重组质粒溶解在5~10μL TE溶液中,与80μL GS115感受态细胞混合,转入0.2cm冰预冷电击杯中,冰浴5min。在1.5kV,电容25μF,5ms,电阻200Ω条件下进行电转。电击后立刻加入1mL 1mol/L冰预山梨醇,将内容物转入灭菌离心管中。分成200μL等份,涂于MD平板上,30℃倒置培养,直至得到单个菌落生长。
1.3.6 菌落PCR筛选阳性重组子
当平板上的菌落长到肉眼可见时,挑取单菌落于无菌EP管中,加入100mg/mL蜗牛酶50μL,37℃水浴反应1h破壁,离心取上清作为模板,用酵母5’AOX和3’AOX通用引物对各个菌落进行PCR扩增。PCR反应参数如下:94℃变性10min;94℃变性1min,54℃退火1min,72℃延伸反应2min,重复30个循环;72℃延伸10min。反应完毕后取10μL上样电泳。对于显现特异性条带的克隆,重新培养并保存。
1.3.7 目标蛋白的诱导表达
将筛选出的重组菌株接种于YPD培养基,28℃、170r/min振荡培养过夜。涂布YPD平板活化,28℃培养至长出单菌落。挑取一活化的单菌落接种到250mL BMGY培养基中(初始pH6),28℃、170r/min摇床培养16~18h,至其OD600nm值在2.0~6.0之间。4℃、9000×g离心10min收集菌体,用无菌超纯水洗涤菌体1~2次。用50mL BMMY重悬菌体,将所得菌液置于250mL挡板瓶中,双层纱布封口,于28℃、170r/min振荡培养。每24h向培养基中添加甲醇至终体积分数为0.5%;同时补充灭菌超纯水,使菌液总体积保持不变。按时间点分别取菌液样品,取样量为1mL,置于1.5mL EP管中,4℃、9000×g离心2~3min,收集上清,分析目的蛋白的表达量和菌液最佳收获时间。时间节点取:0、24、48、72、96h。Tricine-SDS-PAGE分析表达产物。凝胶的配制方法、电泳条件和染色方法参照文献[15]。
1.3.8 表达条件的优化
初始pH值的优化:按上述方法诱导表达GS115重组菌,采用不同初始pH值(3、4、5、6、7)诱导表达96h,Tricine-SDS-PAGE分析表达产物。
甲醇诱导体积分数的优化:按上述方法诱导表达GS115重组菌,每24h添加甲醇分别为0.5%、1.0%、1.5%、2.0%,Tricine-SDS-PAGE分析表达产物,比较甲醇添加量不同对表达水平的影响。
1.3.9 表达产物的酶解与分离
将表达得到的500mL发酵液4℃、4000×g离心10min获上清液,置于冰浴上,将硫酸铵固体缓慢加入蛋白溶液中,边加边搅拌,避免局部硫酸铵饱和度过高,但搅拌的时候注意不要搅出气泡,加硫酸铵至50%,4℃、4000×g离心10min,沉淀用50mL PBS重新溶解,用1mol/L HCl溶液调整溶液 pH值至2.0。加入终质量浓度为2mg/mL的胃蛋白酶,37℃水浴4h,在融合肽中酸性多肽和碱性多肽之间连接的疏水性氨基酸Phe、Tyr之间切开,形成酸性多肽和碱性多肽产物,85℃、10min灭酶。将灭酶后的酶解液迅速冷却,12000×g离心20min去除沉淀的酸性多肽部分,上清液用1mol/L的NaOH调pH值至6.0,-20℃保存。
1.4 酶解蛋白抑菌作用研究
滤纸用打孔器制作成直径为4mm的圆形滤纸片,121℃高压灭菌后干燥备用。将枯草芽孢杆菌在液体LB培养基中37℃、170r/min过夜振荡培养后,与预先准备好的灭菌固体LB培养基在45℃左右按1:100混合均匀,倒入无菌培养皿中,用无菌镊子将分别在酶解蛋白样品,1g/100mL山梨酸钾溶液、0.1g/100mL乳酸链球菌素溶液中浸泡过的滤纸片放置于平板上,37℃培养过夜。观察抑菌圈的大小。
2 结果与分析
2.1 重组表达质粒pPIC9的构建

图 1 重组质粒pPIC 9的酶切Fig.1 Restriction enzymes analysis of the recombinant plasmid
由图1可知,泳道1是重组质粒用SalⅠ单酶切后获得的条带,大小为8000bp左右,泳道2为直接提取的质粒。为了进一步验证,用5’AOX1和3’AOX1作为引物,重组质粒作为模板进行PCR,1.2%琼脂糖凝胶电泳显示,在600bp处扩增出一条带见图2(泳道1)。进一步测序证实,说明基因已经连接到了质粒载体上。

图 2 重组质粒pPIC9的PCR鉴定Fig.2 PCR analysis of the recombinant plasmid
2.2 GS115生长曲线
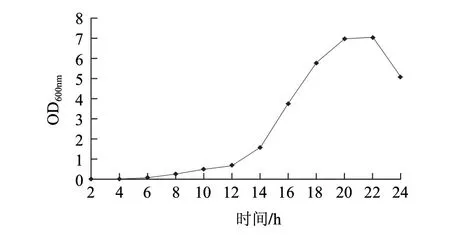
图 3 毕赤酵母GS115生长曲线Fig.3 Growth curve of GS115
为了控制电转化的条件,在转化前要先测定菌株的生长条件,如图3所示,在YPD中,30℃、170r/min条件下,GS115在14~20h为对数生长期,对应OD600nm值为0.6~6.9。对数期的细胞活力强,制备感受态细胞转化率高。
2.3 GS115不同生长状态对转化率的影响

图 4 细胞生长时期对转化率的影响Fig.4 Effect of growth stage on transformation efficiency
在1.5kV、电容25μF、5ms、电阻200Ω电转杯0.2cm条件下,分别选用处于不同对数生长阶段(OD600nm值为0.6~6.9)的酵母细胞制备感受态进行电转化并计算转化率。图4表明,用处于对数生长期的毕赤酵母进行电转化,均有转化子出现,但不同的生长阶段对转化率的影响很大,采用对数中期的酵母细胞即14h,OD600nm值为1.5时转化效率最高,达到18个转化子。
2.4 GS115阳性重组子的筛选
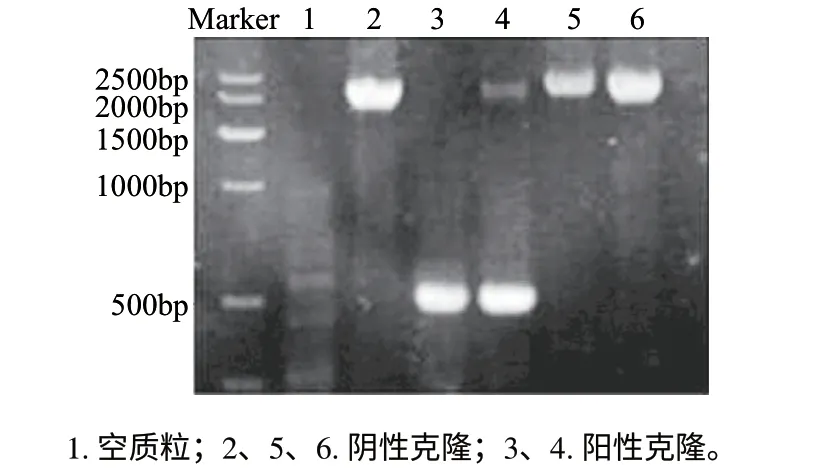
图 5 重组毕赤酵母阳性克隆子的筛选Fig.5 Screening for positive clones of Pichia pastoris
受体菌GS115在组氨酸脱氢酶位点His4有突变,因而不能合成组氨酸,而表达质粒pPIC9有His4基因可与宿主进行互补,因此通过不含组氨酸的培养基(MD)来选择His+转化子。以MD上生长的GS115单菌落为模板,用酵母5’AOX和3’AOX通用引物进行PCR鉴定,如图5所示,1.2%琼脂糖凝胶电泳显示,泳道1无扩增条带,阴性克隆(泳道2、5、6)在2200bp处有条带,与酵母基因组AOX基因大小相符,而阳性克隆(泳道3、4)在600bp左右有一扩增条带,与目的基因有关,说明基因已经整合到宿主酵母中。
2.5 抗菌肽的表达鉴定

图 6 毕赤酵母表达产物的Tricine-SDS-PAGEFig.6 Tricine-SDS-PAGE analysis of peptide expressed in Pichia pastoris
目的融合肽的分子质量约为8kD,由于分子小,常规的SDS-PAGE的分离效果差,而在Tricine-SDSPAGE(16%分离胶,10%夹层胶,4%致密胶)上能得到较好的分离。如图6所示,泳道1、2、3、4、5分别对应培养时间0、24、48、72、96h。结果表明,在BMMY培养基中,初始pH值为6,甲醇诱导体积分数为0.5%的条件下,发酵后72h开始有分子质量为8kD的蛋白得到表达,96h蛋白表达量较高。而阴性对照相应的位置无任何条带。说明抗菌肽GS115中得以表达。细胞最佳收获时间是诱导后96h。
2.6 表达条件的优化

图 7 不同初始pH值对表达水平的影响Fig.7 Effect of initial pH on peptide expression level
由图7可知,在BMMY培养基中,初始pH值为6.0,甲醇诱导体积分数为0.5%的条件下,泳道1、2、3、4、5分别对应初始pH值为3.0、4.0、5.0、6.0、7.0,诱导96 h后的表达结果。在pH<7.0时都有蛋白表达,pH4.0时表达量最高。由图8可知,泳道1、2、3、4分别对应甲醇添加量0.5%、1.0%、1.5%、2.0%。在改变甲醇添加量时,每24h添加终体积分数0.5%、1.0%的条件下有蛋白表达。

图 8 不同甲醇添加量对表达水平的影响Fig.8 Effect of methanol concentration on peptide expression level
2.7 抑菌活性研究

图 9 不同种类防腐剂的抑菌效果Fig.9 Antibacterial effect of different preservatives
由图9可知,酶解上清液的抑菌直径为0.8cm,而1g/100mL的山梨酸钾抑菌直径是0.6cm。0.1g/100mL的乳酸链球菌素抑菌直径是1.3cm。说明酶解蛋白的抑菌活性介于山梨酸钾和乳酸链球菌素之间。
3 讨 论
毕赤酵母没有天然的表达质粒,因此一般外源蛋白基因通过整合型质粒载体整合到毕赤酵母染色体上,随染色体复制而复制,不易丢失。整个体系较为成熟,容易达到较高的表达量,且易于大规模生产,是基因工程中应用较为广泛的一种表达系统[16]。目前已经已有多种蛋白实现了成功表达,如各种抗菌肽、白蛋白、人胰岛素、干扰素等[17-18]。表达载体pPIC9是分泌性质粒,在多克隆位点前有α-信号肽编码序列,可引导外源蛋白分泌至胞外[19],有利于蛋白下一步的分离纯化。
在使用毕赤酵母表达系统表达外源基因时,电转化是最常见且简单易行的方法,但是影响转化率的因素相当复杂。实验表明,处于对数生长中期的酵母细胞最适合制作感受态用于电转化,因为这个阶段的细胞生长最为旺盛[19],虽然在电击条件下细胞死亡率较高,但是相对的存活的细胞较多,得到的转化子的比例也较高。因此毕赤酵母的电转化以培养到对数中期(OD600nm值为1.3~1.5)为宜。
本实验在人工设计和合成一段多聚阳离子抗菌肽和多聚阴离子肽融合肽基因的基础上,以毕赤酵母为表达系统,利用AOX1强启动子成功地表达了目的蛋白,并在α因子信号肽的引导下分泌到胞外,Tricine-SDS-PAGE电泳分析表明表达的目的蛋白分子质量约为8kD,与理论值极相近。以SalⅠ酶线性化的重组质粒pPIC9-PCAP转化GS115酵母细胞时,将在AOX1处以同源重组的方式插入酵母基因组中,产生Mut+型酵母重组子,它能在甲醇的诱导下表达外源蛋白。重组毕赤酵母转化子中用甲醇诱导外源基因的表达时,控制甲醇体积分数十分重要。在培养中由于甲醇的消耗和挥发,若甲醇耗尽或体积分数太低,AOX1启动子不能有效启动,外源基因也就不能得到有效表达,所以需要人工后续添加甲醇。但若甲醇体积分数过高,对细胞会产生毒害作用。实验表明在每24h添加终体积分数为0.5%~1.0%的甲醇时目的蛋白可以得到较好的表达。
蛋白酶降解蛋白是酵母表达系统存在的缺陷,降解不仅能引起目的蛋白的产率下降,降解形成的片段还会造成分离纯化的困难。在发酵的过程中,随着外源蛋白在培养基中的浓度不断提高,蛋白水解酶浓度也随着升高。由于毕赤酵母的pH值适应范围比较广,可以在pH3.0~7.0的范围内生长,而不同的蛋白酶有不同的最佳pH值作用范围,所以适当降低发酵pH值可以在不影响细胞的生长的情况下降低蛋白酶活性,减少目的蛋白的降解,提高外源蛋白的稳定性。本实验中pH4.0时目的产物表达量最高可能与此有关。
表达得到的多聚阳离子抗菌肽抑菌效果与传统的天然防腐剂Nisin相比不够理想,可能是由于表达量偏低,在表达过程中融合肽有可能别自身蛋白酶酶解,且胃蛋白酶酶解效率不高,以致多聚阳离子抗菌肽可能没有很好地与多聚阴离子肽分离,最终多聚阳离子抗菌肽有效浓度偏低。
本实验采用毕赤酵母GS115和载体pPIC9对其分泌性重组表达,成功表达了具有活性的抗菌肽,表达产物具有较好的稳定性。影响外源蛋白在毕赤酵母中表达的因素很多[20-21],如宿主菌的性质、信号肽、表达单元的拷贝数;转录和表达的效率、外源基因的序列、培养基、发酵参数等。 因此在对目的基因进行改造合成时,充分考虑了毕赤酵母的密码子偏好性,并应用GS115的组氨酸营养缺陷型进行了筛选,并对发酵条件进行了初步优化。通过这些措施,使得抗菌肽能够在重组酵母中得以表达。这不仅对抗菌肽的生产实验、抗菌机理等研究具有重要意义,也为其开发成新型天然食品防腐剂和工业化生产奠定了一定的基础。
融合表达虽可大量产生带有抗菌肽片段的融合蛋白,但在体外活性分析还需对融合蛋白进行切割、分离、纯化,并分析抗菌肽的抑菌活性;另外抗菌肽的表达量也需要提高。这些工作有待进一步完善。
[1] 王宜文, 杜兵. 应用于食品工业的天然肽类防腐剂[J]. 农技服务,2007, 24(2): 105-106.
[2] BROWN K L, HANCOCK R E. Cationic host defense (antimicrobial)peptides[J]. Current Opinion in Immunology, 2006, 18: 24-30.
[3] BOMAN H G, INGRID N F, KERSTIN P, et al. Characteristics of an inducible cell-free antibacterial reaction in hemolymph of Samia cynthia pupae[J]. Infection and Immunity, 1975, 12(6): 1426-1438.
[4] MANGONI M L, PAPO N, SAUGAR J M, et al. Effect of natural Lto D-amino acid conversion on the organization, membrane binding,and biological function of the antimicrobial peptides bombinbins H[J].Biochemistry, 2006, 45(13): 4266-4276.
[5] YEAMAN M, YOUNT N. Mechanism of antimicrobial peptide action and resistance[J]. Pharmacologicol Reviews, 2003, 55(1): 27-55.
[6] 段杉, 邓瑞君, 吴锦铸, 等. ε-聚赖氨酸及其生物合成的研究进展[J].食品科技, 2005(4): 13-15.
[7] 尹娜, 李鸿钧, 彭梅. 抗菌肽Cecropin D在毕赤酵母中的表达、纯化及活性鉴定[J]. 中国生物制品学杂志, 2008, 21(3): 185-189.
[8] HITZEMAN R A, HAGIE F E, LEVINE H L, et al. Expression of a h uman gene for interferon in yeast[J]. Nature, 1981, 293: 717-722.
[9] CHEN Yuqing, ZHANG Shuangquan, LI Baocun, et al. Expression of a cytotoxic cationic antibacterial peptide in Escherichia coli using two fusion partners[J]. Protein Expression and Purification, 2008, 57(2):303-311.
[10] JIN Fengliang, XU Xiaoxia, WANG Liexi, et al. Expression of recombinant hybrid peptide cecropinA (1-8)-magainin2 (1-2)in Pichia pastoris[J]. Protein Expression and Purification, 2006, 50(2): 147-156.
[11] SHAW J E, ALATTIA J R, VERITY J E, et al. Mechanisms of antimicrobial peptide action: studies of indolicidin assembly at model membrane interfaces by in situ atomic force microscopy[J]. Journal of Structural Biology, 2006, 154(1): 42-58.
[12] CREGG J M, MADDEN K R, BARRINGER K J, et a1. Functional characterization of the two alcohol oxidase genes from the yeast Pichia pastoris[J]. Molecular and Cellular Biology, 1989, 9(3): 1316-1323.
[13] 赵翔, 霍克克, 李育阳. 毕赤酵母的密码子用法分析[J]. 生物工程学报, 2000, 16(3): 308-311.
[14] 高炳淼, 唐天乐, 长孙东亭. 毕赤酵母高效电转化条件的研究[J]. 中国海洋药物, 2010, 29(2): 1-5.
[15] SCHAGGER H, GEBHARD V J. Tricine-sodium dodecyl sulfate polyacrylamide gel electrophoresis for the separation of proteins in the range from 1-100 kDalton[J]. Analytical Biochemistry, 1987, 166(2):368-379.
[16] LOPEZ M, KOEHLER A, NOWAK G. High-level secretion of dipetarudin, a chimeric thrombin inhibitor, by Pichia pastoris[J].Protein Expression and Purification, 2007, 52: 8-13.
[17] LADDY D J, WEINER D B. From plasmids to protection: a review of DNA vaccines against infectious diseases[J]. International Reviews of Immunology, 2006, 25(3/4): 99-123.
[18] CEREGHINO J L, CREGG J M. Heterologous protein expression in the methylotrophic yeast Pichia pastoris[J]. FEMS Microbiology Reviews, 2000, 24(1): 45-66.
[19] SCORER C A, CLARE J J, McCOMBIE W R, et al. Rapid selection using G418 of high copy number transformants of Pichia pastoris for high-level gene expression[J]. Nature Biotechnology, 1994, 12(2):181-184.
[20] 卫华, 李大力, 汪信. 抗菌肽基因在毕赤酵母总分泌表达及其条件优化[J]. 农业生物技术学报, 2006, 14(6): 976-980.
[21] 熊爱生, 彭日荷. 信号肽序列对毕赤酵母表达外源蛋白质的影响[J].生物化学与生物物理学报, 2003, 35(2): 154-160.
