产褐藻胶裂解酶菌株的分离与鉴定
2013-08-07黄李淑馨曹海龙谭海东赵小明杜昱光
黄李淑馨,刘 钢,岳 敏,曹海龙,谭海东,赵小明,尹 恒,* ,杜昱光,*
(1.中国科学院大连化学物理研究所,辽宁大连116023;2.中国科学院大学,北京100049;3.大连海洋大学食品科学与工程学院,辽宁大连116023)
褐藻胶是由β-D-甘露糖醛酸(mannuronate,M)和α-L-古洛糖醛酸(guluronate,G)组成的直链多糖。两种糖醛酸单体通过α/β-1,4 糖苷键随机排列成褐藻胶分子中的聚甘露糖醛酸片段(polyMblock),聚古洛糖醛酸片段(polyG-block)以及MG 交替嵌段(polyMG-block)[1]。褐藻胶结构复杂,物化性质多样,因而它被广泛应用于食品、医药、化妆品等领域[2]。此外,褐藻胶寡糖因具有免疫调节[3]和神经保护[4]等生物活性,所以它可被开发成独特疗效药物或功能性食品。近年来,随着对褐藻胶及其寡糖的功能评价和开发研究的不断深入,“量身定制”(tailor-made)的新理念被提出,即指设计具有确定结构和聚合度的褐藻胶及其寡糖,使其物化性质或生物活性满足特定用途的需要[5]。褐藻胶裂解酶是一类通过β-消去反应断裂褐藻胶的裂解酶,因其具有专一、高效及反应温和等优点,被视为改造褐藻胶的有力工具。褐藻胶裂解酶按底物专一性可分为聚甘露糖醛酸片段裂解酶(EC 4.2.2.3)和聚古洛糖醛酸片段裂解酶(EC 4.2.2.11),也可按反应模式分为内切或外切酶[6]。褐藻胶裂解酶还可用于降解菌膜[7]及生产生物燃料[8]。受底物专一性和反应模式的影响,单一类型的酶能断裂的褐藻胶位点有限。因此,筛选褐藻胶代谢新菌株,寻找不同类型的酶对开发高值化褐藻胶及其寡糖产品具有重要意义。本研究从海南采集的多类样品中筛到高产褐藻胶裂解酶的4株菌,然后研究了其产酶规律,并通过形态学和系统发育分析对其进行鉴定,旨在获得新酶源微生物资源,为酶的克隆表达及酶法改造褐藻胶奠定基础。

表1 产褐藻胶裂解酶菌株的来源Table 1 Sources of 10 alginate lyase-producing strains
1 材料与方法
1.1 材料与仪器
供分离的37 个样品(包括土壤、淤泥、淡水和海水) 分别采自海南省的风炉岭、红树林、玉带滩、七仙岭、五指山、天涯海角、黎安镇渔港及海口市周边水产海藻工厂等地区;无机营养盐溶液(1000mL):NaCl 5g,KH2PO41g,MgSO4·7H2O 0.5g,CaCl20.2g,FeSO4·7H2O 0.02g;分离培养基(1000mL):无机营养盐溶液中加入褐藻酸钠7g,(NH4)2SO45g,琼脂20g,pH7.2;产酶发酵培养基(1000mL):无机营养盐溶液中加入褐藻酸钠10g,蛋白胨5g,酵母粉1g,pH7.2;种子培养基同发酵培养基;褐藻酸钠 美国Sigma 公司;其他试剂均为国产分析纯;细菌基因组DNA 提取试剂盒及PCR 反应所用的相关试剂 均购自宝生物工程(大连)有限公司;凝胶回收试剂盒 北京博迈德科技发展有限公司。
LRH 系列生活培养箱、HWS24 型电热恒温水浴锅 上海一恒科学仪器有限公司;全温振荡培养箱 太仓市华美生化仪器厂;Veriti 型PCR 仪 美国ABI 公司;GelDoc-It 型凝胶成像仪 美国UVP 公司;Thermo Multiskan Ascent 酶标仪 芬兰Labsystems 公司;IX73型显微镜 日本Olympus 公司。
1.2 实验方法
1.2.1 菌株的分离 称取土壤或淤泥10g,放入盛有90mL 无菌水及玻璃珠的三角瓶中,220r/min 振荡15min 使样品充分分散,梯度稀释后涂布于含有褐藻酸钠的分离培养基平板。30℃倒置培养2~3d,挑取生长良好、形态不一的菌落进行多次划线纯化,并结合显微镜观察得到纯菌株。海水和淡水样品直接进行梯度稀释后涂布分离培养基平板。
1.2.2 产褐藻胶裂解酶菌株的初筛 将分离得到的菌株挑取一环,接种于50mL 产酶发酵培养基,30℃、150r/min 条件下培养,观察培养基粘度变化。培养4d 后取发酵上清液检测是否有酶活。
1.2.3 产褐藻胶裂解酶菌株的复筛 将初筛获得的产酶菌株挑取一环,接种于25mL 种子培养基,30℃、150r/min 摇床培养24h。种子液以2%的接种量转接于50mL 产酶发酵培养基,30℃、150r/min 培养。分别于1 ~6d 取样,将发酵液12000r/min 离心10min,取上清液作为粗酶液测酶活。
1.2.4 褐藻胶裂解酶活力的测定 酶活力测定采用3,5-二硝基水杨酸法(DNS)[9],以0.5%(w/v)褐藻酸钠为底物,测定发酵上清液中的褐藻胶裂解酶活力。酶活力单位定义为:每分钟释放1μmol 还原糖(以葡萄糖计)所需的酶量为一个酶活力单位(U)。发酵液酶活力单位定义为每毫升发酵液含酶活单位(U/mL)。
1.2.5 16S rDNA 序列测序与系统发育树的构建 将目的菌株接种于种子培养基中,30℃、150r/min 摇床培养20h,12000r/min 离心10min 收集菌体,按试剂盒操作步骤提取菌株的基因组DNA。采用通用引物27f(5'-AGAGTTTGATCM[C:A]TGGCTCAG-3')和1518r(5'-AAGGAGGTGATCCAN[A:C:G:T]CCR[A:G]CA-3')[10],以菌株基因组DNA 为模板进行16S rDNA 的PCR 扩增。PCR 反应条件为:95℃5min;94℃1min,55℃1min,72℃1.5min,30 个循环;72℃10min。PCR 扩增产物回收纯化后由宝生物工程(大连)有限公司测序。
将16S rDNA 测序结果在NCBI 核苷酸数据库中进行BLAST 检索(http://blast.ncbi.nlm.nih.gov/),选取同源性较高菌株的16S rDNA 序列,采用MEGA5.1软件选择模型,然后用BEAST v1.7.5 软件构建系统发育树[11-12]。
2 结果与分析
2.1 产酶菌株筛选
采用褐藻酸钠为唯一碳源的分离平板从海南样品中分离出菌株,然后将菌株接入发酵培养基进行初筛。初筛基于的原理是褐藻酸钠溶于水能形成粘稠状溶液,若菌株在含有褐藻酸钠的粘稠培养基中生长并使其粘度下降,说明菌株可以分解褐藻酸钠[13];同时若该菌株的培养基上清液用DNS 法检测到酶活,则进一步确认该菌株产褐藻胶裂解酶。采用双重指标进行初筛,能有效避免假阳性结果,该筛选模型的建立为今后的实验者提供了良好的参考依据。
通过初筛,获得了具有产褐藻胶裂解酶能力的10 个菌株,它们的来源见表1。从表1 可以看出,产褐藻胶裂解酶的菌群分布范围较宽,它们不仅存在于海水、腐烂海藻中,还存在于火山砂土、淡水河流泥沙中。
将初筛得到的10 株菌经种子培养后,转接于发酵培养基中,分别于第24、48、72、96、120、144h 检测发酵上清液中酶活。通过复筛,获得4 株具有较好产酶能力的菌株,编号分别为W14、S20、E03 和W13,它们的发酵液酶活随培养时间的变化如图1 所示。由图1 可以看出,4 株菌中菌株E03 的发酵液酶活最高(0.58U/mL),并且在培养48~72h 内其酶活呈现陡增态势,72h 后发酵液中酶活逐步下降。菌株S20 和W14 的最高发酵液酶活相当(0.23~0.27U/mL),但其产酶高峰期不同。菌株S20 在培养前期(24~48h)迅速达到产酶高峰,而此阶段W14 的发酵液检测不到酶活,直至培养中期(48~96h)W14 产酶显著增加至高峰。菌株W13 的发酵液酶活稍低(0.13U/mL),但其在培养72h 内产酶平稳。

图1 褐藻胶裂解酶活性变化曲线Fig.1 Activition curve of alginate lyases
2.2 菌落及菌株形态观察
菌株E03 单个菌落呈淡粉色半透明,圆形,隆起,表面光滑,边缘整齐,菌苔粘稠,容易形成融合状态菌落(图2A),革兰氏染色阴性,菌体呈球杆状,可见单个散生或形成两个聚集(图2E)。菌株S20 单个菌落呈橙黄色不透明,圆形,隆起,表面光滑,边缘整齐(图2B),革兰氏染色阴性,菌体为杆状,可见单个散生(图2F)。菌株W13 单个菌落呈白色半透明,圆形,隆起,表面光滑,边缘整齐(图2C),革兰氏染色阴性,菌体为杆状,两端钝园,可见单个散生或形成多个聚集(图2G)。菌株W14 单个菌落呈白色不透明,圆形,隆起,表面光滑,边缘整齐,菌苔粘稠,容易形成融合状态菌落(图2D),革兰氏染色阴性,菌体为杆状,可见单个散生或形成2~3 个聚集(图2H)。

图2 菌株E03、S20、W13 和W14 的菌落形态和显微形态(×1000)Fig.2 The colonial morphology and micrograph of four bacteria strains
2.3 16S rDNA 序列分析与系统发育树的构建
菌株E03、S20、W13 和W14 的16S rDNA 的PCR扩增产物大小均为1460bp 左右(图3),经测序后提交至 GenBank (登录号:KC777292、JQ886462、KC777293 和KC777294)。将4 个菌株的16S rDNA序列在NCBI 数据库进行BLAST 比对,然后分别选取同源性较高菌株的16S rDNA 序列,采用BEAST 软件构建了4 个菌株的系统发育树(图4)。从图4 上可以看出,发育树分为两大聚类分支,它们分别从属于拟 杆 菌 门 (Bacteroidetes ) 和 变 形 菌 门(Proteobacteria)。黄杆菌属(Flavobacterium)属于拟杆菌门,假单胞菌属(Pseudomonas)和弧菌属(Vibrio)均属于变形菌门。据推测,约25 亿年前变形菌门与其它门从共同祖先发生分歧[14],因此,在图4 的发育树上,假单胞菌属和弧菌属聚类的大分支在进化的较早时期就与黄杆菌属分开。假单胞菌属和弧菌分属于γ-变形菌纲(Gammaproteobacteria)中不同的目,因此,在图4 的发育树上,假单胞菌属分支和弧菌属分支于进化的较晚时期才分开。此外,图4 还显示了菌株S20 与黄杆菌属菌株聚类于同一分支,而菌株E03 落在假单胞菌属菌株聚类分支中,菌株W13和W14 则落在弧菌属菌株聚类分支中。虽然菌株W13 和W14 在此系统发育树上聚于同一小分支,但它们的产酶规律和菌落形态有明显差异,提示它们可能属于弧菌属内不同的种。由菌落形态特征结合16S rDNA 系统发育分析,初步确定菌株S20 属于黄杆菌属(命名为Flavobacterium sp.S20),菌株E03 属于假单胞菌属(命名为Pseudomonas sp.E03),菌株W13 和W14 属于弧菌属(分别命名为Vibrio sp.W13,Vibrio sp.W14)。
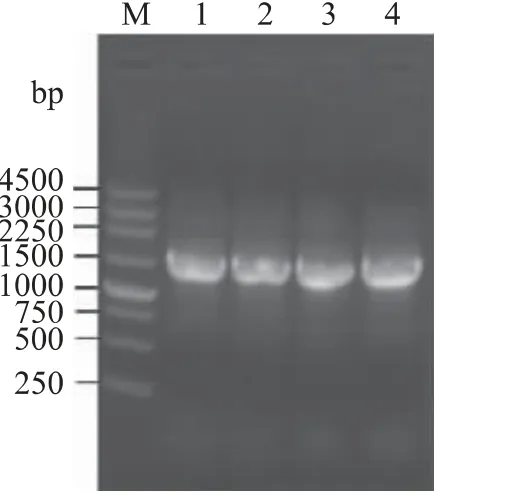
图3 菌株E03、S20、W13 和W14 的16S rDNA 电泳图谱Fig.3 Electrophoresis pattern of the PCR products of 16S rDNA of strains
微生物是褐藻胶裂解酶的重要来源,目前,在海洋细菌、土壤细菌、真菌中均发现有产褐藻胶裂解酶的菌种,其中假单胞菌属、弧菌属的产酶菌株报道较多[6],而黄杆菌属产酶菌株报道较少[9]。假单胞菌是典型的聚甘露糖醛酸片段裂解酶生产源,某些假单胞菌菌株还产其他类型的褐藻胶裂解酶,如Pseudomonas aeruginosa PAO1 产偏好降解MG 交替嵌段的裂解酶[15]。海洋弧菌也是很好的获取聚甘露糖醛酸片段裂解酶和聚古洛糖醛酸片段裂解酶的菌源[16-17]。黄杆菌菌株S20 产聚古洛糖醛酸片段裂解酶,并且研究发现该菌株还产其他类型的褐藻胶裂解酶[18]。本研究获得的假单胞菌新菌株E03、弧菌新菌株W13 和W14、黄杆菌新菌株S20 可作为获得不同类型褐藻胶裂解酶的菌种资源,为下一步酶的克隆表达,酶学性质研究以及酶法开发高价值化褐藻胶及其寡糖产品奠定基础。

图4 菌株E03、S20、W13 和W14 的16S rDNA 的序列系统发育树Fig.4 The phylogenetic tree based on 16S rDNA sequence of four bacteria strains
3 结论
本研究采用褐藻酸钠为唯一碳源的培养基,对采自海南的多类样品进行菌株分离,然后选用观察培养基粘度变化和酶活力检测的双重指标对菌株初筛,获得具有产褐藻胶裂解酶能力的10 个菌株。通过测定发酵液酶活随培养时间的变化,最终获得高产褐藻胶裂解酶且产酶规律显著差异的4 株菌。通过形态学结合16S rDNA 系统发育同源分析,初步鉴定菌株E03 属于假单胞菌属,菌株W13 和W14 属于弧菌属,而菌株S20 属于产褐藻胶裂解酶报道较少的黄杆菌属。
[1]Haug A,Larsen B,Smidsrød O.Studies on the sequence of uronic acid residues in alginic acid[J].Acta Chem Scand,1967,21:691-704.
[2]郭辽朴,李洪军.褐藻胶生物活性及在食品中应用的研究进展[J].四川食品与发酵,2007,43(6):9-12.
[3]Yamamoto Y,Kurachi M,Yamaguchi K,et al.Stimulation of multiple cytokine production in mice by alginate oligosaccharides following intraperitoneal administration[J].Carbohydr Res,2007,342(8):1133-1137.
[4]Tusi SK,Khalaj L,Ashabi G,et al.Alginate oligosaccharide protects against endoplasmic reticulum and mitochondrial mediated apoptotic cell death and oxidative stress [J].Biomaterials,2011,32(23):5438-5458.
[5]Kim HS,Lee CG,Lee EY.Alginate lyase:structure,property,and application[J].Biotechnol Bioprocess Eng,2011,16(5):843-851.
[6]Wong TY,Preston LA,Schiller NL.Alginate lyase:Review of major sources and enzyme characteristics,structure - function analysis,biological roles and applications [J].Annu Rev Microbiol,2000,54:289-340.
[7]Alkawash MA,Soothill JS,Schiller NL. Alginate lyase enhances antibiotic killing of mucoid Pseudomonas aeruginosa in biofilms[J].APMIS,2006,114(2):131-138.
[8]Wargacki AJ,Leonard E,Win MN,et al. An engineered microbial platform for direct biofuel production from brown macroalgae[J].Science,2012,335(6066):308-313.
[9]An QD,Zhang GL,Wu HT,et al.Properties of an alginatedegrading Flavobacterium sp. strain LXA isolated from rotting algae from coastal China[J].Can J Microbiol,2008,54(4):314-320.
[10]Kim DE,Lee EY,Kim HS,et al.Cloning and characterization of alginate lyase from a marine bacterium Streptomyces sp.ALG-5[J].Mar Biotechnol,2009,11(1):10-16.
[11]Tamura K,Peterson D,Peterson N,et al.MEGA5:molecular evolutionary genetics analysis using maximum likelihood,evolutionary distance,and maximum parsimony methods[J].Mol Biol Evol,2011,28(10):2731-2739.
[12]Drummond AJ,Suchard MA,Xie D,et al. Bayesian phylogenetics with BEAUti and the BEAST 1.7[J].Mol Biol Evol,2012,29(8):1969-1973.
[13]An QD,Zhang GL,Wu HT,et al.Production and partial properties of alginase from newly isolated Flavobacterium sp.LXA[J].Process Biochem,2008,43(8):842-847.
[14]Miller SR,Augustine S,Le Olson T,et al.Discovery of a free-living chlorophyII d-producing cyanobacterium with a hybrid proteobacterial/cyanobacterial small -subunit rRNA gene[J].PNAS,2005,102(3):850-855.
[15]Yamasaki M,Moriwaki S,Miyake O,et al.Structure and function of a hypothetical Pseudomonas aeruginosa protein PA1167 classified into family PL-7[J].J Biol Chem,2004,279(30):31863-31872.
[16]李京宝,于文功,韩峰,等.从海洋中分离的弧菌QY102褐藻胶裂解酶的纯化和性质研究[J].微生物学报,2003,43(6):753-757.
[17]Wang Y,Guo EW,Yu WG,et al. Purification and characterization of a new alginate lyase from a marine bacterium Vibrio sp.[J].Biotechnol Lett,2013,35(5):703-708.
[18]Huang LS,Zhou JG,Li X,et al.Characterization of a new alginate lyase from newly isolated Flavobacterium sp.S20[J].J Ind Microbiol Biotechnol,2013,40(1):113-122.
