几种物质对亚硝酸盐清除作用的比较
2013-08-07艾对元张卫兵冯丽丹齐燕姣贠建民郑惇元
艾对元,张卫兵,冯丽丹,齐燕姣,贠建民,毕 阳,郑惇元
(1.甘肃农业大学食品科学与工程学院,甘肃兰州730070;2.西北民族大学化工学院,甘肃兰州730030)
亚硝酸盐结晶为白色粉末,易溶于水。硝酸盐和亚硝酸盐在食品加工过程中主要用作发色剂、防腐剂及肉制品増香剂[1]。但亚硝酸盐具有较强的毒性,过量添加对人体有害[2]。同时其次生产物N-亚硝胺是一种致癌性很强的化合物[3]。因此,阻断亚硝胺合成[4]或消除亚硝胺的前体物质[5]是防治癌病产生的有效途径之一。目前有很多清除食品中亚硝酸盐的相关研究,最常采用的是果[6-7]、蔬品种[8],其含有的VC、茶多酚、黄酮类、色素和有机硫化物等物质能有效地阻断亚硝胺类化合物的合成[9]。我们从文献中筛选出抗坏血酸(VC)、儿茶酚、葡萄糖、牛血清白蛋白(BSA)等若干具还原性的可食性化合物,采用对氨基苯磺酸-盐酸萘乙二胺分光光度法,考察其对亚硝酸盐的清除能力。VC是公认的能够彻底清除亚硝酸盐的物质,它能还原亚硝酸盐[10];儿茶酚多数以衍生物的形式存在于自然界中[11]。水果及蔬菜中通常存在的有机酚,是植物鞣质的成分,在体内可氧化成醌,因此它具有极强的抗氧化性;BSA 结构中包含17 个二硫键和一个巯基[12],因此可与多种阳离子,阴离子和小分子结合[13];D-葡萄糖是自然界广为存在的一种还原性己醛糖。
1 材料与方法
1.1 材料与仪器
0.4%对氨基苯磺酸溶液、0.2%盐酸萘乙二胺溶液、200μg·mL-1亚硝酸钠标准溶液、5μg·mL-1亚硝酸钠标准使用液、0.2mol·L-1乙酸-乙酸钠缓冲溶液(pH3.6~pH5.8)、0.1mol·L-1盐酸 均为天津市光复科技发展有限公司所生产的“南开牌”分析纯药品。
UV-2450 紫外可见分光光度计 SHIMAD-ZU,日本岛津;WZ-100S 数显恒温水浴锅 上海一科仪器设备有限公司;电子天平XB1200C 上海精密仪器仪表有限公司;组织捣碎机DS-1 金坛市万华实验仪器厂;pHS-3C 型酸度计北京华瑞博远;FRESCO17 型离心机 Thermo,赛默飞世尔中国;恒温干燥箱101-2 上海实验仪器厂等。
1.2 标准曲线
参照张婕莉等方法[14],测得亚硝酸钠最大吸收波长为540nm。在此波长处亚硝酸盐浓度与吸光度值成良好的线性关系,实际测得线性回归方程Y =0.132X +0.0092,决定系数R2=0.9976。
Y =540nm 下的吸光值;X =亚硝酸盐标准使用液用量
1.3 亚硝酸盐的清除率测定
以樊明涛[15]的对氨基苯磺酸-盐酸萘乙二胺分光光度法为准,计算样液对亚硝酸盐的清除率公式如下:
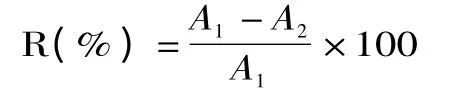
R:清除率(%);A1:未加样液亚硝酸钠的吸光度;A2:加提取液后亚硝酸钠的吸光度(已减去清除物质的吸收度)。
1.4 实验设计
单因素实验时,先考虑四种清除物质的浓度,设定VC的变动范围为0.01%~1%;其它三种的范围均定为0.01%~5%,与亚硝酸盐作用60min 后,观察清除效果。然后以各自最佳浓度为定值,变动反应时间,得出最适清除时间。以上反应均是在室温(20℃),自然pH 条件下进行;均匀实验设计采用4因素5 水平即U5(54)均匀表头(表1),在单因素得到的最适因素水平附近,共进行5 组10 次实验(表2),然后根据实验结果通过SPSS16.0(Release16.0.0(Sep,13,2007).copyright(c).SPSS-IBM.inc.,1989-2007)进行数学分析。
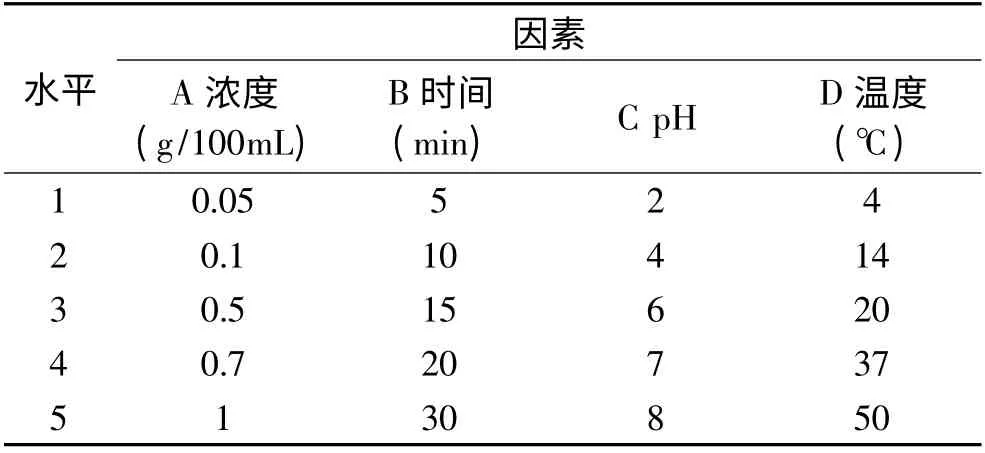
表1 抗坏血酸U5(54)均匀实验因素水平表Table 1 The uniform deseign U5(54)of VC

表2 儿茶酚U5(54)均匀实验因素水平表Table 2 The uniform deseign U5(54)of catechol
2 结果与分析
2.1 反应物浓度单因素实验
结果显示(图1、图2),四种反应物浓度对亚硝酸盐清除率均有一定的影响。随着反应浓度的增大,VC对亚硝酸盐的清除率也相应增加。当其浓度为0.5%~1%时,清除率趋于平缓,稳定在95%左右,浓度1%时清除率最大;儿茶酚对亚硝酸盐的清除率随其浓度呈线性增长,达到5%时清除率最大,接近60%;葡萄糖对亚硝酸盐的清除率成跳跃状改变,在浓度为5%时达到峰值,为8.32%;牛血清白蛋白对亚硝酸盐的清除率随其反应浓度呈S 形变化。当反应物浓度为0.5%时清除率达到9%,随后出现下降。因此,葡萄糖和BSA 对亚硝酸盐的清除能力均小于10%,清除效果不理想。

图1 不同浓度VC 对亚硝酸盐的清除作用Fig.1 Effect of the diffrent concentration of on the scavenging of nitrite

图2 儿茶酚、葡萄糖、BSA 不同浓度对亚硝酸盐的清除作用Fig.2 Effect of the 3 substances concentration on the scavenging of nitrite
2.2 反应时间单因素实验
在起始阶段,随着反应时间的延长,这四种物质对亚硝酸盐的清除率均逐渐增大。VC于60min 时清除率最大,为81.94%,随后稳定在80%左右(图3);儿茶酚于60min 时清除率最大,为41.59%,随后出现下降;葡萄糖于120min 时清除率最大,为7.90%;但是时间对BSA 的清除率影响不大,当60min 时其清除率达到峰值5.55%,随后稳定在5%左右。
对在不同反应液浓度、反应时间下葡萄糖、牛血清白蛋白对亚硝酸盐的清除率在0.01 的显著性水平下用SPSS16.0 做独立样本T-检验(表3)。可以看出,葡萄糖和BSA 对亚硝酸盐清除率的平均值分别为0.0578(5.78%),0.0685(6.85%)。根据单样本t检验,设置检验值为0.1(10%的清除率)时,它们的T检验值的伴随概率均都极显著的小于0.01,即它们的清除率期望值都不到10%,因此可以认为它们对亚硝酸盐无显著的清除能力。

表3 独立样本T-检验统计表Table 3 Independent sample T-test results

图3 四种物质不同时间对亚硝酸盐的清除作用Fig.3 Effect of the 4 substances reaction time on the scavenging of nitrite
2.3 均匀实验
因为葡萄糖和BSA 对亚硝酸盐无显著的清除能力,所以以反应液浓度(A),反应时间(B),反应pH(C),反应温度(D)4 个不同因素,根据均匀实验要求,结合单因素实验结果,通过U5(54)均匀表确定VC、儿茶酚实验方案,得到实验结果(表4、表5)及回归方程(表6、表7)。
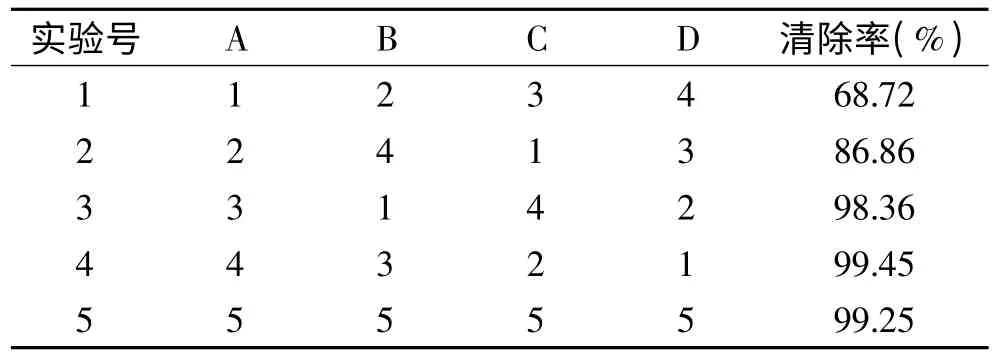
表4 VC U5(54)均匀实验结果Table 4 U5(54)uniform experiment results of VC
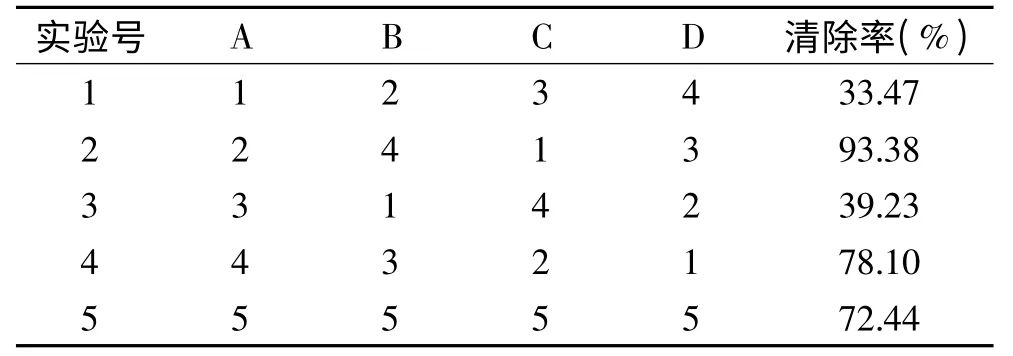
表5 儿茶酚U5(54)均匀实验结果Table 5 U5(54)uniform experiment results of catechol
实验结果通过SPSS16 分析,确定均匀实验当中抗坏血酸对亚硝酸盐清除率的线性回归方程为:Y =-0.0815-1.0470X1+0.0625X2+0.2532X3-0.0356X4,方程的决定系数R2=0.9984,方程的总体显著性p =3.60 ×10-7,说明此方程线性拟合很好,具有极显著意义(表6);儿茶酚对亚硝酸盐清除率的线性回归方程为:Y =0.3991-0.0784X1+0.0204X2-0.0113X4,此方程R2=0.9985,p =7.49E-09,线性拟合很好,且具有极显著意义(表7)。从以上2 个均匀实验线性模拟来看,X1即清除剂浓度对清除率影响极显著,当然浓度值有一定限度,所以其系数是负值;X2即反应时间,它与清除率呈正相关,时间越长,清除作用越彻底;X3即pH,对VC的影响极显著,因为当溶液变成碱性时,VC的结构将被破坏,只有在酸性条件下,其清除作用才最有效[16]。但pH 对儿茶酚却没有显著影响;最后是X4即反应温度,其系数是负值,表明低温有利于清除作用。因此,调整清除剂浓度,延长反应时间,控制反应液的pH,降低反应温度等条件,是提高亚硝酸盐清除率的重要手段。通过模型计算,当VC浓度<0.7%,反应时间>15min,4 <pH <8,温度<4℃时,清除率>=100%,这点不难从VC均匀实验结果第四项得到验证,实际清除率达到99.45;同理,对于儿茶酚,利用该线性模型预测,其浓度<1%,反应时间>40min,温度<15℃时,清除率>=100%。而儿茶酚均匀实验结果第2 项显示实际清除率为93.38%。因此,这二种模型都是比较理想的,可以作为VC、儿茶酚清除亚硝酸盐的数学表达。
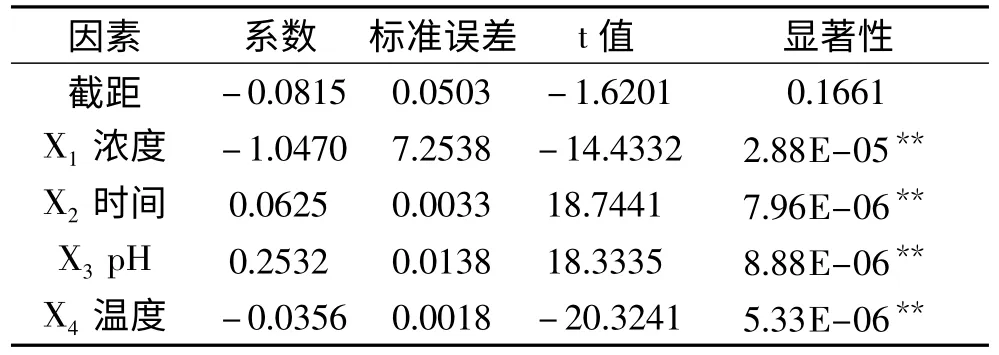
表6 VC的回归方程方差分析Table 6 Multiple linear regression analysis of VC

表7 儿茶酚的回归方程方差分析Table 7 Multiple linear regression analysis of catechol
3 讨论与结论
3.1 讨论
根据现有的研究结果,表明亚硝酸盐的清除主要有两种方式,一种是酶降解途径,另一种是非酶降解途径[17]。酶降解途径可以通过细菌的亚硝酸盐还原酶将其还原成NO,NH3。另外就是被机体的一些黄嘌呤氧化还原酶(Xanthine oxidoreductase),亚硝酸盐还原酶(Nitrite reductase),NO 合成酶(NO synthase(NOS))等还原成NO[18]。而NO 可以促进血管扩张及血液循环,业已被证明是一种存在于动植物中的信号分子,而且被应用于医疗药物中。非酶降解途径是通过一些强还原性物质如VC、黄酮类[19]及杂环类等物质,将其还原成成NO,N2O,H2N2O2,N2等物质[20],从而降解亚硝酸盐。从实验结果来看,VC、儿茶酚对亚硝酸盐的清除效果分别达到99.45%,93.38%;理论预测它们可以彻底地清除亚硝酸盐。因为这二种物质都属于强还原剂。儿茶酚是邻苯二酚,属于多羟基酚;而VC化学官能团里含有-NH2,-OH及还原性羰基及酚基,所以他们可以通过非酶方式清除亚硝酸盐,而且它们的清除作用与时间正相关,这更加说明非酶反应随时间而逐步完成[21]。同时,VC、儿茶酚是大多数氧自由基的清除剂,因而能阻断亚硝胺的合成。而葡萄糖和BSA 对亚硝酸盐的清除率最高只有8.32%、10.93%(单因素实验中出现的最大值,未做算数平均),葡萄糖存在于日常饮食及机体内,而BSA 类似于人的免疫球蛋白,它们均不能还原亚硝酸盐。因此,只有一些高还原性的生物活性物质如黄酮类、多糖、色素等[22],才能有效清除亚硝酸盐。
3.2 结论
从反应液浓度、反应时间等条件看来,葡萄糖、牛血清白蛋白这两种物质,对亚硝酸盐的清除能力作用不明显,均显著低于10%。均匀实验结果表明,抗坏血酸的浓度为0.7%、反应时间15min、反应pH4、反应温度4℃时,对亚硝酸盐的清除率最大,达到99.45%;儿茶酚的反应浓度为1%、反应时间40min、反应pH2、反应温度20℃时,其对亚硝酸盐的清除率最大,达到93.38%。通过均匀实验得到的线性模型表明,VC、儿茶酚都可以彻底清除亚硝酸盐。
[1]南庆贤.肉类工业手册[M].北京:中国轻工业出版社,2003:205-210.
[2]Fennema O R.Food Chemistry(2nd edition)[M].Revised and Expanded,1985:645-646.
[3]曹会兰.亚硝酸盐对人体的危害和预防[J].微量元素与健康研究,2003,(2):78-80.
[4]Jakszyn P,Gonzalez C A.Nitrosamine and related food intake and gastric and oesopHageal cancer risk:A systematic review of the epidemiological evidence [J] . World journal of gastroenterology,2006,12(27):4296-4303.
[5]卢志强,娄红祥.植物活性成分与癌症的化学预防[J].中草药,2002,33(6):563-566.
[6]Jung-Hye S,Jun-Yeal L,Jong-Chan J,et al.Chemical Properties and Nitrite Scavenging Ability of Citron(Citrus junos[J]Journal of the Korean Society of Food Science and Nutrition,2005,34(4):496-502.
[7]艾对元,冯丽丹,齐燕姣,等.柠檬对亚硝酸盐清除作用的研究[J].中国食品工业,2013,(2):52-55.
[8]冯丽丹,李捷,艾对元.几种常见果蔬对亚硝酸盐清除能力的研究[J].甘肃农业大学学报,2011,46(2):139-142.
[9]Choi S Y,Chung M J,Lee S J,et al.N-nitrosamine inhibition by strawberry,garlic,kale,and the effects of nitrite-scavenging and N - nitrosamine formation by functional compounds in strawberry and garlic[J].Food Control,2007,18(5):485-491.
[10]薛丽,蓝红英.VC对降低香肠亚硝酸钠残留量的研究[J].食品科技,2006,(6):65-66.
[11]Seung-Cheol L,So-Young K,Seok-Moon J,et al.Effect of Far- Infrared Irradiation on Catechins and Nitrite Scavenging Activity of Green Tea[J]. Journal of Agricultural and Food Chemistry 2005,54(2):399-403.
[12]Bushra H M,Munaf H Z,Ihab I A,et al.Free radical scavenging activity of silibinin in nitrite- induced hemoglobin oxidation and membrane fragility models [J] . Saudi pHarmaceutical Journal,2011,19(3):177-183.
[13]Pietraforte D,Salzano A M,Scorza G,et al.Scavenging of reactive nitrogen species by oxygenated hemoglobin:globin radicals and nitrotyrosines distinguish nitrite from nitric oxide reaction[J].Free Radical Biology and Medicine,2004,37(8):1244-1255.
[14]张捷莉,丁博,刘志强,等.几种肉制品中亚硝酸盐含量的测定[J].食品科技,2006(9):242-224.
[15]樊明涛.食品分析与检验[M].西安:世界图书出版西安公司,1998.204-207.
[16]Takahama U,Hirota S,Kawagishi S.Effects of pH on nitriteinduced formation of reactive nitrogen oxide species and their scavenging by pHenolic antioxidants in human oral cavity[J].Free Radical Research,2009,43(3):250-261.
[17]Ivanov V M.The 125th Anniversary of the Griess Reagent[J].Journal of Analytical Chemistry,2004,59(10):1002-1005.
[18]Kazuyasu S,Kazuki K,Hitoshi A,et al.Luteolin:A Strong Antimutagen against Dietary Carcinogen,Trp-p-2 in Peppermint,Sage,and Thyme[J].J Agric Food Chem,1995,43(2):410-414
[19]Jun L,Songyi L,Zuozhao W. et al. Supercritical fluid extraction of flavonoids from Maydis stigma and its nitrite -scavenging ability[J].Food and Bioproducts Processing,2011,89(4):333-339.
[20]Feelisch M,Fernandez B,Bryan N,et al.Tissue processing of nitrite in hypoxia:an intricate interplay of nitric oxide-generating and-scavenging systems[J].Journal of Biological Chemistry,2008,283(49):33927-33934.
[21]Jae S C,Si H P,Jin-Ho C.Nitrite scavenging effect by flavonoids and its structure-effect relationship[J]Archives of pharmacal Research,1989,12(1):26-33.
[22]Jin-Hyun K,Ki-Moon P.Nitrite scavenging and superoxide dismutase-like activities of herbs,spices and curries[J].Korean journal of food science and technology,2000,32(3):706-712.
