鱼露中章鱼胺的分离提取研究
2013-08-07曲映红刘志东陈舜胜
曲映红,刘志东,陈舜胜,*
(1.上海海洋大学,上海水产品加工及贮藏工程技术研究中心,上海201306;2.中国水产科学研究院东海水产研究所,上海200090)
章鱼胺(Octopamine,OA),是脊椎动物激素去甲肾上腺素的一个同类物,具有对-羟苯-β-羟乙胺的化学结构,又名章鱼涎胺或真硝胺,化学名为:1-(4-羟基苯基)-2-氨基乙醇,化学式为C8H11NO2,分子量为153.176。章鱼胺首先由Espamer 和Boretti在章鱼(Octopusvulgaris)的唾液中发现而得名[1]。章鱼胺是一种天然的β3-肾上腺素能受体激动剂[2],在肥胖症的治疗和II 型糖尿病的防治上有潜在的应用价值[3]。近来来,关于章鱼胺的生物活性[4-5]和检测方法[6-7]的研究日趋活跃。天然章鱼胺也存在于枳实和鱼露中,且鱼露中的含量相对丰富[8]。在前期实验[9]中发现,利用智利外海茎柔鱼内脏酿制的鱼露中章鱼胺含量很高,可达6000 ~7000μg·mL-1。朱婷婷[10]研究发现H103 大孔吸附树脂对鱼露中章鱼胺有较好的吸附分离效果,该树脂对鱼露中章鱼胺的静态饱和吸附量达2.925mg·g-1(干树脂),用30%的乙醇作洗脱液,洗脱率达98.04%。王敏[11]用硅胶吸附分离鱿鱼内脏水解液中的章鱼胺,静态饱和吸附量为3.209mg·g-1(干硅胶),采用30%的乙醇为洗脱剂时,洗脱率达95.32%。由于H103 大孔吸附树脂的处理过程中要使用盐酸、丙酮、甲醇等试剂,因此从食品安全的角度考虑,本研究选用硅胶来分离提取鱼露中的章鱼胺。鱼露中所含的章鱼胺是具有较高生物活性的纯天然章鱼胺,本实验旨在探讨从鱼露中提取章鱼胺的有效方法,以期为合理开发利用智利外海茎柔鱼废弃物提供科学依据。
1 材料与方法
1.1 材料与仪器
鱼露 以茎柔鱼内脏为原料40℃保温速酿的鱼露。制备方法如下:茎柔鱼内脏切块、绞碎,加入盐(加入量为茎柔鱼内脏重量的20%)、水(料液比为1∶1),搅匀装桶,盖上5 层纱布,40℃保温酿制3 个月。鱼露原浆较为粘稠,先用两层脱脂纱布过滤,再用布氏漏斗抽滤,得到澄清透明的鱼露备用。章鱼胺标准品(盐酸盐) Sigma 公司;磷酸二氢钠、柠檬酸、氢氧化钠、乙醇、硅胶(60~100 目,100~200 目和200~300 目) 分析纯,上海化学试剂采购供应站。
HWS12 型电热恒温水浴锅 上海一恒科技有限公司;层析柱;智能蠕动泵;LGJ-10 台式压盖型真空冷冻干燥机 北京松源华兴科技发展有限公司;SCL-10A vp 高效液相色谱仪,SPD-10A vp 紫外检测器,SIL-10ADvp 自动进样器,CLASS-VP 工作站 岛津国际贸易(上海)有限公司;Alliance 2695 Quattro micro 液相色谱串联质谱联用仪 Waters 公司。
1.2 静态吸附性能考察
1.2.1 饱和吸附量的测定 参考文献[11]的方法。精密称取60~100、100~200、200~300目三种规格的硅胶各约1g,分别置于50mL 的带盖塑料管中,准确加入10mL 鱼露,2h 内每隔5min 震荡10s,然后静置24h,使硅胶达到饱和吸附。尽量不摇动试管,使硅胶保持在试管底部,小心吸取上层溶液并测定章鱼胺浓度。硅胶在室温下的饱和吸附量按下式计算:饱和吸附量=(吸附前鱼露中章鱼胺浓度一吸附后鱼露中章鱼胺浓度)×鱼露体积/硅胶干重。在其后的实验中选用吸附量最大的硅胶分离鱼露中的章鱼胺。
1.2.2 洗脱率的测定 参考文献[10]的方法。从食品安全、经济角度及前期的研究结果综合考虑,选用乙醇的水溶液作为洗脱剂。取7 支50mL 的带盖塑料管,分别加入精密称取的硅胶(1.2.1 中吸附量最大的硅胶)约1g,准确加入鱼露5mL,每隔5min 震荡10s,共2h,然后静置24h,分离树脂,对应加入浓度分别为10%,20%,30%,40%,50%,70%,90%的乙醇水溶液各20mL,每隔5min 震荡10s,共2h,测洗脱液浓度,计算洗脱率。洗脱率(%)计算公式为:洗脱率=(洗脱液浓度×洗脱液体积)/饱和吸附量×100。在其后的实验中选用洗脱率最大的乙醇溶液作为洗脱剂。
1.3 动态吸附性能考察
1.3.1 动态吸附 参考文献[11]的方法。将1.2.1中静态饱和吸附量最大的硅胶湿法装柱,选用的层析柱直径2cm,硅胶柱高度24cm,故柱体积约75mL。用智能蠕动泵控制鱼露以1BV·h-1的流速上柱。收集柱底流出的鱼露,每50mL 取最后1mL,用HPLC法测定章鱼胺含量。
1.3.2 动态洗脱 参考文献[12]的方法。达到饱和吸附的硅胶柱底以蠕动泵抽5min,除去可能残存的鱼露,以前述静态洗脱时洗脱率最大的乙醇溶液作为洗脱剂,用蠕动泵控制其流速为1BV·h-1,收集洗出液,每5mL 一管,测定各收集管洗出液中章鱼胺的浓度。
1.4 章鱼胺的精制和定性鉴定
将收集的各管洗出液混合在一起,旋转蒸发至约10mL,采用岛津SCL-10A vp HPLC 分离系统进行精制,色谱条件为:采用Sepax HP-C18(21.2mm ×250mm,10μm)色谱柱,流动相为0.02mol·L-1柠檬酸-0.02mol·L-1磷酸二氢钠(7 ∶3),pH3,流速10mL·min-1,检测波长274nm。收集出峰时的流出液,真空冷冻干燥后用质谱做定性鉴定。
将章鱼胺标准品和冻干后得到的白色粉末状物质分别配制成1ppm 的甲醇溶液进行质谱分析。使用高分辨率质谱可得知离子的精确质量数,然后以参照物作峰匹配可以确定分子式和分子量。使分子和离子中的各种化学键断裂后可形成碎片离子,籍此可推断出分子和离子的裂解方式,从而得到它们的结构信息。本研究所采用的质谱条件是:电喷雾离子源(ESI),温度120℃;脱溶剂气和锥孔气N2;脱溶剂气流速500L h-1,脱溶剂温度350℃;锥孔电压20V,锥孔气流速50L·h-1;毛细管电压3.50kV;碰撞气体氩气;扫描方式为正离子扫描;碰撞能量分别为5、10、20eV。
2 结果与分析
2.1 硅胶对鱼露中章鱼胺的静态吸附
三种不同目数的硅胶对鱼露中章鱼胺的静态饱和吸附量如图1 所示。结果表明:60~100、100~200、200~300目的硅胶对鱼露中章鱼胺的饱和吸附量分别为:3.8372、3.0429、1.6539mg·g-1(干硅胶)。可以看出,60~100目硅胶对鱼露中章鱼胺的饱和吸附量明显高于其他两种硅胶,因此在后续实验中选用60~100目硅胶分离鱼露中的章鱼胺。
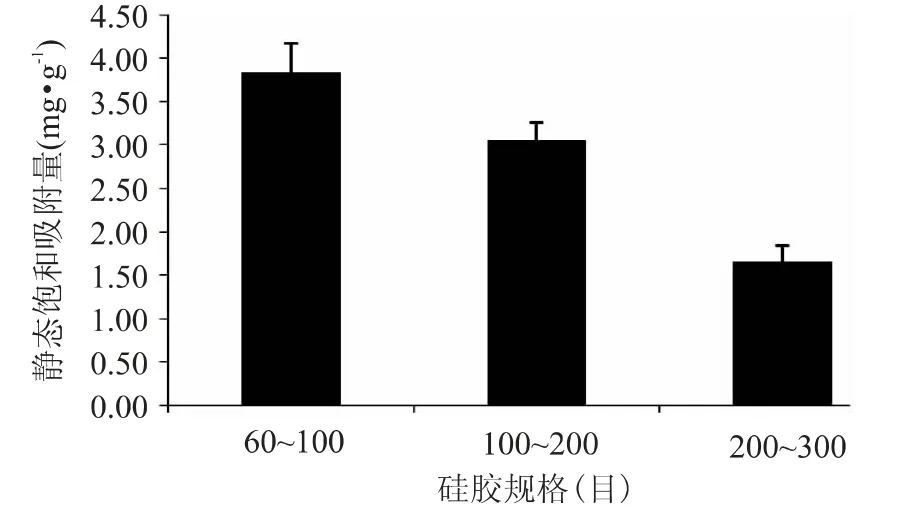
图1 三种规格的硅胶对鱼露中章鱼胺静态饱和吸附性能比较Fig.1 Comparison of statically saturated adsorption performance on the three kinds of silica gel
2.2 乙醇洗脱剂浓度的选择
以乙醇水溶液为洗脱剂时测得的静态洗脱率详见表1。结果表明随乙醇浓度的增加,章鱼胺的洗脱率很快上升,以30%乙醇为洗脱剂时的洗脱率最高,达90.48%,之后随浓度增大洗脱率降低。据此,在动态洗脱时就选用30%乙醇水溶液作为洗脱剂。
2.3 硅胶对鱼露中章鱼胺动态吸附性能的研究
60~100目硅胶对鱼露中章鱼胺动态吸附结果见表2,当60~100目硅胶处理的鱼露为硅胶本身的2BV 时,即上样鱼露体积为150mL 时,上样后鱼露中的章鱼胺浓度为1.546mg·mL-1;上样鱼露体积300mL(4BV)时,上样后鱼露中的章鱼胺浓度为4.112mg·mL-1;发现在上样量在300~350mL 时,上样后鱼露中的章鱼胺浓度已接近上样前浓度,可认为硅胶对章鱼胺的吸附已接近饱和,故认为60~100目硅胶对鱼露中章鱼胺动态吸附的最佳上样量为4BV。

表1 洗脱剂的不同浓度对洗脱率的影响Table 1 Effect of different eluent concentration on the elution rate
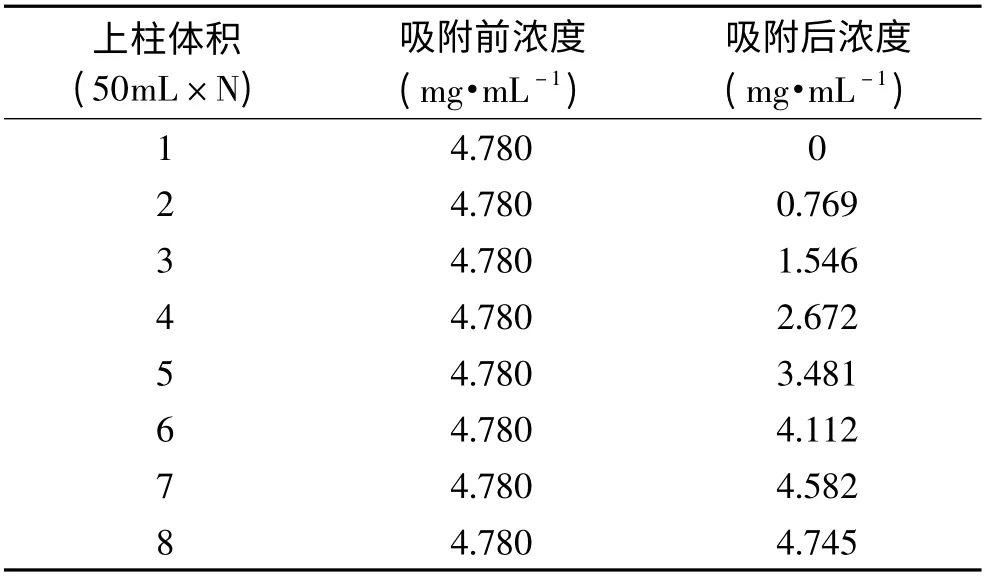
表2 60~100目硅胶对章鱼胺的动态吸附效果Table 2 Dynamic adsorption capacity of 60~100mesh silica gel for octopamine
2.4 硅胶对鱼露中章鱼胺的动态洗脱
以洗出液体积为横坐标,以洗出液中章鱼胺浓度为纵坐标作图可说明洗脱液(30%的乙醇溶液)对硅胶柱上章鱼胺的动态洗脱情况,如图2 所示。从图中可以看出,洗出液体积达到40mL 时,洗出液中章鱼胺浓度达到最大值,并随洗脱液体积的增加而逐渐下降,到75mL 时洗出液中的章鱼胺浓度已降至0.5mg·mL-1以下,这时可以认为硅胶柱上吸附的章鱼胺已基本上被洗脱下来,此时洗脱液上样量为82.5mL,即1.1BV。

图2 硅胶对章鱼胺的动态洗脱曲线Fig.2 Dynamic desorption curve of silica gel for octopamine
2.5 精制冻干后章鱼胺的质谱分析
章鱼胺标准品和提取得到的章鱼胺冻干样品分别被不同的碰撞能量轰击,得到的质谱图如图3 和图4 所示,其中图3a~图3c 分别为碰撞能量为20、10、5eV 时章鱼胺标准品的质谱图,图4a~图4c 分别为碰撞能量为20、10、5eV 时章鱼胺冻干样品的质谱图。由图中可以看到章鱼胺冻干品与标准品的质谱图基本一致,因此可认为冻干后得到的物质为纯度较高的章鱼胺。
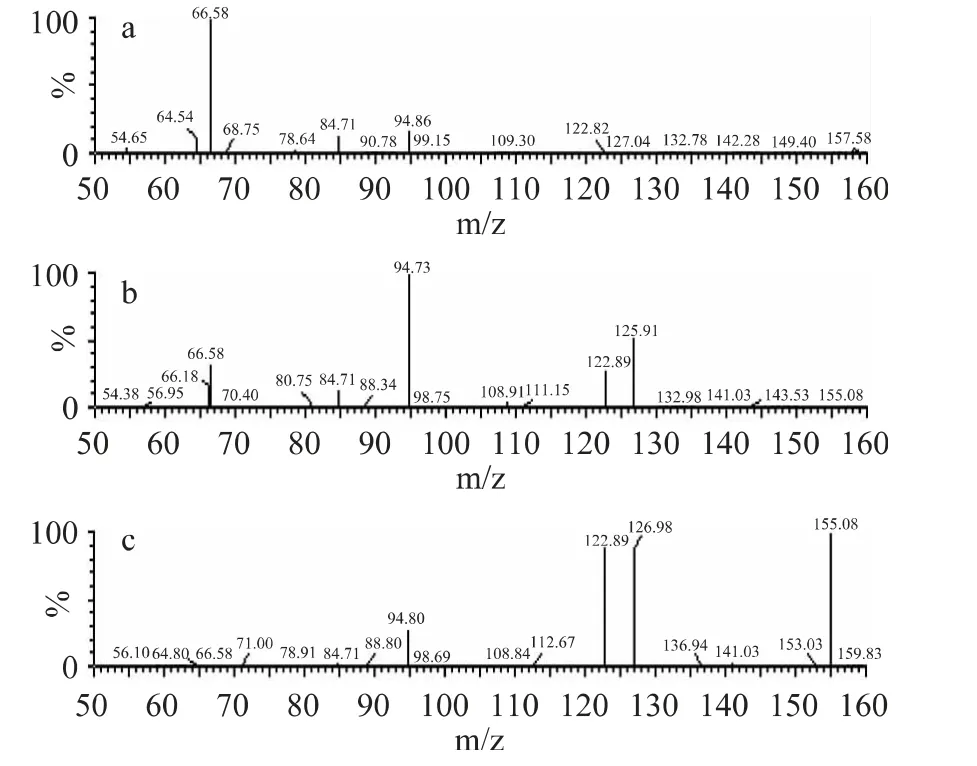
图3 章鱼胺标准品质谱图Fig.3 Mass spectra of octopamine standard
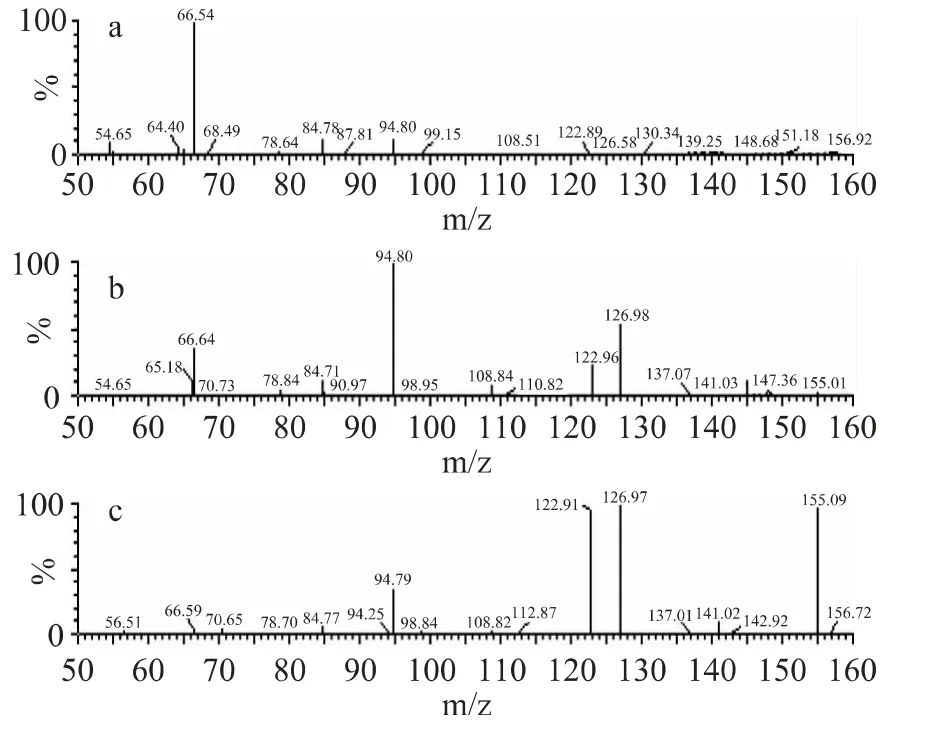
图4 章鱼胺样品质谱图Fig.4 Mass spectra of octopamine sample
3 结论
本实验利用智利外海茎柔鱼内脏为原料,经保温速酿制备鱼露,再经硅胶柱吸附、乙醇洗脱、高效液相色谱精制并冻干后,得到了较高浓度的天然章鱼胺粉末。本研究发现60~100目硅胶对鱼露中章鱼胺的静态饱和吸附量达3.837mg·g-1(干硅胶),以30%的乙醇为洗脱剂时,洗脱率达90.48%。60~100目硅胶对鱼露中章鱼胺动态吸附的最佳上样量为4BV,动态洗脱时用1.1BV 洗脱液可基本洗脱完全。
鱼露中章鱼胺的含量较为丰富,高于其他许多水产品。从鱼露中有效提取章鱼胺并进行精制,可以为进一步开发利用天然章鱼胺打下基础。从智利外海茎柔鱼内脏速酿鱼露中提取章鱼胺,可使废弃物得以综合利用,减少资源浪费和环境污染。实验过程中所用硅胶、洗脱剂等安全无毒,可为制备食用级的章鱼胺产品提供依据。
[1]潘灿平,李维喜,张卢军,等.昆虫体内章鱼胺的分布功能及其研究进展[J].昆虫知识,2005,42(4):369-374.
[2]Carpene C,Galitzky J,Fontana E,et al.Selective activation of beta3 - adrenoceptors by octopamine:comparative studies in mammalian fat cell[J].Naunyn Schmiedebergs Arch Pharmacol,1999,359(4):310.
[3]Arch JRS.β3-Adrenoceptor agonists:potential,pitfalls and progress[J]. European Journal of Pharmacology,2002,440(1):99.
[4]曲映红,杨佳华,陈舜胜.章鱼胺衍生物的合成及抗氧化活性研究[J].中国海洋药物杂志,2012,31(3):37-40.
[5]吴顺凡,郭建洋,黄佳,等.昆虫体内章鱼胺和酪胺的研究进展[J].昆虫学报,2010,53(10):1157-1166.
[6]陈丹红.HPLC 法同时检测章鱼胺和牛磺酸的研究[J].食品科技,2011,36(1):259-261.
[7]邱伟强,陈舜胜,王建中,等.人血清肾上腺素能受体激动剂章鱼胺测定方法的研究[J].时珍国医国药,2010,21(6):1379-1380.
[8]王敏,陈舜胜,王锡昌,等.水产品可食部章鱼胺含量的研究[J].中国海洋药物,2009,28(1):44-47.
[9]曲映红,王敏,刘志东,等.利用智利外海茎柔鱼内脏速酿鱼露的研究[J].中国海洋药物,2011,30(1):50-52.
[10]朱婷婷,荣艳萍,陈舜胜,等.鱼露中章鱼胺分离方法的研究及对风味的影响[J].中国海洋药物,2008,27(3):18-23.
[11]王敏.水产品中章鱼胺含量的比较及D 型章鱼胺的分离制备[D].上海:上海海洋大学,2010.
[12]向大雄,李焕德,朱叶超,等.大孔吸附树脂分离纯化葛根总黄酮的研究[J].中国药学杂志,2003,38(1):35-37.
