豆渣RNA 及其酶解物对小鼠免疫功能的影响
2013-08-07邵美丽陈慧燕
邵美丽,陈慧燕,李 娜
(东北农业大学食品学院,黑龙江哈尔滨150030)
豆渣是大豆制品产业的主要副产物,目前有关豆渣的深加工利用非常局限,主要集中在膳食纤维、异黄酮和维生素E 等活性物质的开发方面[1-3]。随着大豆产量的不断增加和大豆加工行业的迅速发展,豆渣的综合利用和深度开发成为急需解决的问题。核糖核酸(ribonucleic acid,RNA)是细胞内的重要成分,研究表明核糖核酸及核糖核苷酸对免疫系统正常功能、肠道生长发育、肝组织功能及脂代谢都有重要影响[4-8]。我国可提供的核酸资源较单一,工业上主要以废啤酒酵母作为原料提取RNA,但由于获取原料困难,不能满足市场需要[9]。而豆渣中的核酸含量也不亚于酵母核酸,且豆渣价格低廉,来源丰富,是天然优质的核酸资源[10]。故本实验室开展了有关豆渣RNA 制备、酶解及其功能方面的研究。本文主要利用实验室前期制备好的豆渣RNA[11]及其酶解物,研究二者对小鼠的细胞免疫、体液免疫及非特异性免疫功能的影响,并比较二者免疫调节作用的差异,以期为豆渣资源的深度开发提供科学依据。
1 材料与方法
1.1 材料与仪器
Balb/c 小白鼠(清洁级,8 周龄,体重(18 ±2)g,雌雄各半) 哈尔滨兽医研究所;豆渣RNA 及其酶解物 实验室自制;刀豆蛋白A 天津市恒兴化学试剂制造有限公司;四甲基偶氮唑盐 天津博迪化工股份有限公司;RPMI1640 细胞培养液 天津市致远化学试剂有限公司;小牛血清 杭州四季青生物工程公司;SRBC 哈尔滨兽医研究所;豚鼠补体 实验室自制;印度墨汁 北京市西中化工厂。
BIO RAD 680 酶联免疫检测仪 美国Labconco公司;TE2000 倒置显微镜 OLYMPUS 公司;MR23i低温冷冻离心机 法国Jouan 公司。
1.2 实验方法
1.2.1 动物分组及给药 小白鼠随机分为7 组,分别为正常对照组(生理盐水)、豆渣RNA 高剂量组(10.0mg/mL)、豆渣RNA 中剂量组(1.0mg/mL)、豆渣RNA 低剂量组(0.1mg/mL)、豆渣RNA 酶解物高剂量组(10.0mg/mL)、豆渣RNA 酶解物中剂量组(1.0mg/mL )、豆渣 RNA 酶解物低剂量组(0.1mg/mL)。每组12 只,雌雄各半。每只每日灌胃0.5mL 受试物,连续30d,自由采食和饮水。
1.2.2 脏器指数的测定 参照文献[12],实验结束,处死小鼠,取胸腺和脾脏,用滤纸吸干表面血污,分别称重,并按公式计算胸腺指数、脾脏指数。计算公式如下:

1.2.3 脾淋巴细胞增殖反应(MTT 法) 参照文献[13],实验结束,无菌取小鼠脾脏,置于平皿内200目的不锈钢网上。用注射器针芯研磨,加入RPMI1640 培养液冲洗。将上述细胞悬液转入2 倍体积的淋巴细胞分离液,1000r/min 离心10min,吸取中间的白膜层(单个核细胞层),用RPMI1640 培养液洗涤2 次后,计数,并调整浓度至1 ×106/mL。
将上述制备的脾细胞悬液分两孔加入24 孔培养板中,每孔1mL,其中一孔加ConA(5.0μg/mL),另一孔作对照,置5% CO2,37℃CO2孵箱中培养72h。培养结束前4h,每孔吸取上清液0.7mL,加入0.7mL不含小牛血清的RPMI1640 培养液,同时加入MTT(5mg/mL)50μL/孔,继续培养4h。培养结束后,每孔加入1mL 酸性异丙醇,吹打混匀,使紫色结晶完全溶解。然后分装到96 孔培养板中,每组设3 个平行孔,测OD570值,用加ConA 孔的光密度值减去不加ConA 孔的光密度值代表淋巴细胞的增殖能力。
1.2.4 小鼠迟发型超敏反应(DTH)检测 参照文献[14],实验结束,用20%(v/v)SRBC 悬液注射在小鼠右侧足垫皮下,每鼠50μL,同时左侧注射50μL 生理盐水。24h 后,用游标卡尺测定小鼠左右足垫厚度,以左右足垫厚度之差为肿胀程度,同一部位测量3 次,取平均值。
1.2.5 小鼠脾抗体生成细胞检测(定量溶血分光光度法) 参照文献[15],于实验第26d,向小鼠腹腔注射2%绵羊红细胞(SRBC)0.2mL。第30d 处死小鼠,取脾脏并按照1.2.3 方法制备脾细胞悬液。然后取脾细胞悬液1mL,依次加入补体和0.2% SRBC 各1mL,于37℃温浴1h,3000r/min 离心10min,取上清,测OD413值。
1.2.6 单核-巨噬细胞功能的测定(碳廓清实验)参照文献[16],实验结束,小鼠尾静脉注射稀释的印度墨汁0.05mL。并分别于2、10min 后内毗静脉丛采血2μL,并将血样迅速吹到2mL 的0.1%碳酸钠溶液中,然后测OD619值。按照下列公式计算碳粒廓清指数K 及吞噬指数α。
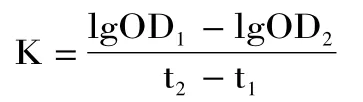
OD1:2min 时的吸光值;OD2:10min 时的吸光值;t1:2min;t2:10min。

2 结果与分析
2.1 豆渣RNA 及其酶解物对小鼠免疫器官重量的影响
胸腺和脾脏是机体内重要的免疫器官,与机体的细胞、体液免疫关系密切。当对机体使用免疫增强剂时会增加胸腺和脾脏的重量,故在一定程度上,胸腺和脾脏的重量可反映机体免疫功能的强弱,因此测量其重量可作为判断机体免疫功能的辅助指标[17]。豆渣RNA 及其酶解物对小鼠免疫器官的影响如图1 所示。

图1 豆渣RNA 及其酶解物对小鼠免疫器官重量的影响Fig.1 Effect of okara RNA and hydrolysates on viscera index in mice
由图1 可知,豆渣RNA 及其酶解物组各剂量组的胸腺指数虽然较对照组有所增加,但无显著性差异(p >0.05),表明豆渣RNA 及其酶解物对胸腺无明显影响。而豆渣RNA 及其酶解物组各剂量组的脾脏指数均显著高于对照组(p <0.05),其中酶解物中、高剂量组极显著高于对照组(p <0.01)。同时,酶解物高剂量还极显著高于RNA 各剂量组(p <0.01),表明豆渣RNA 及其酶解物均可明显促进小鼠脾脏生长,并在剂量范围内呈现明显的剂量效应关系,其中酶解物高剂量组效果最优。
2.2 豆渣RNA 及其酶解物对小鼠脾淋巴细胞增殖反应的影响
脾脏是各类免疫细胞居住的场所,也是对抗原物质产生免疫及产生免疫效应物质的重要基地。伴刀球蛋白(con A)可以选择性地刺激T 淋巴细胞使之增殖,因此通过测定伴刀球蛋白诱导的脾淋巴细胞增殖能力可以反映机体的细胞免疫功能[18]。豆渣RNA 及其酶解物对小鼠脾淋巴细胞增殖反应的影响如图2 所示。
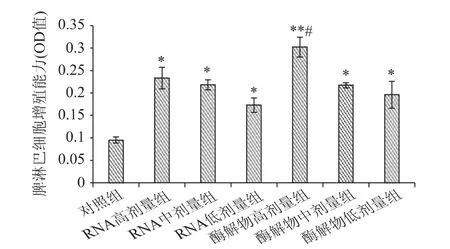
图2 豆渣RNA 及其酶解物对小鼠脾淋巴细胞增殖反应的影响Fig.2 Effect of okara RNA and hydrolysates on lymphocyte transformation in mice
由图2 可以看出,与对照组相比,豆渣RNA 及其酶解物各剂量组均能显著提高小鼠脾淋巴细胞增殖能力(p <0.05),而且二者均呈现明显的剂量效应关系。其中,酶解物高剂量组极显著高于对照组(p <0.01),同时它还显著高于RNA 各剂量组(p <0.05),表明豆渣RNA 及其酶解物均能明显提高小鼠的脾淋巴细胞增殖能力,增强小鼠细胞免疫功能,其中酶解物高剂量组的效果最显著。
2.3 豆渣RNA 及其酶解物对小鼠迟发型变态反应的影响
DTH(迟发型变态反应)是检测T 细胞功能的体内实验方法之一,通过测定受测物对机体迟发型超敏反应的影响,可反映机体的T 细胞功能或受试物的作用[19]。豆渣RNA 及其酶解物对小鼠迟发型变态反应的影响如图3 所示。
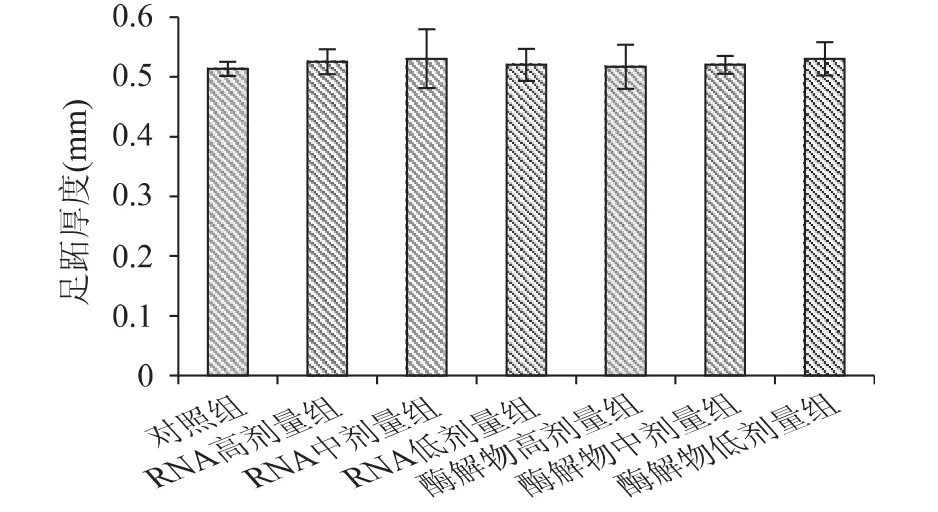
图3 豆渣RNA 及其酶解物对小鼠的迟发型变态反应影响Fig.3 Effect of okara RNA and hydrolysates on delayedtype hypersensitivity in mice
由图3 可知,经口给予小鼠不同剂量的豆渣RNA 及其酶解物30d 后,尽管豆渣RNA 组及其酶解物各剂量组的足趾增厚值比对照组有所增加,但未达到显著性水平(p >0.05),说明豆渣RNA 及其酶解物对T 细胞介导的迟发型超敏反应的影响不明显。
2.4 豆渣RNA 及其酶解物对小鼠脾脏抗体生成细胞的影响
脾脏的抗体生成细胞水平是反映机体体液免疫功能的重要指标之一[10]。豆渣RNA 及其酶解物对小鼠脾脏抗体生成细胞的影响如图4 所示。
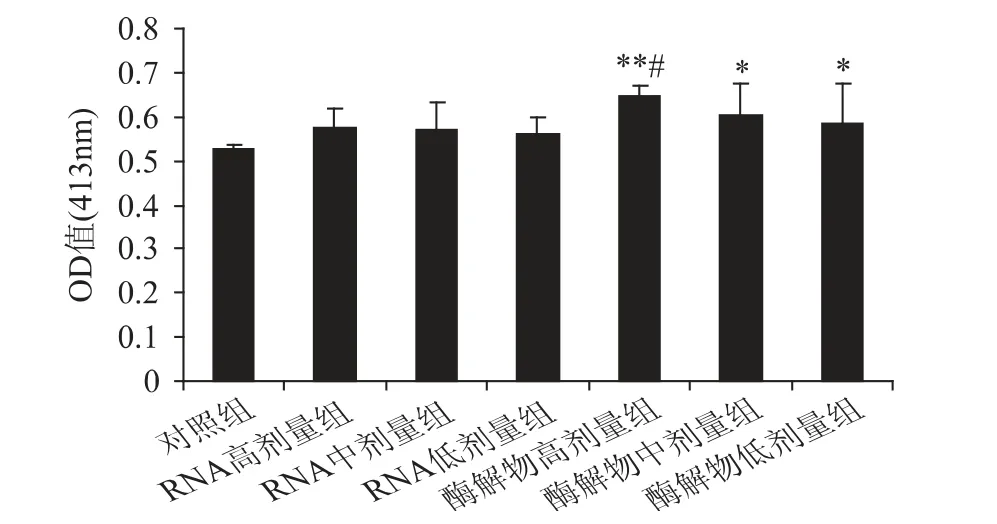
图4 豆渣RNA 及其酶解物对小鼠脾脏抗体形成细胞的影响Fig.4 Effect of okara RNA and hydrolysates on the antibody forming cell in mice
由图4 可以看出,豆渣RNA 组及其酶解物各剂量组小鼠的脾脏抗体生成细胞水平均高于对照组。其中,豆渣RNA 各剂量组与对照组相比,差异不显著(p >0.05),而豆渣RNA 酶解物各剂量组则显著高于对照组(p <0.05),且酶解物高剂量组极显著高于对照组(p <0.01),同时显著高于RNA 各剂量组(p <0.05),并呈现明显的剂量效应关系。表明豆渣RNA酶解物可明显增加脾脏的抗体生成细胞水平,增强小鼠的体液免疫功能。其中酶解物高剂量组的效果最好。
2.5 豆渣RNA 及其酶解物对小鼠单核-巨噬细胞功能的影响
巨噬细胞是机体天然免疫防御系统中重要的免疫效应细胞,其吞噬功能可反映机体非特异性免疫功能的强弱[21]。豆渣RNA 及其酶解物对小鼠单核-巨噬细胞吞噬功能的影响如图5 所示。
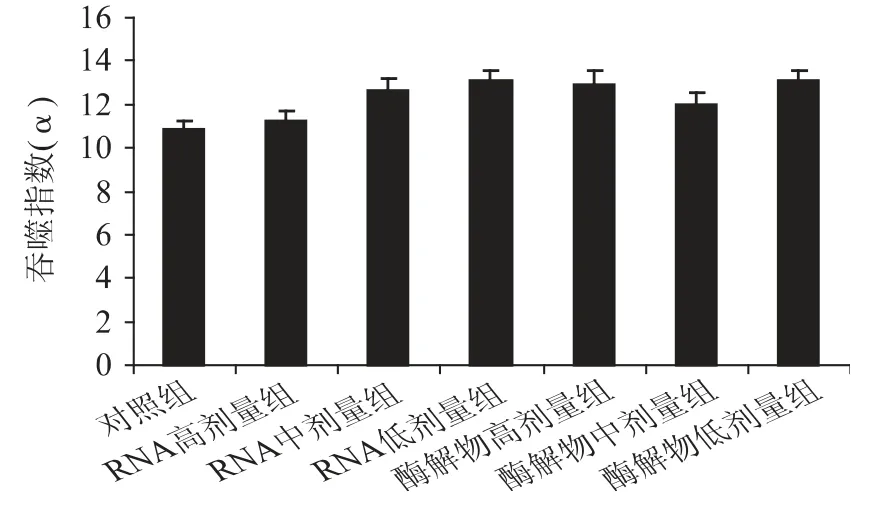
图5 豆渣RNA 及其酶解物对小鼠巨噬细胞吞噬功能的影响Fig.5 Effect of okara RNA and hydrolysates on ability of carbon clearance in mice
由图5 可知,与对照组相比,豆渣RNA 及其酶解物各剂量组吞噬指数虽有所提高,但差异不显著(p >0.05),表明豆渣RNA 及其酶解物不能明显促进小鼠巨噬细胞的吞噬功能,提示豆渣RNA 及其酶解物对机体的非特异性免疫调节作用不明显。
3 讨论
研究表明RNA 是维持机体正常免疫功能的必需营养成分。补充外源性RNA,不仅可以增强机体的免疫功能,还能恢复由蛋白质缺乏或其他原因引起的免疫功能丧失[22]。豆渣RNA 作为一种新的RNA 资源,其免疫活性如何,尚未见报道。本研究依照《保健食品检验与评价技术规范》的要求,分别从免疫器官重量、细胞免疫功能、体液免疫功能和单核-巨噬细胞功能4 个方面探讨了豆渣RNA 及其酶解物在不同剂量水平下对小鼠免疫功能的影响,并比较了二者免疫调节作用的差异。
本实验表明豆渣RNA 及其酶解物均能促进小鼠脾脏生长,增强脾淋巴细胞增殖能力,提高小鼠脾脏细胞的抗体生成水平,二者均呈现剂量依赖性。这说明豆渣RNA 及其酶解物可通过提高小鼠的细胞免疫和体液免疫增强机体的整体免疫能力。此结果与王兰芳等研究日粮中添加核苷酸能极显著提高免疫抑制小鼠的抗体形成细胞的数目和淋巴细胞转化率的结果相似[23]。
豆渣RNA 与豆渣RNA 酶解物相比,在增强脾脏指数,淋巴细胞增殖能力和抗体生成量方面,RNA 酶解物的高剂量组显著优于RNA 其他各剂量组,RNA酶解物的中、低剂量组较相对应的RNA 中、低剂量组虽然也有提高,但差异不显著。这说明豆渣RNA酶解中小分子的低聚寡核苷酸可能更加易于小肠吸收,所以酶解物组的免疫效果相比非酶解物组好,但RNA 酶解物高剂量组(10.0mg/mL)的效果最明显。
此外,本实验表明豆渣RNA 及其酶解物不能明显促进小鼠巨噬细胞的吞噬功能。且豆渣RNA 及其酶解物各剂量组吞噬指数未呈现剂量依赖性。豆渣RNA 组出现随剂量增加,吞噬指数逐渐降低的趋势,推测可能因剂量过大造成机体短期刺激过大,影响其炭粒廓清能力,导致吞噬指数降低。豆渣RNA酶解物组则出现随剂量增加,吞噬指数先降低后增加的趋势,此原因有待于下一步在本实验剂量(0.1~10.0mg/mL)范围内,减小剂量设计倍数,增加实验组数,进一步实验后分析探讨。
4 结论
豆渣RNA 及其酶解物均能促进小鼠脾脏生长,增强脾淋巴细胞增殖能力,提高抗体生成细胞水平,但对巨噬细胞吞噬功能影响不明显。这表明豆渣RNA 及其酶解物主要通过促进机体的细胞免疫和体液免疫而发挥免疫调节作用。其中,豆渣RNA 酶解物高剂量组(10.0mg/mL)的效果明显优于豆渣RNA 组。
[1]陈霞,杨香久,徐永华,等.豆渣膳食纤维制备及其在食品中的应用[J].中国粮油学报,2002,17(2):1-3.
[2]高金燕,徐江林.从大豆豆渣中提取大豆异黄酮的初步研究[J].中国食品添加剂,2003(5):16-18.
[3]戴小阳,罗泽民.豆渣的有效利用[J].湖南农业科学,1996(1):28-29.
[4]徐慧,刘建军,赵祥颖.啤酒废酵母提取核糖核酸工艺的研究[J].中国酿造,2008,35(6):35-37.
[5]胡刚,孙军勇,蔡国林,等.浓盐法提取啤酒废酵母核糖核酸的研究[J].中国酿造,2009(7):112-114.
[6]Marina C E,Victor L,María F.Extraction of RNA from fermented milk products for in situ gene expression analysis[J].Analytical Biochemistry,2010,10(2):307-309.
[7]Ha S,Li K,Lori A K,et al.Evaluation of microbial RNA extractions from Streptococcus pneumonia [J]. Journal of Microbiological Methods,2007,68:342-348.
[8]Luliana S,Keith S,Bhoomi M. Emerging role of small ribonucleic acid in gastrointestinal tumors:Critical Reviews in oncology[J].Hematology,2010,76(3):173-185.
[9]孙荣丹,刘莹,张洪林,等.浓盐法与稀碱法在啤酒废酵母中提取RNA 的研究[J].氨基酸和生物资源,2006,28(3):76-78.
[10]毕韬韬,吴广辉,高愿军.豆渣深加工研究进展[J].食品研究与开发,2011,32(6):149-151.
[11]李娜,柴菜建,邵美丽,等.工业化方法提取及纯化豆渣RNA 的工艺研究[J].食品工业,2013,34(1):4-7.
[12]李静,刘力源,任捷,等.地锦粗提物对脾虚小鼠脏器指数和抗氧化能力的影响[J].中国微生态学杂志,2011(12):1060-1063.
[13]Avantika V,Kashi N P,Aloukick K S.Evaluation of the MTT lymphocyte proliferation assay for the diagnosis of neurocysticer cosis[J].Microbiological Methods,2010,81(2):175-178.
[14]张秀美.新编兽医实用手册[M].济南:山东科学技术出版社,2006:8-10.
[15]Christopher C G,Carola G V,Katrina L R.Control systems and decision making for antibody production [J]. Nature Immunology,2010,11:681-688.
[16]Dongsan P,Dae-Kwon B,Jeong H J.Immunopotentiation and antitumor effects of a ginsenoside Rg3- fortified red ginseng preparation in mice bearing H460 lung cancer cells[J].Environmental Toxicology and Pharmacology,2011,31 (3):397-405.
[17]Kulkarni A D,Rudolph F B,Van-Buren C T.The role of dietary sources of nucleotides in immune function:a review[J].Nutrure,1994,124(8):1442-1446.
[18]杨小军,左伟勇,陈伟华.面筋蛋白的胃蛋白酶酶解物对大鼠免疫功能的影响[J].南京农业大学学报,2004,27(4):69-72.
[19]霍乃蕊,岳文斌,刘玉花.羊骨木瓜蛋白酶水解物对小鼠免疫功能的影响[J].中国实验动物学报,2010,5(18):418-420.
[20]Clement K A,Andrew A A,Keiku Y.Dietary nucleosidenucleotides mixture aggravates nasal allergic responses induced by toluene diisocyanate in mice[J].Nutrition Research,2010,17(10):1597-1605.
[21]Huang Q,Li Z,Yang XF.Flow cytometry in evaluating phagoeytosis of mouse peritoneal Macrophages[J]. Chin J Pharmacol Toxicol,2007,21(2):140-146.
[22]李蓉,佟晓永,潘宏志.饮食核酸对不同龄小鼠免疫功能的影响[J].营养学报,2000,22(1):36-39.
[23]王兰芳,乐国伟,施用晖.外源核苷酸对小鼠免疫功能的影响[J].营养学报,2003,25(3):298-301.
