甘薯块根膨大后期β-淀粉酶和淀粉含量相关性分析
2013-08-07陈显让李红兵郭尚洙邓西平
陈显让,李红兵,康 乐,3,郭尚洙,邓西平,*
(1.西北农林科技大学资源环境学院,陕西杨凌712100;2.黄土高原土壤侵蚀与旱地农业国家重点实验室,中国科学院水利部水土保持研究所,陕西杨凌712100;3.西北农林科技大学林学院,陕西杨凌712100;4.韩国生命工学研究院,韩国大田305-806)
β-淀粉酶是广泛存在于微生物和植物中的一种水解酶,它能从非还原末端开始,依次按麦芽糖单位降解淀粉分子的α-1,4 糖苷键,进而使产物从α 麦芽糖变为β 麦芽糖[1]。β-淀粉酶广泛应用于工业生产,既可以水解淀粉生成高浓度麦芽糖糖浆,在啤酒的生产中代替大麦芽[2],也可以作为饴糖、饮料等生产过程的糖化剂[3]。β-淀粉酶是甘薯块根中仅次于贮藏蛋白的一种蛋白质成分,约占根可溶性蛋白的5%[4-5]。甘薯在蒸煮过程中产生的香味也部分归因于β-淀粉酶水解淀粉产生的麦芽糖的作用,并且β-淀粉酶含量低的甘薯的甜度也会大大小于含量高的[6]。目前,我国β-淀粉酶的生产主要以微生物生产和植物中提取为主,利用微生物生产有耐热性差、成本高昂等缺点,而从植物中获得的β-淀粉酶具有酶活力高、耐热性好、作用pH 范围广等优点[7],因而得到了广泛应用。甘薯块根中的β-淀粉酶含量较高,提取成本低廉,是较为理想的生产β-淀粉酶的原料[8]。廖爱君等人研究了利用甘薯淀粉生产中的废水资源获得β-淀粉酶的方法[9],这种方法吸附剂用量少、成本低,1kg 鲜薯可制备110g 的酶制剂,每克酶活力达7 万单位,总回收率在80%以上,可以明显提高甘薯深加工的经济效益。本文从果实膨大后期到收获期间对十个甘薯品系和两个甘薯品种的淀粉率和β-淀粉酶含量进行了测定,以期为选用提取β-淀粉酶的优质甘薯做参考。
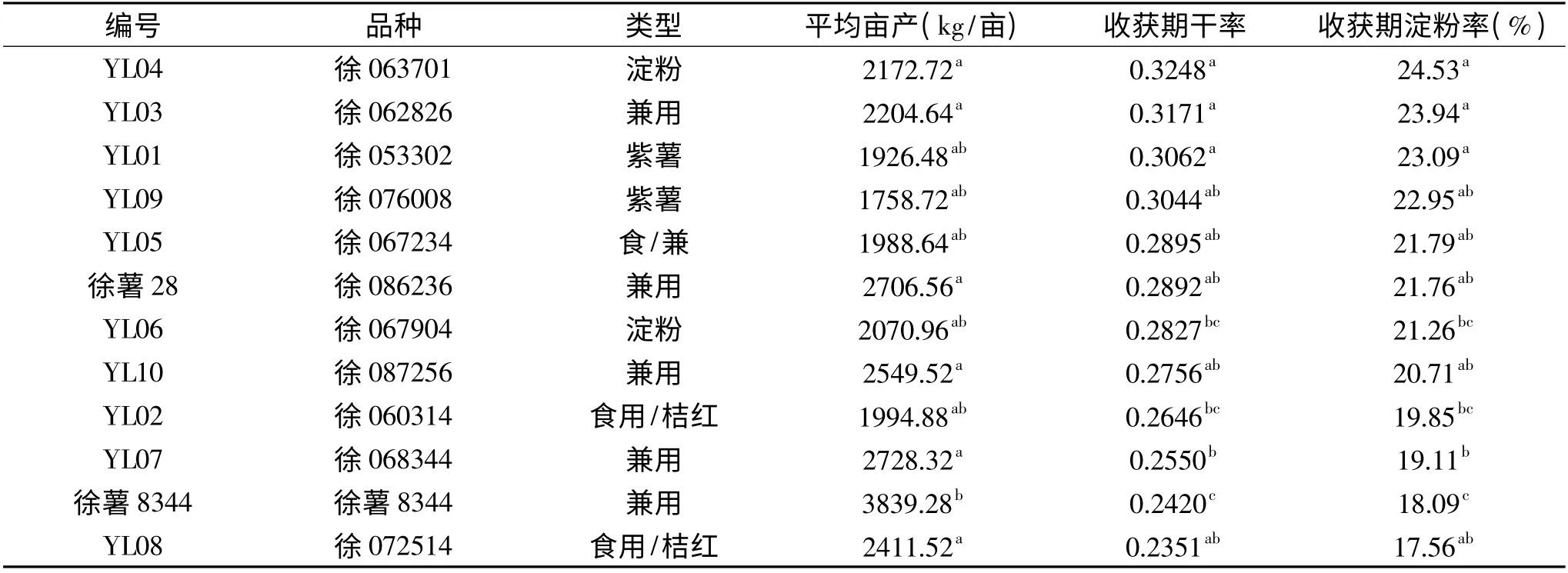
表1 栽种品种产量和淀粉率对照表Table 1 Comparisons of yields and starch contents
1 材料与方法
1.1 材料与试剂
徐薯28、徐薯8344,以及10 个高代品系甘薯徐州甘薯研究所提供,分别于果实膨大后期到收获期间每7 天采集甘薯块根一次,一半用于测量甘薯干率,另一半保存于-80℃冰箱中,共采集样品五次。
主要试剂:PVP Sigma;β-巯基乙醇 Amresco;可溶性淀粉 科密欧;磷酸缓冲液 华大;DNS 试剂 圣宇;麦芽糖 科密欧。
1.2 仪器与设备
岛津UV-2550 分光光度计、sigma 3K30 离心机、AISET YLE-1000 恒温水浴锅、人和SHZ-A 水浴恒温振荡器、Sartorius PB-10 pH 计、岛津UX220H 分析天平等。
1.3 实验方法
1.3.1 甘薯的栽种 10 个高代品系,两个对照品种,随机区组排列,3 重复,每小区3 行,行长4.4m,行距0.8m,株距0.22m,60 株/区;走道0.5m,栽插密度3788 株/667m2,实验净面积316.8m2。生育期为2011年6 月14 日到10 月29 日,共计137d。
1.3.2 淀粉率的测定 收获期前28d 开始,7d 取一次样品。每种甘薯取个体重量150g 左右的薯块,三个重复,切成颗粒,在105℃下杀青15min,烘箱中80℃烘至恒重,准确测量干样重量并计算甘薯烘干率,根据烘干率换算法[10]确定淀粉率:
淀粉率=烘干率×0.7781-0.0014
1.3.3 β-淀粉酶的提取 取各品系甘薯块根中心处2.0g(每2 块薯块样合为1 个重复,设3 次重复)于研钵中,加入液氮研磨成粉,装入离心管中,按1∶5(W/V)加入酶提取液(50mmol/L Tris- HCl,pH7.5,含1%PVP,5mmol/L 的2-巯基乙醇),离心(12000r/min,4℃)30min,取上清液倒入25mL 容量瓶,定容至刻度,即为所提取的粗酶液[11]。
1.3.4 β-淀粉酶的活性测定参照Bernfeld 方法[12],并根据实际情况加以优化。在具塞试管中加入5mL 1%的可溶性淀粉、1mL 0.2mol/L pH6.8 的磷酸缓冲液(当pH 为5.0~7.0 时,甘薯块茎β-淀粉酶同工酶的活力最高[13])、3.9mL 超纯水,40℃下预热5min,再加入0.1mL 待测酶液并立即保温30min,之后再取出试管在水浴中煮沸10min。待水解液冷却后吸取1mL 用3,5- DNS 显色,使用岛津UV-2550Probe 分光光度计在520nm 下测定还原糖吸光值(按麦芽糖毫克数计算)。一个酶活力单位(U)为30min 内产生1mg 麦芽糖所需酶量。
1.3.5 分析方法 采用SPSS、SAS 软件进行数据分析。
2 结果与分析
2.1 不同品系的产量和淀粉含量比较
甘薯收获之后,经过多次称重、计算平均值,计算干率和淀粉率,获得亩产比较值、收获期干率和淀粉率,结果见表1。从膨大后期到收获期,总体上淀粉率升幅为1%~5%。
从表1 可以看出,作为淀粉性的甘薯品系YL04表现出了收获期最高的淀粉率,YL03 和两种紫薯(YL01 和YL09)次之;食用型桔红心甘薯品系YL02和YL08 表现出了较低的淀粉率,生食口感较好。徐薯8344 较其它甘薯品系产量具有显著差异,不同甘薯品系产量差异较大,平均亩产从1758.72kg/亩到3839.28kg/亩,然而,成熟品种徐薯28 和徐薯8344平均亩产量分别为2706.56kg/亩和3839.28kg/亩,居所有实验品种的第三和第一,明显高于大多高代品系品种,由于二者淀粉率较低,所以口感较好,综合亩产和淀粉含量,二者仍为较理想的能源型和食用型兼用甘薯。
2.2 根据干率的分类比较各淀粉酶变化趋势
作为甘薯块根品质的重要指标之一,β-淀粉酶只存在于植物和少数微生物中[14]。甘薯块根中含有大量的淀粉酶,其中以β-淀粉酶为主[15]。甘薯块根中β-淀粉酶基因表达受蔗糖[16]、多聚半乳糖醛酸、机械损伤和ABA[17]等的诱导。β-淀粉酶是一种蛋白质,不适宜的温度会破坏活力部位三维结构的完整性,从而显著影响酶的活力。据鄂巍、李新华等人[15]报道,β-淀粉酶酶活力在40℃时最高,高于或低于此温度酶活力均降低,并且在70℃时,β-淀粉酶几乎完全失活。因此本实验在40℃下进行酶活测定,在煮沸状态下使酶失活。
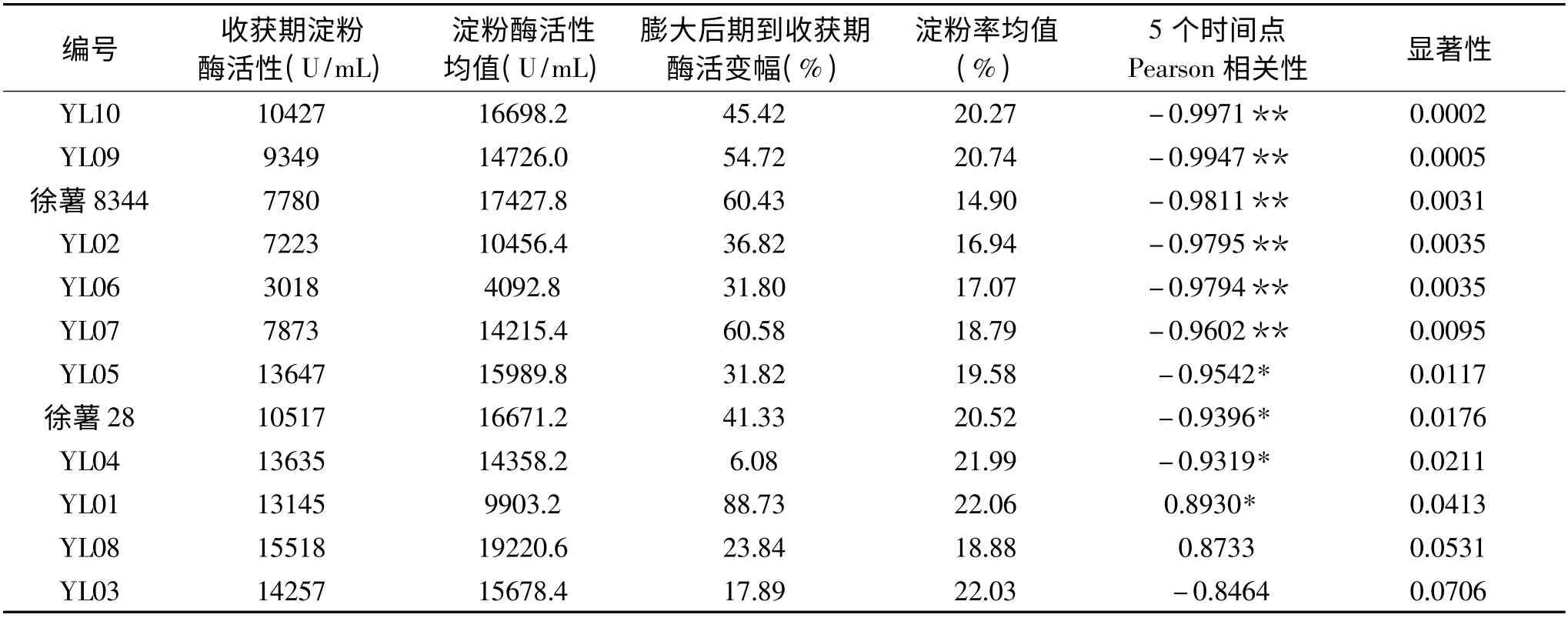
表2 12 个品系块根膨大后期5 个时间点β-淀粉酶活性和淀粉率变化相关性分析结果Table 2 Correlation analysis between β-amylase activity change and starch contents change of 12 strains at 5 time points
由于干率和淀粉率成正比,可以将收获期淀粉率按照大于22%、20% ~22%、小于20% 分成高干率、中干率、低干率三组。进行酶活性比较分析。紫薯YL01、YL09 在高干率一组,而食用型桔红心甘薯YL02 和YL08 在低干率一组,这也体现出了甘薯块根颜色、品种的差异所带来的淀粉率的差异。
由图1~图3 可以看出,除YL01 外,其余品系在甘薯块根膨大后期至收获期β-淀粉酶活性均有下降趋势,这与甘薯块根成熟淀粉含量增加有关。其中,中、低干率品系中有多个品系在收获前14d时表现出了最高的β-淀粉酶活性,高中低干率三组甘薯中每组都有3 个品系的β-淀粉酶活性在收获期时水平相当,说明除了个别品系,大部分干率接近的品系在收获期β-淀粉酶活性较为相近。区别于其它品系,图2 中的YL06 表现出较低的β-淀粉酶活性。
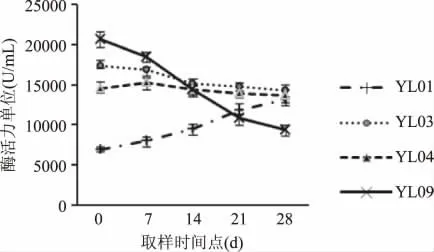
图1 高干率甘薯中β-淀粉酶活性变化趋势Fig.1 Variation trend of β-amylase activity in high-rate dry matter content types
2.3 不同品系间β-淀粉酶活性变化和淀粉率变化的相关性分析

图2 中干率甘薯中β-淀粉酶活性变化趋势Fig.2 Variation trend of β-amylase activity in middle-rate dry matter content types
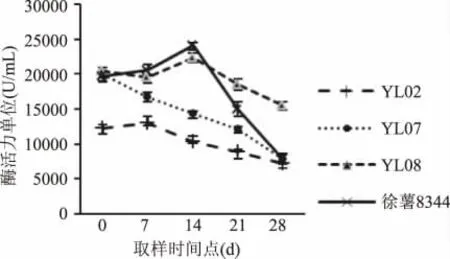
图3 低干率甘薯中β-淀粉酶活性变化趋势Fig.3 Variation trend of β-amylase activity in low-rate dry matter content types
根据上述测定五个时间点的酶活的变化,结合淀粉率的变化加以分析。SPSS 软件分析5 个时间点的淀粉酶活性和对应时间点的淀粉率的线性相关性,并以显著性加以排序。
从表2 可以看出,除品系YL01 外,其余品系在收获期均表现较低的β-淀粉酶活性,并且收获期β-淀粉酶活性要低于五个时期的均值。表2 结果表明除YL01 和YL08 表现为正相关外,其他品系β-淀粉酶活性和各时期淀粉率均表现为负相关。YL02、YL06、YL07、YL09、YL10、徐薯8344 表现出极显著相关性,YL01、YL04、YL05、徐薯28 表现出显著相关性。YL03 和YL08 相关性不显著。从以上分析看出,大部分品种β-淀粉酶活性变化和淀粉率的变化都有一定的相关性,多为负相关,这与前人报道相似[18-19],淀粉酶主要是将淀粉分解为糖,从理论上讲,淀粉酶活性越高,淀粉被分解的越快,淀粉率应该是下降的,但并不是所有品种都符合这一理论。从β-淀粉酶活性变化来看,YL01、YL07、徐薯8344、YL09 变幅较大,其中包含紫薯YL01 和YL09,而桔红心甘薯YL02 和YL08 变幅较低。
从活性水平来看,成熟品种徐薯8344 表现出了最高的酶活性均值,但是收获期活性和均值差异巨大。收获期YL08 和YL03 的β-淀粉酶活性较高,且均值亦较高。
综合考虑,β-淀粉酶活性与淀粉率多呈负相关关系,且从果实膨大后期到收获期,薯块淀粉含量多为升高趋势,但是变幅也根据不同品系的基因型有所不同,可以说淀粉分解转化速度的快慢,不完全由淀粉酶活性的高低决定,可能还受更多的因素控制。
3 结论与讨论
3.1 淀粉率和β-淀粉酶活性是甘薯品质的两个重要指标,在膨大后期和贮藏期的变化会影响甘薯的利用价值[18-19]。本研究测定了几种甘薯膨大后期到收获的β-淀粉酶活性和淀粉率,根据实验结果来看,总体上淀粉含量和β-淀粉酶有较为显著的相关性,且多为负相关。不同淀粉率薯品系β-淀粉酶活性差异显著,但淀粉率高的品系淀粉酶活性不一定高,这可以为选择提取β-淀粉酶的优质甘薯来源提供依据。
3.2 甘薯在果实膨大期β-淀粉酶活性峰值多出现在收获前28d,部分出现在收获前14d,从初始到收获变幅从6.08%~88.73%不等,说明品种之间存在不小差异,在考虑从甘薯中提取β-淀粉酶效益时需要从这几个时期的淀粉率、酶活性以及产量综合分析。
3.3 薯块颜色不同、功用不同,淀粉含量和β-淀粉酶活性差异也较为明显,如紫薯品系(YL01 和YL09)相对于桔红心品系(YL02 和YL08)表现出了较高的收获期淀粉率和较低的平均β-淀粉酶活性,并且紫薯品系β-淀粉酶活性变幅亦较高。在之前的研究中,N.T.Dziedzoave[20]报道了同期栽种的甘薯皮颜色不同,β 淀粉酶活性水平也是在不同的结论,但没有深入研究,本文进行了一些探究,这也是今后需要更加深入探讨的一个方向。
[1]Ann Y G,Iizuka,M Yamamoto T,et al.Preparation and Some Properties of Active Monomer of Sweet Potato β-Amylase[J].Agriculture Biological Chemistry,1990,54(3) :769-774.
[2]王惠权,何秉旺.微生物β-淀粉酶研究进展[J].微生物学通报,1994,21(1) :44-47.
[3]李新华,鄂巍,林琳.紫甘薯β-淀粉酶水溶性提取技术的研究[J].食品工业科技,2008,29(2) :266-268.
[4]Li HS,Oba K.Major Soluble protein of sweet potato roots and changes in proteins after cutting infection,Or storage[J].Agriculture Biological Chemistry,1985,49(3) :734-744.
[5]Yoshida N,Nakamura K.Molecular cloning and expression in Escherichia coli of cDNA encoding the subunit of sweet potato β-amylase[J].Biochemisty,1991,110:196-201.
[6]Nakamura K,Ohto MA,Yoshida N,et al.Sucrose-Induced Accumulation of beta- Amylase Occurs Concomitant with the Accumulation of Starch and Sporamin in Leaf-Petiole Cuttings of Sweet Potato[J].Plant Physiology,1991,96(3) :902-909.
[7]贾彦杰,梁新红,朱文学,等.不同沉淀方法分离甘薯β-淀粉酶的研究[J].食品科学,2010,31(18) :22-25.
[8]孙俊良.酶制剂生产技术[M].北京: 科学出版社,2004:159-160.
[9]廖爱君,陈信波,罗泽民,等.甘薯β-淀粉酶的制备及性质研究[J].湖南农业大学学报,1998,24(1) :28-30.
[10]陆国权.甘薯淀粉若干重要品质性状的基因型差异研究[J].浙江农业大学学报,2000,26(4) :379-383.
[11]张剑,林庭龙,秦瑛,等.β-淀粉酶研究进展[J].中国酿造,2009(4) :5-8.
[12]邱宏端,李志达,沈卫星,等.植物β-淀粉酶的提取与酶粉剂的制备[J].福州大学学报: 自然科学版,1996,24( 6) :104-108.
[13]张原箕,张华,赵力,等.甘薯块茎中β-淀粉酶同工酶特性及其在萌芽过程中的组织分布[J].农产品加工·学刊,2006,79(10) :53-56.
[14]J S Swanston,J-L.Molina-Cano.Beta-amylase activity and thermostability in two mutants derived from the malting Barley cv.Triumph[J].Journal of Cereal Science,2001,33(2) :155-161.
[15]鄂巍,李新华,林琳,等.紫甘薯β-淀粉酶性质研究[J].农业科技与装备,2008,2:72-74.
[16]Tsukaho Hattori,Harumi Fukumoto,Shoko Nakagawa et al.Sucrose-induced expression of genes coding for the tuberous root storage protein,sporamin,of sweet potato in leaves and petioles[J].Plant & Cell Physiology,1991,32(1) :79-86.
[17]Ohto MA,Nakamura- Kito K,Nakamura K.Induction of expression of genes coding for sporamin and β- amylase by polygalacturonic acid in leaf-petiole cuttings of sweet potato[J].Plant Physiology,1992,99(2) :422-427.
[18]陶向,张勇为,姜玉松,等.甘薯块根储藏过程中的淀粉含量变化[J].应用与环境生物学报,2010,16(5) :741-744.
[19]谢逸萍,李洪民,王欣.贮藏期甘薯块根淀粉酶活性变化趋势[J].江苏农业学报,2008,24(4) :406-409.
[20]NT Dziedzoave,AJ Graffham,A Westby,et al.Influence of variety and growth environment on β-amylase activity of flour from sweet potato( Ipomea batatas) [J].Food Control,2010,21(2) :162-165.
