槲皮素对高脂日粮小鼠学习记忆能力的影响研究
2013-08-07田英杰陈立立乐国伟施用晖
郑 静,田英杰,陈立立,乐国伟,2,施用晖,2
(1.江南大学食品学院食品营养与安全研究所,江苏无锡214122;2.江南大学食品安全与科学教育部重点实验室,江苏无锡214122)
氧化应激(Oxidative stress,OS)即体内活性氧的产生与抗氧化防御体系之间失衡,从而导致组织损伤的一种状态。氧自由基(ROS)生成增加,损害正常细胞,诱发各种人类疾病,其中就包括神经退行性病变[1],如帕金森,阿尔兹海默病,临床上共同表现为记忆认知能力的下降。核转录因子Nrf2 属于CNC亮氨酸拉链转录激活家族,可以诱导抗氧化物质和细胞保护成分的基因表达。研究表明[2]长期高脂饲喂小鼠脑部氧化应激增加,核转录因子Nrf2 水平和活性下降,从而引起记忆能力衰退。血红素单加氧酶1(HO-1)亦称热休克蛋白,能在氧化应激或其他不利的刺激下迅速作出保护性应答。研究发现抗氧化剂正二氢愈创酸(NDGA)可以通过激活抗氧化通路Nrf2/HO-1,减轻氧化应激对小脑神经元的损害[3]。脑源性神经营养因子(Brain - derived neurotrophic factor,BDNF)是神经营养因子家族中的一员,对神经元的分化、存活起着重要的作用,在海马、下丘脑、大脑皮层中表达尤为丰富[4],与学习记忆能力密切相关。有研究发现HO-1 可以通过其下游产物胆红素和一氧化碳(CO)调控神经元和神经胶质细胞中BDNF 和胶质细胞源性神经营养因子(GDNF)的表达[5]。以上研究说明Nrf2/HO-1 是细胞抗氧化的重要通路,同时在维持大脑的正常功能中起重要作用。槲皮素(Quercetin,Q)及其衍生物是最常见的黄酮类化合物,广泛存在于蔬菜、水果及植物中,具有良好的抗氧化及保护神经元,抗焦虑,增强认知能力的作用。Heo 发现槲皮素可以保护中枢神经细胞,减轻氧化应激对神经细胞的毒性作用,从而保护大脑的正常生理功能。本实验以长期高脂日粮饲喂诱导氧化应激模型,通过Morris 水迷宫实验测定小鼠空间学习记忆能力的变化,并测定氧化应激相关指标及基因的表达,探讨槲皮素对高脂膳食小鼠学习记忆能力的影响及其可能机制。
1 材料与方法
1.1 材料与仪器
实4 周龄C57B/L 雌性小鼠 上海斯莱克动物中心;槲皮素 Sigma 公司,纯度为99.5%;总抗氧化能力(T-AOC)、丙二醛(MDA)测定试剂盒 南京建成生物工程研究所;3-硝基酪氨酸(3-NT)、4-羟基壬烯酸(4-HNE)测定试剂盒 厦门慧嘉生物科技有限公司;AccuPower TM Greenstar qPCR PreMix 试剂盒 上海BIONEER 公司。
Morris 水迷宫 北京硕林苑科技有限公司;F96荧光分光光度计 上海棱光技术有限公司;荧光定量PCR 仪 美国AB 公司。
1.2 动物分组和饲喂
选用C57B/L 雌性健康小鼠4 周45 只,1 周预饲后,根据体重随机均分为3 组:正常对照组(Control,正常日粮),高脂模型组(HFD,约20%脂肪),槲皮素组(HFD +Q,高脂日粮添加0.01%槲皮素)(日粮配方见表1)。实验用小鼠同室分笼饲养,自然光照,自由采食,充足饮水,室内温度(20 ± 2)℃,相对湿度55%。
1.3 Morris 水迷宫实验
26 周进行Morris 水迷宫实验,实验程序包括定位航行实验和空间探索实验两部分。其中定位航行实验(Place navigation)即每天将小鼠面向池壁从特定的入水点放入水中,每次找到水面下的平台后任其在平台上停留20s,然后拿出小鼠擦干,休息30s后从下一个入水点再次放入水中,每只小鼠每天都从4 个特定的入水点被放入水中,共持续4d,记录每一次小鼠寻找到平台的时间(逃避潜伏期,escape latency);第5d 空间探索实验(spatial probe)是在定位航行实验后去除平台,然后任选一个入水点将小鼠放入水池中,记录其在60s 内的游泳轨迹,记录并统计原平台象限游泳时间与总时间之比以及游泳路程与总路程之比,考察小鼠对原平台的记忆。
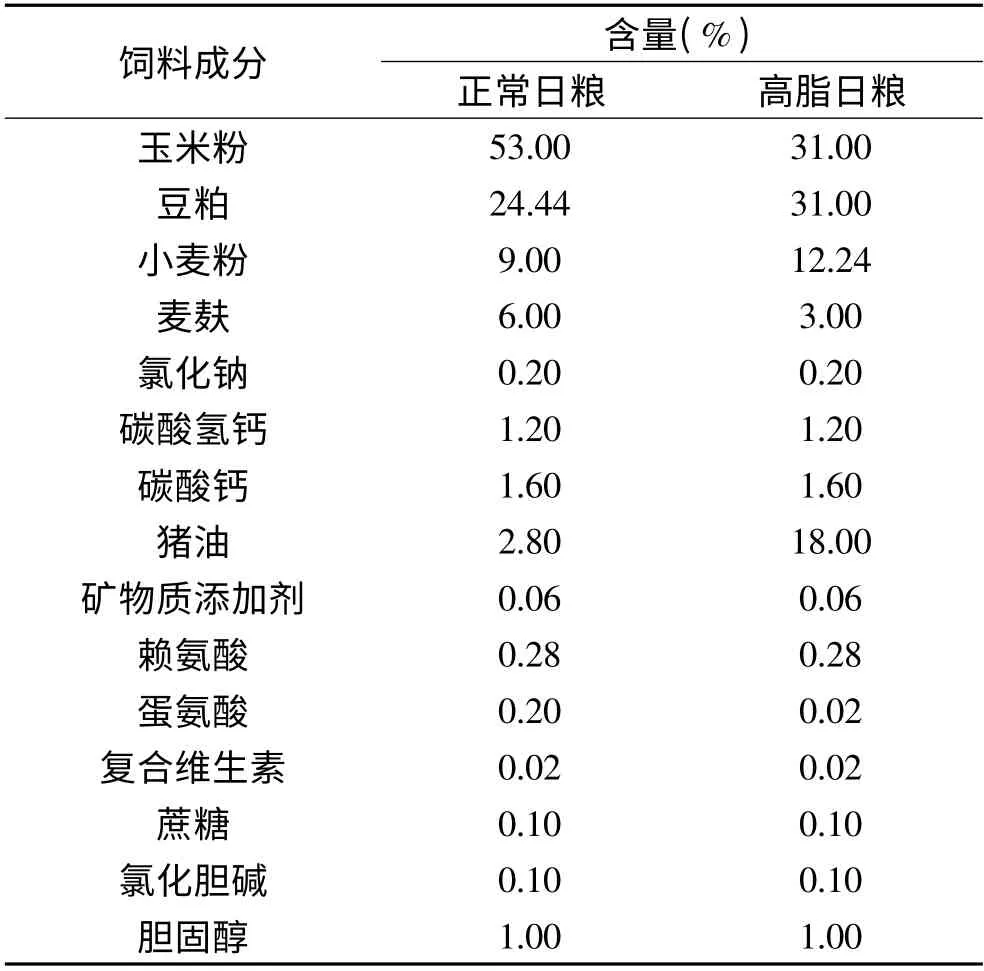
表1 实验日粮配方及营养成分Table 1 Formula and nutrients content of the dietary
1.4 样品采集和指标测定
实验结束后,以戊巴比妥钠麻醉小鼠,摘眼球取血,在冰浴上开颅,迅速分离双侧大脑皮层和海马,用0.9%生理盐水冲洗除去表面残血,左侧皮层和海马按重量体积比1∶10 用0.9%的预冷生理盐水制成匀浆液用于氧化应激指标的测定,右侧海马加入装有1mL Biozol 的DEPC 处理过的EP 管中,于-70℃保存,用于基因测定。利用张迺哲等学者的荧光法在430nm 波长下测定还原型谷胱甘肽(GSH)和氧化型谷胱甘肽(GSSG)吸光度(OD)值,通过标准曲线计算样品中GSH 和GSSG 浓度,算出GSH/GSSG。按照相应的试剂盒说明书用酶标仪在520nm 波长下测定T-AOC 吸光度(OD)值,以及在532nm 波长下测定MDA 吸光度(OD)值,根据相应的公式计算出组织中T-AOC 和MDA 含量。ELISA 试剂盒应用双抗体夹心法,用酶标仪在450nm 波长下测定皮层中3-NT和海马中4-HNE 吸光度(OD)值,通过标准曲线计算3-NT 和4-HNE 含量。荧光定量PCR 技术检测海马组织中Nrf2,HO-1 以及BDNF 的基因表达。
1.5 RNA 提取和逆转录实时荧光定量PCR
按Biozol 提供的说明书提取海马组织的总RNA,紫外分光光度计鉴定其质量和浓度。取合格的RNA 样品2μg,加入 OligdT 2μL,20mmol/mL dNTP2μL,用DEPC 水补足体系至10μL,70℃水浴5min 后,冰浴迅速冷却;随后加入:5 × RT Buffer5μL,40U/μL RNA 酶抑制剂0.25μL,200U/μL MMLV 逆转录酶0.5μL,DEPC 水9.25μL。37℃水浴1.5h,95℃水浴3min,得到的cDNA。

表2 实时荧光定量PCR 引物序列Table 2 Sequences of primers in quantitative real-time PCR

表3 槲皮素对高脂日粮小鼠Morris 水迷宫实验结果的影响(n=10,¯x±SD)Table 3 The effect of quercetin on the results of Morris Water Maze experiment of mice fed high-fat diet(n=10,¯x±SD)
1.6 实时荧光定量PCR
使用BIONEER 公司的AccuPowerTM Greenstar qPCR PreMix 试剂盒,每孔加入cDNA 模板0.5μL,正负链引物(10mM)各0.4μL,qPCR PreMix 5μL,无菌双蒸水3.7μL,反应体系为10μL。扩增条件:95℃,5min;95℃,20s;60℃,30s;72℃,20s;45 个循环,最后72℃延伸2min,以β-actin(100μmol/L)为内参基因进行荧光定量PCR 分析。基因引物均由上海捷瑞生物工程有限公司设计合成(引物序列见表2)。RT-PCR产物的特异性由溶解曲线评估。基因相对表达量的计算方法参照Kenneth and Thomas 创立的方法。
1.7 数据处理与统计方法
采用SPSS17.0 统计软件对数据进行单因素方差分析、相关性分析,并Duncan 多重比较。实验数据用±SD表示,显著水平为p <0.05,极显著水平为p <0.01。
2 结果与分析
2.1 槲皮素对高脂日粮小鼠水迷宫实验结果的影响
由表3 可知,前4d 的定位航行实验中,随着训练时间延长,小鼠逃避潜伏期(escape latency,EL)逐渐缩短并出现分化,至训练第3d,与正常组相比,高脂组小鼠EL 显著延长(p <0.05),槲皮素干预后EL 下降,但无显著性差异(p >0.05);第4d,高脂组小鼠EL 显著延长(p <0.05),槲皮素组干预后EL 显著缩短(p <0.05);在第5d 的空间搜索实验中,高脂组原平台象限游泳时间比例和路程比例与正常组相比显著降低(p <0.05),添加槲皮素后两项指标皆显著升高(p <0.05)。说明饲喂到26 周时,高脂组小鼠空间学习记忆能力显著性衰退,槲皮素可以显著增强学习记忆能力。
2.2 槲皮素对高脂日粮小鼠大脑皮层和海马氧化还原状态的影响
由表4 可知,高脂组小鼠皮层和海马T-AOC 与正常组相比显著降低(p <0.05),给予槲皮素后显著上升(p <0.05);皮层GSH/GSSG 水平显著下降(p <0.05),给予槲皮素后恢复至正常;高脂组小鼠皮层中3-NT、MDA 以及海马中4-HNE、MDA 的含量显著升高(p <0.05),添加槲皮素后,可显著降低皮层MDA和海马MDA、4-HNE 含量(p <0.05),并使3-NT 恢复至正常水平。
2.3 槲皮素对高脂日粮小鼠海马组织中Nrf2、HO-1和BDNF 基因相对表达量的影响
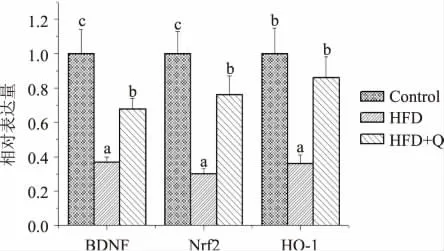
图1 槲皮素对高脂日粮小鼠海马组织中BDNF,Nrf2 以及HO-1 基因表达的影响(n=10,¯x±SD)Fig.1 The effect of quercetin on the expression of BDNF,Nrf2 and HO-1 in hippocampus of mice fed high-fat diet(n=10,¯x±SD)
如图1 所示,给予高脂膳食后,Nrf2、HO-1 和BDNF 的表达与正常组相比显著下调(p <0.05),槲皮素干预后,Nrf2、HO-1 和BDNF 的表达与高脂组相比显著上调(p <0.05),其中HO-1 表达恢复至正常水平。
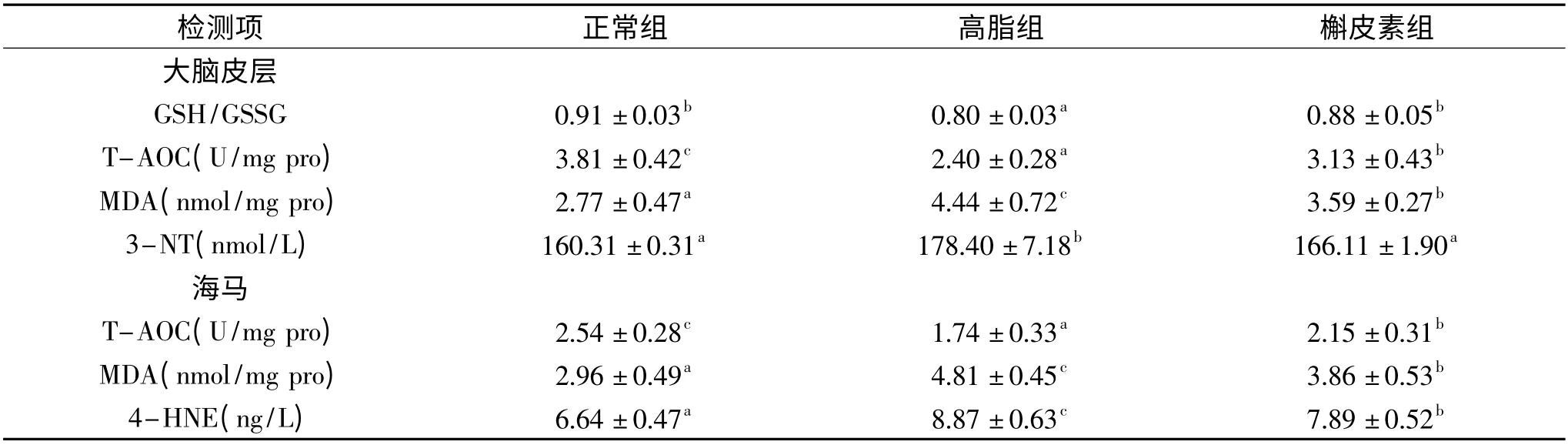
表4 槲皮素对高脂日粮小鼠大脑皮层和海马氧化还原状态的影响(n=10,¯x±SD)Table 4 The effect of quercetin on the redox state of cortex and hippocampus of mice fed high-fat diet(n=10,¯x±SD)
3 结论
3.1 认知能力下降伴随着衰老而发生,表现为思维敏捷程度下降以及学习记忆能力下降。近年来已有不少研究发现高脂膳食能造成认知障碍,但是迄今为止其具体机制仍不清楚。目前较为广泛接受的是氧化应激学说、胰岛素抵抗学说、tau 蛋白学说等,其中氧化应激学说在神经退行性病变过程中的作用越发受到关注。脑组织是体内氧负荷最大的器官之一,虽然人脑的重量仅占人体总重量2%~3%,但却消耗了供应机体的20%的氧。脑部有着高的糖代谢和呼吸代谢,高浓度的不饱和脂肪酸组成脑神经元的膜结构,而且高浓度的反应铁离子和低浓度的抗氧化酶水平都使得脑组织更加容易受到ROS 的损伤[6]。Susan A[7]发现12 月龄的SAMP8 小鼠脑中氧化应激产物含量显著高于4 月龄小鼠,学习记忆能力显著下降,给予抗氧化剂α-硫辛酸和N-乙酰-半胱氨酸(NAC)后发现,大脑氧化应激程度减轻,学习记忆能力得到改善,说明氧化应激是学习记忆能力衰退的重要机制。本实验通过Morris 水迷宫观察到26 周高脂日粮小鼠学习记忆能力显著下降,氧化应激指标测定发现小鼠脑组织GSH/GSSG 和T-AOC水平显著降低,蛋白质氧化产物3-NT 和脂质过氧化产物4-HNE、MDA 含量显著上升,槲皮素可以显著改善高脂膳食引起的氧化应激,增强学习记忆能力,说明长期高脂饲喂导致小鼠脑部氧化平衡状态被打破,引起了蛋白质氧化和脂质过氧化损伤,从而导致学习记忆能力下降,而槲皮素可以显著减轻脑部氧化应激程度,增强学习记忆能力。
3.2 核转录因子Nrf2 能通过诱导一系列抗氧化剂保护蛋白的编码,促进细胞内氧化还原环境的条件调节,因此成为细胞抗氧化应激的重要通路。Andy[8]发现神经胶质细胞中核转录因子Nrf2 的激活可以引发强烈的抗氧化应答,尤其增加了GSH 的合成和利用;亦有研究发现蒜素可以通过增强Nrf2 抗氧化信号通路改善老龄小鼠学习记忆能力障碍[9]。血红素氧合酶(HO-1)是体内广泛存在的一种抗氧化酶,HO-1 的诱导表达是通过激活Nrf2 在HO-1基因启动子区域与抗氧化反应元件(ARE)的结合而实现的。研究发现黑质中HO-1 表达可以上调多巴胺能神经元中BDNF 和神经胶质细胞中的GDNF 表达水平;Yoshiko[10]等人发现4-愈创木酚(4-MC)可以诱导神经干细胞或祖细胞中HO-1 的表达,对抗氧化应激引起的神经细胞凋亡,这一过程是依赖于PI3K/Akt 通路实现的。上述研究表明Nrf2/HO-1通路在中枢神经系统中发挥着重要的抗氧化以及维持大脑正常功能的作用。本实验中,荧光定量PCR结果显示,26 周后,高脂组小鼠海马Nrf2 和HO-1 基因表达均出现显著性下调,槲皮素干预后,Nrf2 表达水平显著上调,HO-1 表达水平恢复至正常,说明长期高脂膳食抑制了Nrf2/HO-1 通路的正常表达,破坏了大脑正常的抗氧化防御能力,导致学习记忆能力下降,槲皮素显著上调Nrf2/HO-1 基因表达,增强了脑部抗氧化能力,从而改善了学习记忆能力减退。
3.3 脑源性神经营养因子(BDNF)与其高亲和力受体TrkB 在维持神经元突触活性和可塑性的过程中发挥重要作用。Aiguo[11]等人给予大鼠高脂膳食2 个月后发现BDNF、突触蛋白1,CREB 等基因表达显著性下调,记忆认知能力衰退,给予抗氧化剂VE 治疗后,脑部氧化应激程度减轻,突触蛋白1 和CREB 的激活过程正常化,记忆认知能力得到恢复,说明氧化应激可以通过影响BDNF 体系来调控突触可塑性和认知能力。本实验结果显示,高脂组小鼠海马BDNF表达水平显著下调,给予槲皮素后,BDNF 表达水平显著上调,所以我们推测长期高脂膳食损害学习记忆能力可能是因为诱导了脑部氧化应激,削弱了神经元突触活性和可塑性。
3.4 槲皮素作为一种天然的黄酮类物质广泛存在于水果和蔬菜中,具有较强的抗氧化性和自由基清除能力。已有报道指出,槲皮素具有抗炎、抗凝血、抗缺血效应[12]和神经保护作用。Mubeen Ahmad Ansari[13]在海马细胞培养过程中加入β-淀粉样蛋白(Aβ),发现细胞存活率下降,自由基水平上升,3-NT和4-HNE 含量升高,给予槲皮素预处理后发现Aβ诱导的细胞毒性减弱,细胞存活率增加,自由基、3-NT和4-HNE 水平都下降,说明适当剂量的槲皮素可以通过减轻氧化应激状态发挥神经元保护作用;亦有研究发现槲皮素可以通过促进神经元Nrf2 核转位,增加谷胱甘肽水平来阻止H2O2诱导的氧化应激引起神经元凋亡[14];Shuang[15]发现槲皮素可以显著减轻乙醇诱导的大鼠肝细胞氧化应激损害,并指出这一保护作用与激活ERK 和上调HO-1 基因表达有关。本实验发现给予槲皮素治疗后,小鼠空间学习记忆能力得到显著增强,氧化应激得到显著改善,Nrf2/HO-1 通路和BDNF 基因表达显著上调,所以我们推测槲皮素增强高脂日粮小鼠空间学习记忆能力,可能与上调Nrf2/HO-1 抗氧化通路的基因表达,改善脑部氧化应激,以及上调BDNF 基因表达有关。
[1]Zhu X,Su B,Wang X,et al.Causes of oxidative stress in Alzheimer disease[J].Cellular and Molecular Life Sciences,2007,64(17) :2202-2210.
[2]Morrison Christopher D,Pistell Paul J,Ingram Donald K,et al.High Fat Diet Increases Hippocampal Oxidative Stress and Cognitive Impairment in Aged Mice: Implications for decreased Nrf2 signaling[J].Journal Neurochemistry,2010,114( 6) : 1581-1589.
[3]Silvia Guzmán-Beltrán,Sandra Espada,Marisol Orozco-Ibarra,et al.Nordihydroguaiaretic acid activates the antioxidant pathway Nrf2/HO-1and protects cerebellar granule neurons against oxidative stress[J].Neuroscience Letters,2008,447 ( 2 - 3):167-171.
[4]Scott EK,Robert LM,Amanda JM,et al.The effects of energy-rich diets on discrimination reversal learning and on BDNF in the hippocampus and prefrontal cortex of the rat[J]. Behavioural Brain Research,2007,182(1) :57-66.
[5]Park Hee Ra,Park Mikyung,Choi Jehun,et al.A high-fat diet impairs neurogenesis:Involvement of lipid peroxidation and brain-derived neurotrophic factor[J].Neuroscience Letters,2012,482(3) :235-239.
[6]Emerit J,Edeas M,Bricaire F,et al.Neurodegenerative disease and oxidative stress[J].Biomedicine & Pharmacotherapy,2004,58(1) :39-46.
[7]Farr Susan A,Poon H.Fai,Dilek Dogrukol-Ak,et al.The antioxidants a-lipoic acid and N-acetylcysteine reverse memory impairment and brain oxidative stress in aged SAMP8 mice[J].Journal of Neurochemistry,2003,84(5) :1173-1183.
[8]Shih Andy Y,Johnson Delinda A,Wong Gloria,et al.Coordinate Regulation of Glutathione Biosynthesis and Release by Nrf2-Expressing Glia Potently Protects Neurons from Oxidative Stress[J].The Journal of Neuroscience,2003,23 ( 8) :3394-3406.
[9]Li Xian-Hui,Li Chun-Yan,Lu Jiang-Ming,et al.Allicin ameliorates cognitive deficits ageing - induced learning and memory deficits through enhancing of Nrf2 antioxidant signaling pathways[J].Neuroscience Letters,2012,514(1) :46-50.
[10]Furukawa Yoshiko,Urano Tomomi,Minamimura Misato,et al.4- Methylcatechol - induced heme oxygenase - 1 exerts a protective effect against oxidative stress in cultured neural stem/progenitor cells via PI3 kinase/Akt pathway[J].Biomedical Research,2010,31(1) :45-52.
[11]Wu Aiguo,Ying Zhe.The interplay between oxidative stress and brain-derived neurotrophic factor modulates the outcome of a saturated fat diet on synaptic plasticity and cognition[J].European Journal of Neuroscience,2004,19(7) :1699-1707.
[12]Moon SK,Cho GO,Jung SY,et al.Quercetin exerts multiple inhibitory effects on vascular smooth muscle cells:role of ERK1/2 cell- cycle regulation,and matrix metalloproteinase - 9[J].Biochemical and Biophysical Research Communications,2003,301(4) :1069-1078.
[13]Mubeen Ahmad Ansari,Hafiz Mohammad Abdul,Gururaj Joshi,et al.Protective Effect of Quercetin in Primary Neurons Against Aβ(1-42) :Relevance to Alzheimer's Disease[J].J Nutr Biochem,2009,20(4) :269-275.
[14]Florencia Arredondo,Carolina Echeverry,Juan A Abin-Carriquiry,et al.After cellular internalization,quercetin causes Nrf2 nuclear translocation,increases glutathione levels,and prevents neuronal death against an oxidative insult[J].Free Radical Biology & Medicine,2010,49(5) :738-747.
[15]Liu Shuang,Hou Wei,Yao Ping,et al.Heme oxygenase-1 mediates the protective role of quercetin against ethanol-induced rat hepatocytes oxidative damage[J].Toxicology in Vitro,2012,26(1) :74-80.
