腹壁下动脉穿支皮瓣带蒂移植修复股部残端软组织缺损
2013-08-07张功林甄平陈克明杨荣华谭庆强赵来绪杨军林
张功林 甄平 陈克明 杨荣华 谭庆强 赵来绪 杨军林
随着显微外科技术的发展,临床应用吻合血管的皮瓣与肌皮瓣修复四肢软组织缺损较为广泛,但皮瓣臃肿及对供区损伤较大仍是该项技术的缺陷。近年来,穿支皮瓣的兴起,不仅解决了受区皮瓣臃肿的问题,而且,大大降低了对供区肌肉与血管的损伤[1-4]。2006 年1 月至2012 年1 月,我们应用带蒂腹壁下动脉穿支皮瓣移植修复同侧股部残端软组织缺损取得满意效果。
1 资料与方法
1.1 临床资料
本组12 例,男9 例,女3 例。年龄22~55 岁,平均36 岁。均为股部高能量损伤,肢体毁损性离断。损伤平面:股部近侧1/3;3 例,中1/3,9 例。损伤原因:交通事故伤6 例,重物砸伤4 例,机械性损伤2 例。8 例为保留肢体长度,遗留股部残端创面,4 例为外伤性截肢后发生残端组织坏死创面。创面匀有不同程度的炎性肉芽组织与坏死组织。9 例清创后伴有骨外露。创面大小:5cm×10cm~6cm×14cm。切取皮瓣大小:7cm×20cm ~9cm×28cm。左侧8 例,右侧4 例。均为陈旧性病例,伤后时间:6~28 天,平均12 天。采用腹壁下动脉外侧支为血供的皮瓣9 例,内侧支为血供的皮瓣3 例。
1.2 手术方法
采用全麻,取平卧位。先行受区创面清创,去除创面坏死与炎性肉芽组织并环形切除条件较差的皮缘,反复用3%的双氧水冲洗创面。然后,比受区创面稍大,在同侧腹部设计腹壁下动脉穿支皮瓣。按术前用Doppler 血流探测仪探测到血管穿出点在脐旁的位置,因而皮瓣近端设计在脐旁,将血管穿出点包括在皮瓣近端。远端朝向肩胛下角,其蒂部设计在腹股沟韧带中点。在深筋上将皮瓣从远端向脐旁游离(图1),在腹外斜肌腱膜和腹直肌前鞘表面,首先找到外侧肌皮穿支,再继续向内侧解剖,可找到内侧肌皮穿支。确定最大的一支为血管蒂后,在其穿出点剪开腹直肌前鞘,纵向钝性分离穿支周围的肌纤维,结扎小的血管分支,追寻穿支至腹壁下血管主干,取得足够长的血管蒂,注意保留腹直肌纤维和进入肌肉的神经的完整性。用切开隧道法将皮瓣以腹壁下动脉为蒂,旋转180°转移至受区修复股部残端创面(图2)。供区创面一期缝合修复,特别注意在腹直肌前鞘切开处行粗丝线加强缝合。
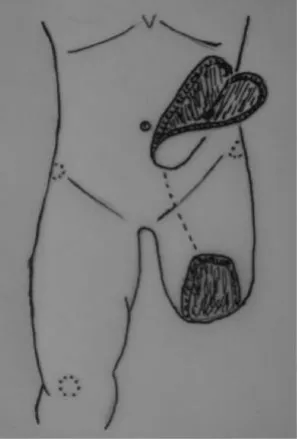
图1 皮瓣切取示意图
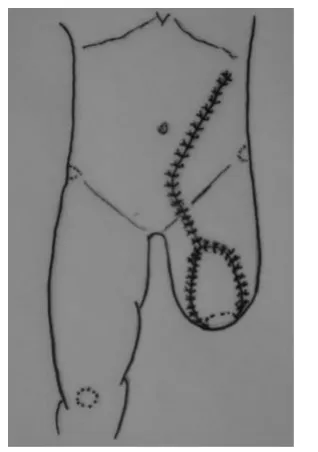
图2 皮瓣旋转180°修复股部残端创面
2 结果
本组皮瓣移植术后经过顺利,没有发生皮瓣血运障碍。术后一周内皮瓣稍有些肿胀,一周后自然消退。1 例皮瓣发生小的皮缘裂开,术后1 个月自然愈合。1 例受区皮瓣远端皮缘发生小的炎性渗出,经两周局部换药逐渐愈合。皮瓣全部成活,供区切口愈合好。术后随访1.8~4.0 年,平均2.8 年,受区皮瓣外形良好,局部不臃肿,不需行皮瓣修薄术。供区与受区愈合满意,供区没有发生腹壁切口疝和腹肌无力等并发症。供区无明显功能丧失。修复后的残端外形没有影响应用假肢,没有发生受区皮肤磨破与溃疡。取得了满意的治疗效果(典型病例见图3~6)。
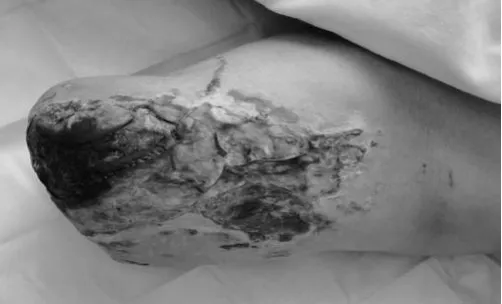
图3 术前左股部残端外形
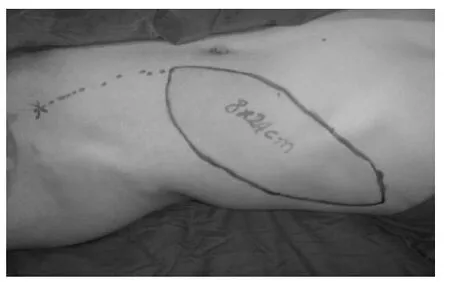
图4 皮瓣设计
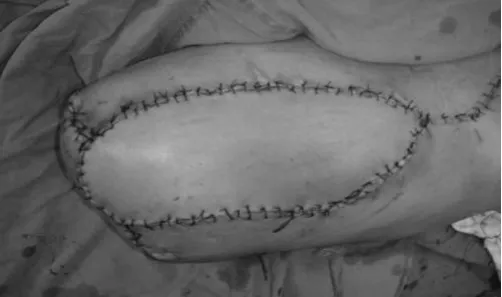
图5 皮瓣修复后残端外形
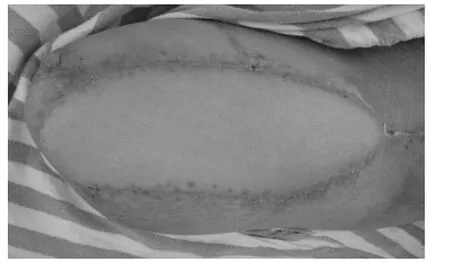
图6 术后4 周外形
3 讨论
近年来,以穿支为基础的皮瓣在临床应用与解剖学研究发展较快,其定义是皮瓣由肌皮穿支供养,穿支较恒定且口径适宜,皮瓣切取时不连带其下肌肉,减轻了对供区的损伤,皮瓣较薄以及修复后的受区外形满意等优点是穿支皮瓣的特点。这是由传统的肌皮瓣逐渐发展而来的[5],从肌肉中游离穿支血管,但不切取肌肉,对供区肌肉与血管的损伤降低到了最低的程度。腹壁下动脉穿支皮瓣是临床应用最多、最具有代表性的皮瓣之一,其次为股前外侧、臀部以及胸背动脉穿支皮瓣等[6,7]。Kim 等[8]曾报告应用带蒂腹壁下动脉肌皮穿支皮瓣修复臀部瘢痕孪缩取得满意效果。
为了佩戴假肢所需保留的最短股骨长度是从大粗隆尖部向下15cm,最长为25cm。本组应用本文介绍的方法修复股部残端创面,保留了肢体佩戴假肢所需的长度。该方法与吻合血管的皮瓣移植相比,由于不吻合血管,不需要显微外科设备与技术,受区与供区同一体位,手术操作方便。不损伤受区主要血管,手术方法相对简单、安全。与带蒂腹直肌皮瓣相比,最大的优势是:不切取供区肌肉,降低了对供区的损伤。受区不臃肿,不需二期行皮瓣修薄术。
根据Fansa 等[9]的解剖学研究表明:腹壁下动脉肌皮穿支存在率为97.3%。穿支穿出点距腹中线3.3cm,位于脐下0.9cm。但穿支类型因人而异,穿支的变异较为常见[10]。因而能在术中辨认穿支,并将其游离出来,是手术取得成功的重要因素。Moon和Talor 将腹壁下动脉的穿支血管分为3 种类型[11],Ⅰ型为单支型,Ⅱ型为双支型,Ⅲ型为三支型,前两种类型临床较常见。在本组单支型仅发现1 例,11 例为双支型。穿支的口径与行程也是重要因素,鉴别最佳的穿支(>1mm),单支口径是最重要的。穿支在肌肉内行程短,就会减少在肌内解剖的范围,可以减轻对肌肉的损伤,最大限度地保存肌肉功能,以降低术后发生腹壁并发症的机会[12,13]。
穿支血管的位置和口径的选择可通过CT 血管造影(Computed tomographic angiography,CTA)和核磁血管造影(Magnetic resonance angiography,MRA)来确定,这两种方法尽管能够精确地预先判定穿支血管的管径、位置、走行,让术者事先确定好哪支穿支最优化,管径较大、肌肉段较短、位置较佳[9,14-16]。但是,我们体会应用:①根据Fansa 等[9]的提出的穿支穿出点距腹中线3.3cm,位于脐下0.9cm 的大体位置。②术前应用Doppler 检查提示血管穿支的位置。③通过术中解剖和游离出的穿支确定穿支血管质量。这3 点就能达到对穿支血管的选择目的。本组没有应用CTA 和MRA 检查方法,就是利用这3 点选择穿支血管,认为具有经济、实用和可操作性好的优点。
腹壁下动脉走行在腹直肌与其前鞘之间,在其向上走行过程中,部分血管纵向走行在腹直肌内,外侧支在上端靠近进入腹直肌的运动神经。术中如果对外侧支行较广泛的游离,有损失该神经的可能,会导致腹直肌失神经支配,造成腹直肌力量减弱,影响腹直肌的功能。会丧失保存肌肉功能不受损的优点[7]。我们在操作中特别重视了对腹直肌神经的保护,在术后随访中没有发生腹壁切口疝和腹肌无力等并发症。
我们体会:带蒂转移的术式安全可靠,适用于会阴部、股部以及膝部创面的修复,优于吻合血管的皮瓣移植。为了增加皮瓣旋转的长度,可将皮瓣向上设计,但要注意血管穿出点要包括在皮瓣近端。皮瓣旋转时,其蒂部防止受压与打折,勿使其有张力对皮瓣的成活较为重要。切取皮瓣时对穿支血管的游离的技术要求高,穿支血管有过细或变异的可能,是该方法的不足之处。
[1] 张功林,章鸣,郭翱,等.腓肠内侧动脉穿支带蒂皮瓣修复膝和小腿上1/3 软组织缺损[J]. 中华显微外科杂志,2008,31(4):246-248.
[2] Park JJ,Campbell KA,Mercuri JJ,et al.Updates in the management of orthopedic soft-tissue injuries associated with lower extremity trauma[J].Am J Orthop,2012,41(2):27-35.
[3] Zhu L,Wei J,Daluvoy S,et al.Free partial latissimus dorsi myocutaneous flap for coverage of severe achilles contracture in children[J].J Plast Reconstr Aesthet Surg,2013,66(1):113-119.
[4] Yeung LC,Ellstrom CL,Martin MC.A donor-site preference utility study for three flaps used in lower extremity microvascular reconstruction[J].Ann Plast Surg,2011,66(1):59-61.
[5] Cappiello J,Piazza C,Taglietti V,et al.Deep inferior epigastric artery perforated rectus abdominis free flap for head and neck reconstruction[J].Eur Arch Otorhinolaryngol,2012,269(4):1219-1224.
[6] 张世民,唐茂林,章伟文,等.穿支皮瓣的名词术语与临床应用原则[J].中国临床解剖学杂志,2011,29(6):599-601.
[7] Garvey PB,Salavati S,Feng L,et al.Perfusion-related complications are similar for DIEP and muscle-sparing free TRAM flaps harvested on medial or lateral deep inferior epigastric Artery branch perforators for breast reconstruction[J]. Plast Reconstr Surg,2011,128(6):581-589.
[8] Kim KS,Kim ES,Hwang JH,et al.Buttock reconstruction using a pedicled deep inferior epigastric perforator flap[J]. Microsurgery,2011,31(3):237-240.
[9] Fansa H,Schirmer S,Frerichs O,et al.Significance of abdominal wall CT-angiography in planning DIEA perforator flaps, TRAM flaps and SIEA flaps[J].Handchir Mikrochir Plast Chir,2011,43(2):81-87.
[10] Rozen WM,Ashton MW,Grinsell D.The type 4 DIEA:A newly identified branching pattern of the deep inferior epigastric artery[J].Plast Reconstr Surg,2010,126(2):86e-87.
[11] Moon HK,Taylor GI.The vascular anatomy of rectus abdominis musculocutaneous flaps based on the deep superior epigastric system[J].Plast Reconstr Surg,1988,82(5):815-832.
[12] Chowdhry S,Hazani R,Collis P,et al.Anatomical landmarks for safe elevation of the deep inferior epigastric perforator flap:a cadaveric study[J].Eplasty,2010,28(10):41.
[13] Garvey PB, Salavati S, Feng L, et al.Abdominal donor-site outcomes for medial versus lateral deep inferior epigastric artery bra-nch perforator harvest[J]. Plast Reconstr Surg, 2011, 127(6):2198-2205.
[14] Aubry S,Pauchot J,Kastler A,et al. Preoperative imaging in the planning of deep inferior epigastric artery perforator flap surgery[J].Skeletal Radiol,2013,42(3):319-327.
[15] 崔怀瑞,吴东方,唐茂林,等.腹壁下动脉穿支皮瓣的应用解剖学研究[J].中国临床解剖学杂志,2011,29(6):614-618.
[16] Figus A,Wade RG,Gorton L,et al.Venous perforators in DIEAP flaps: an observational anatomical study using duplex ultrasonography[J].Plast Reconstr Aesthet Surg,2012,65(8):1051-1059.
