促黄体激素释放激素a(LHRHa)靶向鸦胆子油脂质体的制备及质量评价
2013-08-07刘晓娟常淑芳孙江川叶红霞曾飚朱轶朱深银王驰
刘晓娟,常淑芳,孙江川,叶红霞,曾飚,朱轶,朱深银,王驰
促黄体激素释放激素a(LHRHa)靶向鸦胆子油脂质体的制备及质量评价
刘晓娟,常淑芳,孙江川,叶红霞,曾飚,朱轶,朱深银,王驰
目的制备促黄体激素释放激素a(LHRHa)靶向鸦胆子油脂质体并评价其质量。方法采用薄膜分散法结合生物素-链霉亲和素桥接法制备LHRHa靶向鸦胆子油脂质体,正交设计优选处方,透射电镜下观察脂质体形态,采用Zetasizer Nano ZS分析仪测定脂质体粒径、Zeta电位,葡聚糖凝胶柱层析结合分光光度法测定包封率,通过离心加速实验及渗漏率考察脂质体稳定性,体外细胞实验鉴定脂质体靶向性。结果所得优化处方为磷脂与胆固醇比4:1,药物与脂质比3:10,DSPE-PEG-Biotin与卵磷脂质量比为3%,超声乳化时间为8min。按此处方制备的脂质体形态圆整,粒径为155.1±14.5nm,Zeta电位为–24.1±0.54mV,平均包封率达92.2%,对卵巢癌A2780/DDP细胞的亲和力约为普通脂质体的2.7倍。结论LHRHa靶向鸦胆子油脂质体制备工艺可行,同时具有包封率高、稳定性及靶向性良好等优点。
鸦胆子油脂质体;促黄体激素;卵巢肿瘤
鸦胆子油是苦木科植物鸦胆子的干燥果实经石油醚提取所得的脂肪油[1],是目前公认的有效抗癌中药之一,临床常用于肝癌、卵巢癌、胰腺癌[2]等多种肿瘤的辅助治疗。随着鸦胆子油及其制剂的广泛应用,有关其不良反应的报道也越来越多。制备鸦胆子油靶向制剂是降低其毒性,进一步提高疗效的关键。但目前有关鸦胆子油靶向制剂的制备尚未见文献报道。促黄体激素释放激素受体(LHRH-R)是近年来发现的新的卵巢癌治疗靶点[3],据报道携带LHRHa的靶向制剂对卵巢癌细胞具有良好的靶向性[4[4]制备LHRHa靶向鸦胆子油脂质体,以包封率为指标,采用正交实验筛选并优化处方和制备工艺,同时对其质量及体外靶向性进行评价。
1 材料与方法
1.1主要试剂及仪器 大豆卵磷脂(lipoid S100,德国Lipoid GmbH公司);生物素化聚乙二醇-二硬脂酰磷脂酰乙醇胺(DSPE-PEG-Biotin,美国Sigma公司);生物素化LHRHa(北京中科亚光生物科技有限公司);链霉亲和素(streptavidin,SA,北京博奥森公司);鸦胆子油(辽宁营口市新港药材厂);Sephadex G-50葡聚糖凝胶(上海浩然生物技术有限公司);氯仿、甲醇等试剂均为分析纯。NanoDrop 2000分光光度计(美国Thermo Scientific公司);Zetasizer Nano ZS90分析仪(英国M alvern公司);H-7500透射电镜仪(日本HITACHI公司);TCS-SP2型激光共聚焦显微镜(德国Leica公司)。
1.2LHRHa靶向鸦胆子油脂质体的制备 精密称取大豆卵磷脂(SPC)80mg、胆固醇20mg、DSPEPEG-Biotin 240μg、鸦胆子油30mg,溶于氯仿-甲醇(5:1)的混合溶剂,真空减压旋转蒸干形成均匀脂质薄膜,充入氮气,加入磷酸盐缓冲液旋转洗膜,水浴超声使溶液分散形成稳定体系,依次过0.45μm、0.22μm微孔滤膜除菌,获得生物素化脂质体混悬液。加入链霉亲和素溶液,4℃振摇30min使其充分反应;加入生物素化LHRHa,4℃震荡反应30m in;过Sephadex G-50柱除去游离物质,得到LHRHa靶向鸦胆子油脂质体。同时制备空白脂质体。分装至西林瓶中,4℃冰箱避光保存备用。
1.3脂质体形态、粒径、Zeta电位检测 取LHRHa靶向鸦胆子油脂质体液适量,PBS稀释后用1%磷钨酸溶液负染,滴至铜网上晾干,在透射电镜下观察脂质体形态、粒径并摄制照片。用Zetasizer Nano ZS分析仪测定脂质体Zeta电位。
1.4正交实验设计与处方优化 在单因素实验基础上,采用正交实验优化LHRHa靶向鸦胆子油脂质体的处方和制备工艺,以包封率作为考察指标。影响LHRHa靶向鸦胆子油脂质体粒径大小与包封率的主要因素包括卵磷脂与胆固醇质量比(A)、药物与脂质的质量比(B)、DSPE-PEG-Biotin与卵磷脂质量比(C)、超声乳化时间(D)。上述4种因素各取3个水平,采用正交设计L9(34)对处方进行优化(表1)。
1.5质量控制
1.5.1线性关系 用紫外分光光度仪测得鸦胆子油溶液最大吸收波长为234nm,故选择234nm为测定波长。取鸦胆子油标准品适量,用甲醇配成浓度为0.89、1.78、2.67、3.56、4.45mg/m l系列标准液,在234nm处测定以上各溶液的吸光度(A)值。以A值对浓度(c)进行线性回归,回归方程为A=0.127c+0.007(r=0.9995,n=5)。结果表明,溶液在0~4.45mg/m l范围内线性关系良好。

表1 正交实验因素-水平表Tab.1 Factors and levels of orthogonal experiment
1.5.2精密度实验 分别取低、中、高3个浓度的鸦胆子油标准液,在1d内不同时间重复测定5次,计算日内精密度。另每日测定1次,连续测定5d,计算日间精密度。
1.5.3柱回收率 分别移取鸦胆子油标准液0.1、0.3、0.5m l进行柱层析,收集游离药物组分后稀释定容,于234nm处测定A值,代入标准曲线计算柱回收率。
1.5.4洗脱曲线 取LHRHa靶向鸦胆子油脂质体混悬液上柱(经水溶胀的葡聚糖凝胶柱),以PBS为洗脱液,分离脂质体和游离药物。收集脂质体流份用10% Tritonx-100溶液破乳后稀释,于234nm处测定A值。洗脱曲线如图1所示,最先流出的1~8m l为脂质体混悬液,12~16m l为游离物质溶液。

Fig.1 Elution curve of LHRHa-targeted Bruceajavanica oil liposome
1.5.5包封率测定 精密移取LHRHa靶向鸦胆油脂质体液0.5m l上柱,以PBS洗脱,收集1~8m l流份共8m l,混合均匀,用10% Tritonx-100溶液膜稀释后测定A值,由标准曲线计算脂质体中包封药量。按2005年版《中国药典》规定[5],计算包封率。包封率=(W总-W游)/W总×100%。W总为总药量,W包为包入脂质中的药量,W游为未包入脂质体的药量。
1.6稳定性考察
1.6.1离心加速实验 将按最优处方制备的LHRHa靶向鸦胆子油脂质体进行离心加速实验(4℃,1000r/m in,离心5m in)。用分光光度计测定脂质体离心前后234nm处A值的变化,求稳定性参数KE。,其中A0为脂质体离心前的A值,A为脂质体离心后的A值。
1.6.2脂质体在不同贮存条件下的稳定性 将LHRHa靶向鸦胆子油脂质体分装至西林瓶于4℃、25℃条件下密闭避光保存,间隔一定时间取样考察外观、渗漏率。按1.5.5中的方法测定不同时间包封率,并计算渗漏率。渗漏率=(W包-W储)/W包×100%,其中W包、W储分别为制备时的包封率和贮存一定时间后的包封率。
1.7体外靶向性鉴定 以香豆素-6(一种绿色荧光物质)为模型药物,按1.2方法分别制备包载香豆素-6的普通脂质体(A)和LHRHa靶向脂质体(B)。取培养好的卵巢癌A2780/DDP细胞(表达LHRH受体),分别加入上述两种脂质体,2h后在激光共聚焦显微镜下观察细胞荧光强度。
2 结 果
2.1脂质体形态、粒径、Zeta电位 镜下见脂质体外观圆整,粒径分布均匀(图2)。制得的脂质体经多次滤膜过滤后粒径为155.1±14.5nm,多分散系数(PDI)为0.227,符合正态分布规律。Zetasizer Nano ZS分析仪测定结果显示脂质体荷负电,为–24.1±0.54mV。
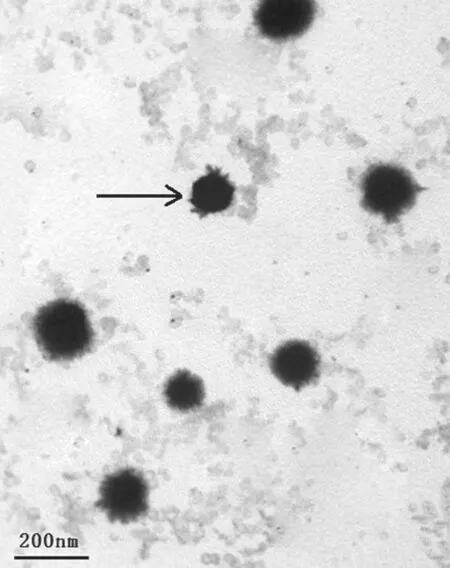
图2 LHRHa靶向鸦胆子油脂质体透射电镜照片(×25 000)Fig.2 Transm ission electron m icroscopic photograph of LHRHa-targetedBruceajavanicaoil liposome (×25 000)
2.2正交实验结果 对表2结果进行直观分析,由极差R可知对包封率(EE%)的影响由高到低依次为B>A>C>D。在实验所选范围内,药物与脂质的质量比是主要影响因素,最佳处方工艺组合为B3A3C2D3,即选择卵磷脂与胆固醇之比为4:1,药物与脂质比为3:10,DSPE-PEG-Biotin质量为卵磷脂的3%,超声乳化时间为8min。

表2 L9(34)正交实验结果Tab.2 Results of L9(34)orthogonal design

表3 LHRHa靶向鸦胆子油脂质体离心加速实验结果(n=3)Tab.3 Centrifugal acceleration experiment results of LHRHatargetedBruceajavanicaoil liposomes (n=3)

表4 LHRHa靶向鸦胆子油脂质体不同时间渗漏率(%)Tab.4 Percolation rates at different times of LHRHa-targetedBruceajavanicaoil liposomes
2.3结果验证 按2.2项中所得处方B3A3C2D 3制备LHRH a靶向鸦胆子油脂质体3批,包封率分别为90.4%、92.6%、93.5%,平均包封率为92.2%±1.59%,表明按该处方制备的脂质体包封率高,且重现性良好。
2.4精密度及柱回收率 计算日内、日间精密度,其RSD均小于2%,表明精密度良好。平均柱回收率为98.62%,RSD为1.80%,符合实验要求。
2.5初步稳定性考察 表3中数据表明,稳定性参数KE变化较小,脂质体稳定性良好。考察脂质体在不同贮存条件下的稳定性,结果显示4℃条件下脂质体混悬液放置15d为浅白色,无分层、沉淀现象,25℃放置1周即出现大量絮状沉淀,外观浑浊,如表4中数据所示,说明靶向脂质体在4℃条件下保存可提高其稳定性。
2.6体外靶向性实验结果 激光共聚焦显微镜观察(图3)可见,A组细胞内仅有微弱荧光,荧光值为38.5±3.8,而B组细胞内出现明亮的绿色荧光,荧光值为103.8±6.4,约为A组的2.7倍,表明LHRHa靶向脂质体对表达LHRH受体的卵巢癌细胞具有较强的靶向亲和能力。

图3 卵巢癌A2780/DDP细胞对香豆素-6脂质体(A)及LHRHa靶向脂质体(B)的摄取情况Fig.3 Intake of coumarin-6 liposomes (A) and LHRHatargeted liposomes (B) by ovarian cancer A2780/DDP cells
3 讨 论
卵巢癌是女性生殖系统三大恶性肿瘤之一,早期诊断困难,且晚期患者5年生存率较低[6]。肿瘤细胞减灭术辅以化疗是治疗卵巢癌的重要手段,但传统的化疗药物缺乏靶向性,在杀伤肿瘤细胞的同时易对机体正常组织造成损害,产生不良反应。因此,靶向药物的研发成为卵巢癌化疗的热点问题。鸦胆子油为脂溶性药物,易包裹入脂质体微粒,且研究发现其在杀死肿瘤细胞的同时可提高机体的免疫功能,并逆转肿瘤对传统化疗药物的耐药性[7]。近年来文献报道,LHRHa靶向抗肿瘤药物及其脂质微泡对卵巢癌细胞具有良好的靶向性[4,8]。本实验采用薄膜分散法及生物素-链霉亲和素桥接法制备LHRHa靶向鸦胆子油脂质体,将我国传统中药与脂质体结合制备成主动靶向制剂,以期为卵巢癌靶向药物治疗提供新的方向。
本研究采用正交设计优化处方,结果发现,在卵磷脂与胆固醇之比为4:1,药物与脂质比为3:10,DSPE-PEG-Biotin质量为卵磷脂的3%,超声乳化时间为8m in条件下鸦胆子油的平均包封率达到92.2%,且重现性好,后续实验即按该处方比进行。经透射电镜观察,该靶向脂质体为球形,粒径为155.1±14.5nm,脂质体表面带负电,Zeta电位为–24.1±0.54mV,均符合实验要求。
脂质体稳定性是反映脂质体质量的主要指标。本研究结果显示,离心加速前后该脂质体在234nm处的吸光度值没有明显变化,其稳定性参数KE变化较小,提示该靶向脂质体可耐受离心加速过程。贮存温度及时间也是影响脂质体稳定性的重要条件,本研究在4℃、25℃条件下连续观察该脂质体的外观形态及渗漏率,结果发现:4℃条件下脂质体混悬液放置15d内为浅白色,无分层、沉淀现象;25℃放置1周即出现大量絮状沉淀,外观浑浊,随着放置时间延长而明显。在4℃贮存条件下,脂质体渗漏率低,但在25℃贮存条件下渗漏率明显增加,提示该靶向脂质体在4℃条件下保存可提高稳定性。
脂质体的靶向性是决定其能否用于靶向治疗的关键。本研究将包载香豆素-6的普通脂质体及LHRHa靶向脂质体与卵巢癌A2780/DDP细胞分别共同培养2h,激光共聚焦显微镜下观察发现LHRHa靶向脂质体组细胞内荧光强度是普通脂质体组的2.7倍,提示卵巢癌细胞对LHRHa靶向脂质体的摄取能力明显增加,该脂质体具有体外寻靶功能。本研究为鸦胆子油脂质体用于卵巢癌的靶向治疗提供了实验依据。
[1] Yu YL, Lu Y, Tang T,etal. Form ulation, p reparation and evaluation of an intravenous emulsion containingBruceajavanicaoil and coix seed oil for anti-tumor application[J]. Biol Pharm Bull, 2008, 31(4): 673-680.
[2] Lau ST, Lin ZX, Zhao M,etal.Bruceajavanicafruit induces cytotoxicity and apoptosis in pancreatic adenocarcinoma cell lines[J]. Phytother Res, 2008, 22(4): 477-486.
[3] Ko SY, Guo H, Barengo N,etal. Inhibiton of ovarian cancer grow th by a tum or-targeting pep tide that binds eukaryotic translation initiation factor 4E[J]. C lin Cancer Res, 2009, 15(13): 4336-4347.
[4] Guo J, Chang SF, Sun JC,etal. Preparation andinvitrotargeting experiment of LHRHa targeted m icrobubble contrast agent[J]. Chin J Med Imaging Technol, 2011, 27(3): 466-469. [郭娟, 常淑芳, 孙江川, 等. LHRHa靶向微泡造影剂的制备及体外寻靶实验[J]. 中国医学影像技术, 2011, 27(3): 466-469.]
[5] The State Pharmacopoeia Comm ittee. Chinese Pharmacopoeia (Part Ⅱ)[M]. Beijing: Chem ical Industry Press, 2005. 181. [国家药典委员会. 中华人民共和国药典(二部)[M]. 北京: 化学工业出版社, 2005, 181.]
[6] Siegel R, Naishadham D, Jemal A. Cancer statistics, 2012[J]. CA Cancer J Clin, 2012, 62(1): 10-29.
[7] Chen D, Chen P, Zhu M,etal. Reversal effect ofBruceajavanicaoil emulsion on drug-resistant human ovarian cancer cell A2780/ DDP[J]. Chin Emerg Med, 2009, 18(4): 598-599. [陈丹, 陈萍,祝敏, 等. 鸦胆子油乳对人卵巢癌耐药细胞A2780/DDP的耐药逆转作用[J]. 中国中医急症, 2009, 18(4): 598-599.]
[8] Chang S, Guo J, Sun J,etal. Targeted m icrobubb les fo r ultrasound mediated gene transfection and apoptosis induction in ovarian cancer cells[J]. U ltrason Sonochem, 2013, 20(1): 171-179.
Preparation and quality evaluation of LHRHa-targeted Brucea javanica oil liposomes
LIU Xiao-juan1, CHANG Shu-fang1, SUN Jiang-chuan1, YE Hong-xia1, ZENG Biao1*, ZHU Yi1, ZHU Shen-yin2, WANG Chi3
1Department of Gynaecology and Obstetrics, Second Affiliated Hospital of Chongqing Medical University, Chongqing 400010, China
2Department of Pharmacy, First Affiliated Hospital of Chongqing Medical University, Chongqing 400016, China
3College of Pharmacy, Chongqing Medical University, Chongqing 400016, China
*
, E-mail: cqzb1018@yahoo.com.cn
This work was supported by the National Natural Science Foundation of China (30801228), the Key Item of Chongqing HealthBureau (2010-1-39), and the Key Project of Chongqing Traditional Chinese Medicine (2010-1-6)
ObjectiveTo prepare luteinizing hormone-releasing hormone a (LHRHa) targetedBruceajavanicaliposomes and evaluate its quality.MethodsThe LHRHa-targetedBruceajavanicaliposome was prepared by thin layer dispersion together with biotinstreptavidin bridge method. The optimum formation was selected by means of orthogonal design of experiment. The morphology of liposome was observed with transmission electron microscope. Zetasizer Nano ZS analyzer was used to measure the particle size and zeta potential. The entrapment efficiency was determ ined by ultra-violet spectroscopy and column chromatography. Centrifugal acceleration experiment and determ ination of leak rate were performed to prove the liposome stability. The targeting ability of liposome was appraised by cell experimentinvitro.ResultsThe formed optimum formula was as follows: the ratio of lecithin to cholesterol was 4:1,Bruceajavanicaoil:lipid was 3:10, DSPE-PEG (2000)-Biotin:lecithin content was 3%, ultrasonic-homogenized for 8 minutes. Liposomes were round in shape, the average diameter and zeta potential of liposome were 155.1±14.5mm and –(24.1±0.54) mV, respectively. The average entrapment efficiency was 92.2%. Binding capacity with the A2780/DDP cell line in the LHRHa-targeted liposomes was 2.7 times higher than that in the non-targeting liposomes.ConclusionThe technique of preparing LHRHa-targetedBruceajavanicaliposome is suitable, and high in entrapment efficiency, with good stability and targeting ability.
Bruceajavanicaliposomes; luteinizing hormone; ovarian neoplasms
R943
A
0577-7402(2013)07-0548-04
2013-02-11;
2013-04-22)
(责任编辑:李恩江)
国家自然科学基金(30801228);重庆市卫生局重点项目(2010-1-39);重庆市中医处重点项目(2010-1-6)
刘晓娟,医学硕士。主要从事肿瘤药物的靶向治疗研究
400010 重庆 重庆医科大学附属第二医院妇产科(刘晓娟、常淑芳、孙江川、叶红霞、曾飚、朱轶);400016重庆 重庆医科大学附属第一医院药剂科(朱深银);400016重庆 重庆医科大学药学院(王驰)
曾飚,E-mail:cqzb1018@yahoo.com.cn
