氨溴索对铜绿假单胞菌密度感应缺陷株生物膜细菌活力和黏附作用的影响
2013-08-07芦起钟海英林丽华林雅茵杨锡强余加林
芦起,钟海英,林丽华,林雅茵,杨锡强,余加林
氨溴索对铜绿假单胞菌密度感应缺陷株生物膜细菌活力和黏附作用的影响
芦起,钟海英,林丽华,林雅茵,杨锡强,余加林
目的研究氨溴索对铜绿假单胞菌野生株PAO1及密度感应缺陷株(ΔlasI ΔrhlI基因缺陷)生物膜(BF)细菌活力及早期黏附的影响。方法利用平板计数法测定不同浓度(0、1.875、3.75mg/m l)氨溴索对PAO 1菌株、ΔlasI ΔrhlI菌株生物膜菌落的清除效应;荧光多功能酶标仪检测不同浓度氨溴索作用后PAO1菌株、ΔlasI ΔrhlI菌株的荧光强度,计算黏附率以反映干预对细菌黏附的影响。结果氨溴索作用后,两种菌株的活菌生存率和黏附率均出现下降,ΔlasI ΔrhlI株活菌生存率较PAO 1株下降更明显(P<0.05),而PAO 1株黏附率较ΔlasI ΔrhlI株下降更明显(P<0.05)。结论氨溴索具有拮抗密度感应系统的作用,可用于抗细菌生物膜活力,为难治性铜绿假单胞菌感染的治疗提供了新思路。
氨溴索;假单胞菌,铜绿;细菌黏附;群体感应
细菌生物膜(biofilm,BF)是指细菌黏附于惰性或活性实体表面繁殖、分化并分泌大量胞外多聚基质(exopolymeric matrix,ECM)使它们相互粘连,并将自身克隆聚集缠绕其中形成的膜状物,人体细菌感染有65%涉及生物膜[1-2]。细菌生物膜引起的难治性感染是临床上常见的棘手问题。铜绿假单胞菌是临床上常见的生物膜感染的病原,如肺囊性纤维病、支气管扩张、慢性肺脓肿、各种插管合并感染等,病程长且常迁延不愈,抗生素治疗往往无法奏效[3]。氨溴索是临床常用药物,不仅是一种黏液溶解剂,还具有抗炎、抗氧化、抑制炎性介质、松弛气道平滑肌、促进肺表面物质的合成及与其他药物协同等作用[4-5]。细菌生物膜菌是由很多微菌落组成的群体组织,各细胞间通过严密的信号传递来交流信息,这种细胞与细胞的交流有赖于密度感应(quorum sensing,QS)系统[6]。QS系统调节着细菌群体的多种生理功能,已成为控制BF相关感染的新靶点。本研究从细菌清除率和细菌黏附率两个方面来研究氨溴索对铜绿假单胞菌QS系统的影响。
1 材料与方法
1.1受试菌株、药品及主要仪器 铜绿假单胞菌PAO 1野生株和QS系统缺陷株(ΔlasI Δrh lI基因缺陷)由丹麦哥本哈根大学临床微生物系宋志军博士馈赠。氨溴索标准品(中国药品生物制品检定所,批号20051011)。LB培养基,LB琼脂平板,PBS缓冲溶液(北京升博生物制品公司),LIVE/ DEAD®BacLightTM细菌荧光试剂盒(美国Molecular Probes公司)。96孔荧光酶标板(美国Corning公司),多功能荧光酶标仪(美国BioTek Synergy HT),紫外分光光度计(UV-1700,苏州岛津仪器有限公司),荧光显微镜(BX51,O lympus),超声破碎仪(JYD-150)。
1.2方法
1.2.1生物膜体外模型制备 两种菌株单菌落分别接种于L-Broth培养液中,37℃、180r/min震荡培养过夜。分光光度计测定菌液在600nm处的吸光度(A600)值,调整A600值至1.0。接种不同菌株菌液于预先放置无菌盖玻片(8mm×8mm,作为BF生长载体)的24孔细胞培养板中,每孔1m l,37℃培养,隔日换液。
1.2.2平板计数法测定不同浓度氨溴索对生物膜菌落的清除作用 生物膜培养3d,将玻片用PBS漂洗3次后分为空白对照组(未加氨溴索)及2个不同浓度(3.75、1.875mg/m l)的氨溴索作用组。8h后,洗去浮游菌,125W超声震荡15m in,取10μl加入LB平板计数。
1.2.3荧光多功能酶标仪测定不同浓度氨溴索对细胞黏附率的影响 过夜培养两种铜绿假单胞菌菌株,在600nm波长处调整分光光度计的读数至1.0,在96孔板每孔中加入菌液、不同浓度(3.75、1.875mg/m l)的氨溴索及PBS各100μl,作用4h后,以PBS洗涤3次,荧光染料SYTO9染96孔板底部细菌15m in,再以PBS洗去未结合染料,置于酶标仪中检测[7]。每组重复9孔。荧光多功能酶标仪参数如下。激发光滤光片:485nm/20;发射光滤光片:525nm/20;光学位置:bottom;灵敏度:auto;每孔样品检测次数:12次。通过荧光强度计算细菌黏附率。
1.3统计学处理 将菌落计数取常用对数(lg)后进行分析。采用SPSS 12.0统计软件,对数据进行正态性检验,均符合正态分布,组间比较采用单因素方差分析。P<0.05为差异有统计学意义。
2 结 果
2.1不同浓度氨溴索对生物膜菌落的清除效果 1.875、3.75mg/m l氨溴索作用8h后,PAO 1株存活率分别降至空白对照组的84.3%±0.3%、72.9%±0.6%,而QS系统缺陷株则降至空白对照组的76.1%±2%、68.8%±1%,与空白对照组比较差异均有统计学意义,且QS系统缺陷株存活率下降较PAO1株更为明显(P<0.05,表1)。
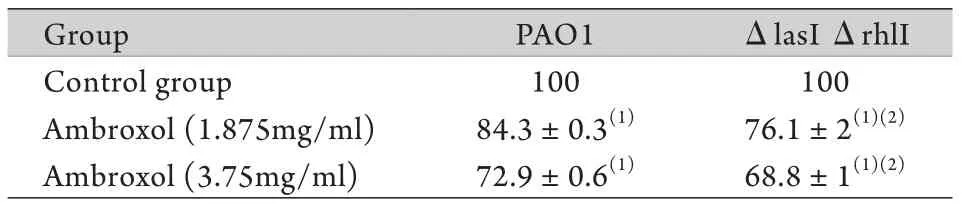
表1 PAO1以及QS系统缺陷株生物膜中细菌存活率(%)Tab.1 Survival rate of bacteria on the biofilms of PAO1 and QS mutant strains (%)
2.2不同浓度氨溴索对细菌黏附率的影响1.875、3.75ng/m l氨溴索作用4h后,PAO 1菌株的黏附率分别降至空白对照组的23.8%±1.8%、17.1%±3.4%,QS系统缺陷株分别降至空白对照组的52.3%±1.7%、35.3%±5.7%,与空白对照组比较差异均有统计学意义,且PAO1株黏附率下降较QS系统缺陷株更为明显(P<0.05,表2)。

表2 PAO1以及QS系统缺陷株生物膜中细菌黏附率(%)Tab.2 Adhesion rate of bacteria on the biofilms of PAO1 and QS mutant strains (%)
3 讨 论
近年来随着医疗技术的不断提高,细菌生物膜所致的慢性感染也日益受到人们的重视,如生物材料相关感染以及气管和尿道插管相关感染等[8]。铜绿假单胞菌是呼吸道生物膜感染的主要致病菌,由于生物膜极难被抗生素清除,因此,重症监护室气管插管患者以及介入患者的治疗难度明显加大,甚至危及患者生命。本研究结果表明,氨溴索对QS系统缺陷株以及PAO 1野生株均有清除作用,但对QS系统缺陷株的清除效果更好。M ittal等[9]报道QS系统能调节铜绿假单胞菌多种毒力因子如外毒素A、弹性蛋白酶、蛋白酶、鼠李糖脂、青脓素的表达,而这些毒力因子对维持生物膜的结构具有重要作用,提示氨溴索对QS系统缺陷株清除效果更好可能与毒力因子的表达降低有关。
细菌生物膜的形成和发展是一个动态过程,一般分为5个阶段:最初的定植阶段、不可逆黏附阶段、结构分化阶段、发展成熟阶段和解聚再定植阶段[10-11]。细菌对宿主表面的黏附是形成生物膜的第一步,细菌黏附可分为可逆性和不可逆性两个阶段。QS系统在不可逆阶段开始活化。细菌的黏附能力被认为是评价细菌生物膜形成能力的重要指标[12]。本研究首先探讨了氨溴索是否可以降低铜绿假单胞菌的黏附能力,结果表明氨溴索作用后PAO1野生株以及QS系统缺陷株的黏附率都出现了下降,且PAO1株黏附率下降较QS系统缺陷株更明显,提示氨溴索干预了铜绿假单胞菌的QS系统。由于QS系统缺陷株黏附率也出现了下降,提示QS系统并不是调节铜绿假单胞菌黏附的唯一因素,其他的调节因素如鞭毛、菌毛、胞外多糖、藻酸盐等也起到一定作用。
综上所述,本研究证实氨溴索具有拮抗QS系统ΔlasI ΔrhlI的特性,提示其在降低生物膜形成以及预防感染方面具有广泛的用途。同时本研究结果也为临床导管相关性铜绿假单胞菌生物膜感染的治疗提供了新的思路。
[1] Potera C. Forging a link between biofilm s and disease[J]. Science, 1999, 283(5409): 1837, 1839.
[2] Li HY, Xia QM, Li FX ,etal. Inhibitory effect of clindamycin on biofilm of mucoidP.aeruginosainvitro[J]. Med J Chin PLA, 2004, 29(10): 875-878. [李鸿雁, 夏前明, 李福祥, 等. 克林霉素对黏液型铜绿假单胞菌生物被膜的影响[J]. 解放军医学杂志, 2004, 29(10): 875-878.]
[3] Gup ta R, Schuster M. Quorum sensing m odu lates co lony m o rpho logy th rough alky l quino lones inPseudomonasaeruginosa[J]. BMC Microbiol, 2012, 12: 30.
[4] Jacob S, Sh irw aikar A. Preparation and evaluation of m icroencapsu lated fast m elt tab lets of am b roxo l hydrochloride[J]. Indian J Pharm Sci, 2009, 71(3): 276-284.
[5] Li DX, Li P, Zhou Y. Effects of atom ization inhalation of budesonide and ambroxol on stroke-associated pneumonia[J]. J Logist Univ CAPF (Med Sci), 2012, 21(12): 990-991, 994. [李东旭, 李鹏, 周阳. 布地奈德联合氨溴索雾化吸入治疗卒中相关性肺炎疗效观察[J]. 武警后勤学院学报(医学版), 2012, 21(12): 990-991, 994.]
[6] Girard G, Bloem berg GV. Central role of quorum sensing in regu lating the p roduction of pathogenicity factors inPseudomonasaeruginosa[J]. Future Microbiol, 2008, 3(1): 97-106.
[7] Boulos L, Prévost M, Barbeau B,etal. LIVE/DEAD BacLight: app lication of a new rap id staining m ethod fo r d irect enumeration of viable and total bacteria in drinking water[J]. J Microbiol Methods, 1999, 37(1): 77-86.
[8] Pires D, Sillankorva S, Faustino A,etal. Use of new ly isolated phages for control ofPseudomonasaeruginosaPAO1 and ATCC 10145 biofilms[J]. Res Microbiol, 2011, 162(8): 798-806.
[9] M ittal R, Sharma S, Chhibber S,etal. Contribution of quorumsensing systems to virulence ofPseudomonasaeruginosain an experimental pyelonephritis model[J]. J Microbiol Immunol Infect, 2006, 39(4): 302-309.
[10] Blander JM, Medzhitov R. Regulation of phagosome maturation by signals from toll-like receptors[J]. Science, 2004, 304(5673): 1014-1018.
[11] Singh PK, Schaefer AL, Parsek MR,etal. Quorum-sensing signals indicate that cystic fibrosis lungs are in fected with bacterial biofilms[J]. Nature, 2000, 407(6805): 762-764.
[12] Lin LH, Yu JL, Lin YY,etal. Effects of allitride on adhesion and exopolysaccharide ofPseudomonasaeruginosabiofilms[J]. Chin J Microecol, 2009, 21(1): 9-12. [林丽华, 余加林, 林雅茵. 大蒜素对铜绿假单胞菌生物膜早期黏附及胞外多糖的影响[J].中国微生态学杂志, 2009, 21(1): 9-12.]
Effects of ambroxol on biofilm adhesion and viability of Pseudomonas aeruginosa quorum sensing defective strain
LU Qi, ZHONG Hai-ying, LIN Li-hua, LIN Ya-yin, YANG Xi-qiang*, YU Jia-lin*
Department of Neonatology, Children′s Hospital of Chongqing Medical University; Key Laboratory of Developmental Diseases inChildhood Co-organized by the Province and Ministry of Education; Key Laboratory of Pediatrics in Chongqing, Chongqing InternationalScience and Technology CooperationCenter for Child Development and Disorder, Chongqing 400015, China
*
. YANG Xi-qiang, E-mail: xiqyang@163.com; YU Jia-Lin, E-mail: yujialin486@sohu.com
This work was supported by the National Natural Science Foundation of China (30772363,30901279), Medical Science Foundationof Chongqing Medical University and Talent Foundation of Chongqing Children′s Hospital
ObjectiveTo investigate the effects of ambroxol on the biofilm viability and pristine adhesion ofPseudomonasaeruginosawild (PAO1) and quorum sensing defective strain (QS, gene deletion of ΔlasI and ΔrhlI).MethodsThe biofilm was treated by different concentrations (0, 1.875, 3.75mg/m l) of ambroxol. The number of colony was measured with agar plate, multifunction fluorometer was used to measure the fluorescence intensity of PAO1 and QS strains at the bottom of 96-well plate. The adhesion ratio (%) was calculated to determine the effects of ambroxol on bacterial biofilm adhesion. ResultsAmbroxol treatment reduced the survival rate of the mutant strains compared to that of wild strain, even though the QS strain had increased the adhesion in the presence of ambroxol compared to that of wild strain (P<0.05).ConclusionAmbroxol has a property of significantly antagonizing quorum-sensing system, suggesting that it might be of importance in treatment against chronicPseudomonasaeruginosainfections.
ambroxol;Pseudomonasaeruginosa; bacterial adhesion; quorum sensing
R392
A
0577-7402(2013)07-0545-03
2013-03-20;
2013-05-18)
(责任编辑:张小利)
国家自然科学基金(30772363,30901279);重庆医科大学校级项目;2012年重庆医科大学附属儿童医院苗圃人才计划
芦起,医学博士,副主任医师,副教授。主要从事新生儿感染和免疫方面的研究
400015 重庆 重庆医科大学附属儿童医院新生儿科,儿童发育疾病研究省部共建教育部重点实验室,儿科学重庆市重点实验室,重庆市儿童发育重大疾病诊治与预防国际科技合作基地(芦起、钟海英、林丽华、林雅茵、杨锡强、余加林)
杨锡强,E-mail:xiqyang@163.com;余加林,E-mail:yujialin486@sohu.com
