聚肌胞苷酸、脂多糖及肽聚糖对人气道黏膜天然免疫功能影响的实验研究
2013-08-07张景熙赵立军石荟白冲李强
张景熙,赵立军,石荟,白冲,李强
聚肌胞苷酸、脂多糖及肽聚糖对人气道黏膜天然免疫功能影响的实验研究
张景熙,赵立军,石荟,白冲,李强
目的研究聚肌胞苷酸[Poly(I:C)]、脂多糖(LPS)及肽聚糖(PGN)对人气道黏膜屏障及炎性介质表达的影响,进而了解气道黏膜对不同Toll样受体配体的天然免疫应答反应。方法采用Transwell系统培养人16HBEs气道上皮细胞建立人气道黏膜体外模型,分别给予Poly(I:C)、LPS及PGN顶侧刺激,对照组仅给予MEM+GlutaMax-Ⅰ培养基培养。通过测定跨膜电阻抗(TER)判断16HBEs细胞间的小分子通透性,测定基底侧培养液中FITC-右旋糖酐浓度判断大分子细胞通透性,用ELISA法检测干预24h后培养细胞顶侧及基底侧上清液中IL-8、粒-巨噬细胞集落刺激因子(GMCSF)及TNF-α的蛋白含量。结果10μg/m l Poly(I:C)导致人气道上皮细胞间TER显著降低,FITC-右旋糖酐通透性增加(P<0.01),10μg/m l LPS及100μg/m l PGN刺激对气道上皮细胞TER及FITC-右旋糖酐通透性无明显影响。IL-8和TNF-α表达在Poly(I:C)、LPS及PGN组细胞顶侧和基底侧均较对照组显著增加(P<0.05)。GM-CSF表达在3组细胞顶侧均较对照组增加(P<0.05),仅Poly(I:C)组基底侧表达较对照组增加(P<0.05),LPS和PGN组基底侧与对照组比较无明显变化。Poly(I:C)组、LPS组和PGN组细胞顶侧IL-8和GM-CSF浓度增高程度高于基底侧,形成浓度梯度。结论Poly(I:C)可破坏气道黏膜屏障完整性,导致小分子和大分子通透性增加,同时刺激细胞定向向顶侧分泌炎性介质,LPS及PGN对气道黏膜屏障无影响,但能诱导细胞向顶侧定向分泌炎性介质,提示病毒及细菌感染所致气道炎症与Toll样受体通路介导的气道黏膜天然免疫应答有关。
气道上皮细胞;聚肌胞苷酸;脂多糖类;肽聚糖;免疫,天然;免疫,黏膜
人体呼吸道黏膜直接与外界相通,形成一道天然屏障抵御病原微生物的入侵[1]。作为机体防御系统的第一道防线,黏膜免疫发挥着重要作用,致病性病原体侵入机体后,首先遭遇到天然免疫的抵抗,随后产生获得性免疫,两者共同发挥防御作用[2]。病毒及细菌是引起下呼吸道感染的主要病原体,也是多种慢性气道疾病急性加重的重要诱因[3-4]。病毒或细菌进入下呼吸道后首先与气道黏膜接触,气道黏膜上皮细胞通过自身表达的多种模式识别受体来识别不同病原体并产生应答,参与病原体清除及气道炎症的发生[4-5]。
Toll样受体(Toll-like receptor,TLR)是一个重要的模式识别受体家族,其中TLR2、TLR3、TLR4分别特异性识别肽聚糖(peptidoglycan,PGN)、双链RNA及脂多糖(lipopolysaccharide,LPS)[6]。双链RNA是多种呼吸道病毒在细胞内的代谢产物,聚肌胞苷酸(polyinosinic:polycytidylic acid)简称Poly(I:C),是一种人工合成的双链RNA,能特异性地与细胞内TLR3结合,因其结构类似于多种病毒在细胞内代谢所产生的核糖核酸,常被用作病毒感染的模拟物[7]。PGN和细菌内毒素LPS分别是革兰阳性菌和革兰阴性菌的标志性结构,能够被上皮细胞表达的TLR2和TLR4特异性识别[8]。目前病毒及细菌感染相关的TLR特异性配体对气道黏膜天然免疫应答影响的研究较少。本研究采用气道黏膜体外模型,分别给予Poly(I:C)、LPS和PGN刺激,观察三者对气道黏膜体外模型天然免疫反应的影响。
1 材料与方法
1.1试剂与仪器 人支气管上皮细胞株16HBEs由英国南安普顿大学医学院Davies DE教授惠赠,Transwell培养皿购于Corning公司,Ⅰ型胶原购自Fremont公司,MEM+GlutaM ax-I培养基、胎牛血清(FBS)、青霉素、链霉素购自Gibco公司,铜绿假单胞菌内毒素(LPS)、PGN、4kD异硫氰酸荧光素-右旋糖酐(fluorescein-5-isothiocyanate dextra,FITC-Dextran)购自Sigma公司,ELISA试剂盒购自R&D公司。Fluoroskan Ascent FL2.5仪购自 Thermofisher Scientific公司。
1.2方法
1.2.1细胞培养及实验分组 将16HBEs细胞常规接种于含10%FBS的MEM+GlutaMax-I培养液(青霉素50U/m l,链霉素50μg/m l)的12孔Transwell培养板中,接种密度为0.15×106/m l,培养瓶提前30min用1:100 Ⅰ型胶原包被,置于37℃、5% CO2培养箱中培养1周。
实验分4组,即对照组,Poly(I:C)组,LPS组,PGN组,各组细胞在刺激前,顶侧和基底侧分别给予200μl MEM+GlutaMax-I培养液和500μl含10%FBS的MEM+GlutaMax-I培养液培养24h,然后按照分组分别给予10μg/m l Poly(I:C),10μg/m l LPS和100μg/ m l PGN刺激,对照组给予MEM+GlutaMax-I培养液。实验至少重复3次。
1.2.2细胞间离子通透性测定 通过测量跨膜电阻抗(trans-epithelial electrical resistance,TER)的方法测定细胞间离子通透性,采用EVOM上皮伏欧表(WPI公司)测定16HBEs细胞培养1周后的电阻,TER大于260Ω·cm2提示细胞生长融合良好、细胞间连接完整。分别测量刺激前及刺激后1、2、3、4、6、8、24h的TER值,记录刺激后各时间点TER占刺激前(记时间点为0h)TER值的百分比(%)。
1.2.3细胞间大分子通透性测定 测定FITC-右旋糖酐的浓度(μg/m l)以反映细胞间大分子通透性。按分组施加干预2h后在16HBEs细胞顶侧加入2mg/m l 4kD FITC-右旋糖酐,24h后应用Fluoroskan Ascent FL2.5仪测定基底侧培养基FITC-右旋糖酐吸光值,激发波长480nm,发射波长530nm,以乙二醇-双-(2-氨基乙醚)四乙酸(EGTA)刺激作为阳性对照。
1.2.4ELISA法测定白介素8(IL-8)、粒-巨噬细胞集落刺激因子(GM-CSF)及肿瘤坏死因子α(TNF-α)蛋白的表达 采用ELISA法检测刺激24h后顶侧及基底侧培养基中IL-8、GM-CSF及TNF-α的蛋白浓度,操作均严格按照试剂盒说明进行。先在酶谱仪上测量标准品吸光度并绘制标准曲线,然后测量样品吸光度(A)值,每个样品重复2孔检测,并根据测得的A值在标准曲线计算出样品浓度。
1.3统计学处理 应用GraphPad Prism 5.0软件进行资料录入、整理及统计分析,计量资料以±s表示,多组均数比较采用单因素方差分析。P<0.05为差异有统计学意义。
2 结 果
2.1细胞间通透性检测结果 10μg/m l Poly(I:C)从顶侧刺激16HBEs细胞2、3、4、6、8、24h后,TER均较对照组下降,分别为对照组相应时间点的89.9%、77.5%、77.1%、74.3%、73.2%、32.8%,差异有统计学意义(图1A),10μg/m l LPS或100μg/m l PGN从顶侧刺激16HBEs细胞后1、2、3、4、6、8、24h,TER与对照组比较均无明显下降,提示Poly(I:C)可增加16HBEs细胞间离子通透性,而LPS及PGN刺激对细胞间离子通透性无明显影响。
2.2细胞间大分子通透性检测结果 10μg/m l Poly(I:C)从顶侧刺激16HBEs细胞24h后,基底侧FITC-右旋糖酐浓度(295.81±45.46μg/m l)是对照组(75.81±5.82μg/m l)的3.9倍,差异有统计学意义(P<0.001),10μg/m l LPS和100μg/m l PGN从顶侧刺激16HBEs细胞24h后,细胞基底侧FITC-右旋糖酐浓度分别为84.59±8.96μg/m l和90.20±16.06μg/m l,与对照组比较无明显差异,提示Poly(I:C)可增加16HBEs细胞间大分子的通透性,而LPS及PGN刺激对细胞间大分子通透性并无明显影响(图1B)。
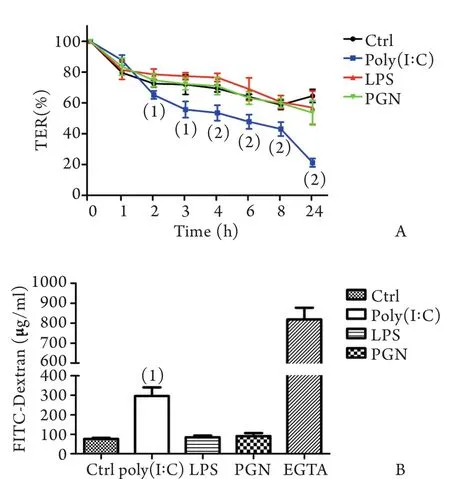
图1 Poly(I:C)(10μg/m l)、LPS(10μg/m l)、PGN(100μg/ m l)经Transwell系统顶侧刺激对16HBEs细胞间通透性的影响Fig. 1 Effect of apical stimulation of Poly(I:C)(10μg/m l), LPS(10μg/m l) and PGN(100μg/m l) on the permeability between cellsviatranswell system
2.3细胞分泌炎性介质IL-8、GM-CSF及TNF-α蛋白的检测结果 10μg/m l Poly(I:C)、10μg/m l LPS和100μg/m l PGN从顶侧刺激16HBEs细胞24h后,向顶侧分泌的IL-8蛋白水平均较对照组升高,分别是对照组的4.38、2.35、2.40倍,差异有统计学意义(P<0.01,表1),各刺激组向基底侧分泌的IL-8蛋白较对照组基底侧升高,分别是对照组的3.15、1.35、1.32倍,差异有统计学意义(P<0.01或P<0.05,表1)。
Poly(I:C)、LPS和PGN从顶侧刺激16HBEs细胞24h后,向顶侧分泌的GM-CSF蛋白水平均较对照组升高,分别是对照组的13.64、3.68、3.31倍,差异有统计学意义(P<0.01),Poly(I:C)刺激组向基底侧分泌的GM-CSF蛋白较对照组升高,是对照组的1.53倍,差异有统计学意义(P<0.05),LPS和PGN刺激组向基底侧分泌的GM-CSF蛋白与对照组比较无明显差异(表1)。
Poly(I:C)、LPS和PGN从顶侧刺激16HBEs细胞24h后,向顶侧分泌的TNF-α蛋白水平均较对照组明显升高,分别是对照组的4.22、1.81、2.02倍,差异有统计学意义(P<0.01),各刺激组向基底侧分泌的TNF-α蛋白较对照组明显升高,分别是对照组的4.82、1.83、2.03倍,差异有统计学意义(P<0.01或P<0.05,表1)。
表1 Poly(I:C)、LPS及PGN刺激后16HBEs细胞向顶侧及基底侧分泌IL-8、GM-CSF和TNF-α的含量(pg/m l,±s,n=3)Tab. 1 Apical and basal content of IL-8, GM-CSF and TNF-α in 16HBEs after stimulation by Poly(I:C), LPS and PGN(pg/m l,±s,n=3)

表1 Poly(I:C)、LPS及PGN刺激后16HBEs细胞向顶侧及基底侧分泌IL-8、GM-CSF和TNF-α的含量(pg/m l,±s,n=3)Tab. 1 Apical and basal content of IL-8, GM-CSF and TNF-α in 16HBEs after stimulation by Poly(I:C), LPS and PGN(pg/m l,±s,n=3)
(1)P<0.05, (2)P<0.01 compared with control group
?
3 讨 论
天然免疫应答是气道黏膜抵御外界病原体的一种与生俱来的防御机制。气道上皮细胞通过自身表达的多种Toll样受体来特异性识别不同病原体的特定结构,启动防御机制并清除入侵病原体[9-10]。气道黏膜通过气道上皮细胞间的紧密连接构成一道天然物理屏障,不仅具有控制细胞生长分化、维持上皮细胞正常极性及通透性的作用,还将黏膜下组织结构与外界隔绝,避免病原体向下侵袭[11],维持黏膜屏障的完整性,是发挥天然免疫功能的一个重要方面。本研究发现,TLR3特异性配体Poly(I:C)可导致气道上皮细胞间离子及大分子物质通透性增加,而LPS及PGN对细胞间通透性无明显影响,表明TLR3受体激活是破坏气道黏膜完整性的一个相关因素。文献报道,LPS能破坏血-脑脊液[12]、肠道[13]等黏膜屏障,PGN刺激后皮肤角质细胞通透性增加[14],这些差异可能与实验细胞的种系不同有关,也反映出相同的TLR配体对不同黏膜的影响有所不同。气道黏膜屏障破坏有可能为细菌、各种抗原侵袭深部组织创造条件。Sajjan等[15]报道鼻病毒(RV)感染后气道黏膜屏障被破坏,流感嗜血杆菌、金黄色葡萄球菌、铜绿假单胞菌等细菌通过细胞间向下侵袭的数量相应增加,可见维持黏膜屏障的完整性对避免黏膜下组织损伤具有一定意义。
气道上皮细胞在病原微生物等外界刺激下可产生多种细胞因子和趋化因子,这种化学屏障功能具有招募并激活免疫细胞参与局部炎症的重要作用,是气道黏膜天然免疫反应的另一组成部分[11]。Ohkuni等[16]研究发现,Poly(I:C)刺激人原代鼻黏膜上皮细胞后,不仅细胞间通透性增加,而且IL-8和TNF-α蛋白的分泌明显增加,表明上呼吸道黏膜物理屏障破坏与炎性介质表达增加同时存在,并都与p38MAPK被激活有关,提示两种反应共用同一条信号通路。本研究显示,Poly(I:C)、LPS及PGN可不同程度地刺激气道上皮细胞表达IL-8、GM-CSF及TNF-α蛋白,其中以Poly(I:C)的刺激作用最为明显。IL-8是一种重要的中性粒细胞趋化因子,可招募循环中的中性粒细胞向组织浸润并释放溶酶体酶,产生活性氧,从而损伤周围组织[17]。GM-CSF具有调节嗜酸细胞成熟、分化、活化、凋亡和脱颗粒等功能,参与嗜酸细胞性炎症的形成[18]。前炎性细胞因子TNF-α主要由活化的单核巨噬细胞产生[19],可引起血管内皮损伤,增加微血管通透性,诱导上皮、内皮细胞表达黏附分子,刺激血小板活化因子(PAF)、前列腺素(PGs)、白三烯(LTs)等炎性介质合成,同时具有促进IL-8、GM-CSF分泌,加重炎症细胞浸润与活化等作用[20]。本研究结果表明,气道上皮细胞是病原体感染后多种炎性因子产生的重要来源之一。LPS及PGN刺激后炎性介质表达虽升高,但对黏膜屏障无明显影响,说明化学屏障的激活与物理屏障的破坏不一定会同时出现,提示黏膜屏障及炎性介质表达可能受不同信号通路的调控,其分子机制值得进一步深入研究。
黏膜屏障破坏有利于病原体向深部侵袭,造成黏膜下组织细胞的激活,如Papadopoulos等[21]曾在病毒感染后的气道黏膜下成纤维细胞内发现病毒颗粒,而多种细胞的激活成为炎性介质增多的其他来源,如Bedke等[22]发现鼻病毒感染刺激人支气管成纤维细胞IL-6、IL-8、RANTES分泌增多,Baines等[23]发现LPS刺激后中性粒细胞中IL-8、IL-1β和TNF-α分泌增加,因此我们推测气道上皮细胞是病原体进入下呼吸道后首先接触的靶器官,气道黏膜的天然免疫应答反应可能是气道炎症的一个启动因素。
我们前期研究显示,Poly(I:C)及LPS刺激单层培养的16HBEs细胞后,IL-8和IP-10等炎性介质表达增高[24]。上皮细胞生长时会产生极性,导致顶侧与基底细胞膜的结构和受体表达有所不同[25],但其生物学功能方面的差异尚不得而知。在本研究中,我们采用Transwell系统培养的16HBEs具有正常细胞极性,为研究细胞顶侧与基底侧的功能差异提供了一种可选择的体外气道黏膜模型[26]。本实验结果显示,IL-8及GM-CSF在细胞顶侧的浓度有高于基底侧的趋势,表明气道上皮细胞具有介导部分炎性介质定向表达的能力,炎性介质向腔面一侧释放形成浓度梯度,部分解释了炎性细胞向气道浸润及向气道腔内聚集的分子机制。同时我们发现,GMCSF在Poly(I:C)刺激后形成的浓度差异远较IL-8及TNF-α的浓度差异明显,可能有利于嗜酸细胞向黏膜下聚集,导致气道炎症向Th2型炎症方向倾斜。
综上,Poly(I:C)可在导致人气道黏膜屏障破坏的同时刺激细胞向顶侧方向分泌炎性介质,LPS及PGN亦可刺激气道上皮细胞分泌炎性介质,提示病毒及细菌感染所致气道炎症与气道黏膜天然免疫应答反应有关,进一步深入研究其分子机制将为控制气道炎症提供新的手段。
[1] Sw ind le EJ, Collins JE, Davies DE. Breakdown in epithelial barrier function in patients with asthma: identification of novel therapeutic app roaches[J]. J Allergy C lin Immuno l, 2009, 124(1): 23-34.
[2] Fang MM, Wang D, Zhang B. Relationship between To lllike receptor-mediated innate immune response and common pathogens lung infection[J]. Int J Respir, 2012, 32(14): 1070-1074.[方明明, 王东, 张波. Toll样受体介导的天然免疫应答与常见病原体肺部感染之间的关系[J]. 国际呼吸杂志, 2012, 32(14): 1070-1074.]
[3] Jackson DJ, Sykes A, Mallia P,etal. Asthma exacerbations:origin, effect, and prevention[J]. J Allergy Clin Immunol, 2011, 128(6): 1165-1174.
[4] Li Q, Chen P, Chen LA,etal. New advances in prevention and treatment for respiratory disease[J]. Med J Chin PLA, 2010, 35(9): 1074-1078. [李琦, 陈萍, 陈良安, 等. 呼吸系统疾病防治新进展[J]. 解放军医学杂志, 2010, 35(9): 1074-1078.]
[5] Eisele NA, Anderson DM. Host defense and the airway epithelium: frontline responses that protect against bacterial invasion and pneumonia[J]. J Pathog, 2011: 249802.
[6] Abdelsadik A, Trad A. Toll-like recep tors on the fork roads between innate and adaptive immunity[J]. Hum Immunol, 2011, 72(12): 1188-1193.
[7] Choi JP, Kim YS, Tae YM,etal. A viral PAMP double-stranded RNA induces allergen-specific Th17 cell response in the airways which is dependent on VEGF and IL-6[J]. Allergy, 2010, 65(10): 1322-1330.
[8] Bauer S, Müller T, Hamm S. Pattern recognition by Toll-like receptors[J]. Adv Exp Med Biol, 2009, 653: 15-34.
[9] Waterer GW. Airway defense mechanisms[J]. Clin Chest Med, 2012, 33(2): 199-209.
[10] Li YQ, Xu WL, Yan JP,etal. Effect of Toll-like receptor-4 and NF-κB on expression of matrix metalloprotease 9 induced by lipopolysaccharide in human airway epithelial cells[J]. Med J Chin PLA, 2011, 36(10): 1048-1052. [李亚清, 许武林, 严建平, 等. Toll样受体4及核因子-κB在脂多糖诱导的气道上皮细胞基质金属蛋白酶9表达中的作用[J]. 解放军医学杂志, 2011, 36(10): 1048-1052.]
[11] Holgate ST. The sentinel role of the airway epithelium in asthma pathogenesis[J]. Immunol Rev, 2011, 242(1): 205-219.
[12] Choi JJ, Choi YJ, Chen L,etal. Lipopolysaccharide potentiates polychlorinated biphenyl-induced disruption of the blood-brain barrierviaTLR4/IRF-3 signaling[J]. Toxicology, 2012, 302(2-3): 212-220.
[13] Gu L, Li N, Gong J,etal. Berberine am eliorates intestinal epithelial tight-junction damage and down-regulates myosin light chain kinase pathways in a mouse model of endotoxinem ia[J]. J Infect Dis, 2011, 203(11):1602-1612.
[14] Yuki T, Yoshida H, Akazawa Y,etal. Activation of TLR2 enhances tight junction barrier in epidermal keratinocytes[J]. J Immunol, 2011, 187(6): 3230-3237.
[15] Sajjan U, Wang Q, Zhao Y,etal. Rhinovirus disrupts the barrier function of polarized airway epithelial cells[J]. Am J Respir Crit Care Med, 2008, 178(12): 1271-1281.
[16] Ohkuni T, Kojima T, Ogasawara N,etal. Poly(I:C) reduces expression of JAM-A and induces secretion of IL-8 and TNF-αviadistinct NF-κB pathways in human nasal epithelial cells[J]. Toxicol Appl Pharmacol, 2011, 250(1): 29-38.
[17] Suzaki I, Asano K, Shikama Y,etal. Suppression of IL-8 production from airway cells by tiotropium brom ideinvitro[J]. Int J Chron Obstruct Pulmon Dis, 2011, 6: 439-448.
[18] Lopez AF, Williamson DJ, Gamble JR,etal. Recombinant human granulocyte-macrophage colony-stimulating factor stimulatesinvitromature human neutrophil and eosinophil function, surface receptor expression, and survival[J]. J Clin Invest, 1986, 78(5): 1220-1228.
[19] Clark IA. How TNF was recognized as a key mechanism of disease[J]. Cytokine Grow th Factor Rev, 2007, 18(3-4): 335-343.
[20] Lampinen M, Carlson M, Håkansson LD,etal. Cytokine-regulated accumulation of eosinophils in inflammatory disease[J]. Allergy, 2004, 59(8): 793-805.
[21] Papadopoulos NG, Bates PJ, Bardin PG,etal. Rhinoviruses infect the lower airways[J]. J Infect Dis, 2000, 181(6): 1875-1884.
[22] Bedke N, Haitchi HM, Xatzipsalti M,etal. Contribution of bronchial fibroblasts to the antiviral response in asthma[J]. J Immunol, 2009, 182(6): 3660-3667.
[23] Baines KJ, Simpson JL, Scott RJ,etal. Immune responses of airway neutrophils are impaired in asthma[J]. Exp Lung Res, 2009, 35(7): 554-569.
[24] Zhang JX, Xu WJ, Han YP,etal. Effects on chemotactic factor expression in bronchial epithelial cells by co-stimulation of po ly(I:C) and lipopo lysaccharide and the underlying mechanism[J]. Chin J Cell Mol Immunol, 2012, 28(10): 1046-1050. [张景熙, 胥武剑, 韩一平, 等. Poly(I:C)和LPS共刺激对人气道上皮细胞趋化因子表达的影响及机制[J]. 细胞与分子免疫学杂志, 2012, 28(10): 1046-1050.]
[25] Chen YT, Gallup M, Nikulina K,etal. Cigarette smoke induces epidermal grow th factor receptor-dependent redistribution of apical MUC1 and junctional beta-catenin in polarized human airway epithelial cells[J]. Am J Pathol, 2010, 177(3): 1255-1264.
[26] Rezaee F, Meednu N, Emo JA,etal. Polyinosinic:polycytidylic acid induces protein kinase D-dependent disassembly of apical junctions and barrier dysfunction in airway epithelial cells[J]. J Allergy Clin Immunol, 2011, 128(6): 1216-1224.
Effects of Poly(I:C), LPS and PGN stimulation on the innate immune function of human bronchial epithelium
ZHANG Jing-xi, ZHAO Li-jun, SHI Hui, BAI Chong, LI Qiang
Department of Respiratory Diseases, Changhai Hospital, Second Military Medical University, Shanghai 200433, China
This work was supported by the National Natural Science Foundation of China (81100017) and Shanghai Health Bureau Foundation(2010065)
ObjectiveTo study the effect of polyinosinic:polycytidylic acid (poly(I:C)), lipolysaccharide (LPS), peptidoglycan (PGN) on the barrier function and inflammatory mediators release of bronchial epithelium, and explore the impact of different specific Toll-like receptor (TLR 2, 3, 4) ligands on airway mucosal innate immune responses.MethodsPolarized human bronchial epithelial cells (16HBEs) were cultured using transwell system to establish human bronchial epithelium modelinvitro. The stimulation of Poly(I:C), LPS and PGN, respectively, was given on 16HBEs apically. The permeabilities of m icromolecule and macromolecule between cells were measured by detecting trans-epithelial electrical resistance (TER) and basolateral medium FITC-dextran concentrations after 24h stimulation. IL-8, GM-CSF and TNF-α protein content of apical and basal supernatants released by 16HBEs were measured by ELISA after 24h stimulation.Results10μg/m l Poly(I:C) resulted in decrease of TER and reduction of increase of FITC-dextran permeability significantly (P<0.001), while 10μg/m l LPS and 100μg/m l PGN showed no obvious effects on TER and FITC-dextran permeability. Poly(I:C), LPS and PGN induced an increase in apical and basolateral IL-8, TNF-α release and apical GM-CSF release of the cells. There was no change in basal expression of GM-CSF after being stimulated by LPS and PGN. The apical increase in IL-8 and GM-CSF was higher in Poly(I:C), LPS and PGN groups than their basal increase, thus forming the concentration gradient between two sides of the polarized cells.ConclusionsPoly (I:C) can damage the barrier integrity of the bronchial epithelium, leading to an increase in m icromolecular and macromolecular permeability, and induce the secretionof inflammatory mediators towards the top side at the same time. LPS and PGN can only induce the secretion of inflammatory mediators towards the top side m ildly, w ithout affecting the barrier function. It is suggested that airway mucosal innate immune response through TLR signaling pathways may be involved in airway inflammation caused by virus and bacterial infection.
epithelial cells; poly I-C; lipopolysaccharides; peptidoglycan; immunity, natural; immunity, mucosal
R562
A
0577-7402(2013)07-0552-05
2012-12-29;
2013-03-17)
(责任编辑:沈宁)
国家自然科学基金(81100017);上海市卫生局面上项目基金(2010065)
张景熙,医学博士,副主任医师,副教授。主要从事气道黏膜屏障与免疫方面的研究
200433 上海 第二军医大学长海医院呼吸内科(张景熙、赵立军、石荟、白冲、李强)
