罗格列酮对脓毒症大鼠空肠短肽载体的调控机制研究
2013-08-07刘丽平郭鸿尹超张磊侯启亮张斌刘健李斌
刘丽平,郭鸿,尹超,张磊,侯启亮,张斌,刘健,李斌
罗格列酮对脓毒症大鼠空肠短肽载体的调控机制研究
刘丽平,郭鸿,尹超,张磊,侯启亮,张斌,刘健,李斌
目的探讨罗格列酮对脓毒症大鼠空肠短肽载体(PepT1)表达的调控作用及其机制。方法健康成年SD大鼠48只,随机分为盲肠结扎穿刺(CLP)组(C组)、假手术组(S组)、罗格列酮组(R组)、罗格列酮+胰岛素组(RI组)、CLP+胰岛素组(CI组)和正常对照组(N组),每组8只。C、CI、S组大鼠术前30m in给予等量生理盐水灌胃;R、RI组CLP前30min给予罗格列酮(20mg/kg)灌胃;RI、CI组在CLP后150m in经股静脉注射胰岛素(10U/kg);N组大鼠未做任何处理。6组大鼠分别于术前30m in及术后30、60、90、120、150m in测空腹血糖,并在150m in时取动脉血和近端空肠待检。采用紫外分光光度法测定血清D-乳酸水平,ELISA法检测血清IL-6、TNF-α、IL-10水平变化,Western blotting检测空肠PepT1表达。结果术前给予罗格列酮可降低脓毒症大鼠呼吸频率、外周血中性粒细胞水平及CLP术后血糖,降低血清炎性因子TNF-α、IL-6、IL-10水平以及D-乳酸水平,增加基础状态下和胰岛素刺激下的PepT1表达。结论罗格列酮可通过降低炎性因子水平而提高脓毒症时空肠肠黏膜PepT1的表达。
脓毒症;胰岛素;罗格列酮;寡肽转运蛋白
脓毒症是临床常见的危重病症,病情进展迅速,救治难度大,病死率高达30%~70%[1-2]。胃肠道是集营养、代谢、免疫和屏障等功能于一体的器官,也是脓毒症过程中多器官功能衰竭(MODS)的启动器官[3-5]。脓毒症导致的肠道功能衰竭可引起明显的肠内营养吸收障碍。短肽载体(PepT1)是肠道吸收糖及蛋白质分解产物短肽(二肽、三肽)的主要途径,胰岛素在体外可调控PepT1的表达及功能,而脓毒症状况下存在胰岛素抵抗。胰岛素增敏剂罗格列酮为过氧化物酶体增生物激活受体γ(PPARγ)激动剂,可减轻炎症反应,改善胰岛素抵抗。本研究建立脓毒症大鼠模型,以探讨罗格列酮对脓毒症肠道损伤的作用及其机制,寻求新的治疗脓毒症肠道吸收功能障碍的药物靶点,为脓毒症肠道功能障碍的调控提供理论依据。
1 材料与方法
1.1实验动物及主要试剂 健康雄性SD大鼠48只(兰州大学动物实验中心提供),10~12周龄,体重270~340g,均给予标准饲养,自由饮水,术前12h禁食。D-乳酸标准品、D-乳酸脱氢酶及辣根过氧化物酶均购自美国Sigma公司;肿瘤坏死因子α(TNF-α)试剂盒,白细胞介素6、10(IL-6、IL-10)购自北京中杉金桥生物技术有限公司;抗大鼠PepT1抗体购自美国Santa Cruz生物公司;罗格列酮购自贵州圣济堂制药有限公司。
1.2分组及给药 48只实验大鼠随机分为6组,每组8只。盲肠结扎穿刺(CLP)组(C组):在CLP前30m in以生理盐水灌胃;假手术组(S组):手术过程基本同C组,但既不结扎也不穿刺盲肠,术前30m in予等量生理盐水灌胃;罗格列酮组(R组):在CLP前30m in予20mg/kg罗格列酮灌胃;罗格列酮+胰岛素组(RI组):CLP前30m in予20mg/kg罗格列酮灌胃,剂量和给药时间参考文献[5]、[6],CLP后150m in股静脉注射10U/kg胰岛素;CLP+胰岛素组(CI组):手术过程同C组,在CLP后150m in由股静脉注射10U/kg胰岛素;正常对照组(N组):大鼠未给予任何处理。CLP后每30m in测血糖1次,至第150m in结束(预实验表明CLP后高血糖持续时间为180~210m in)。腹腔注射10%水合氯醛(3.6mg/kg)快速麻醉,股静脉注射胰岛素,3m in后心脏穿刺取血,离心,取上清-80℃保存,待测血清TNF-α、IL-6、IL-10及D-乳酸水平。切除长约5cm近端空肠,用载玻片刮取肠黏膜后立即于-80℃保存待测短肽载体。
1.3脓毒症模型建立 按文献[7]的方法行CLP。大鼠腹腔注射10%水合氯醛(3.6mg/kg)快速麻醉后,行腹部正中切口(约2cm),游离盲肠,在回盲瓣下结扎盲肠,保持肠管通畅,在肠系膜对侧用20号针头穿刺2次,轻轻挤压保持穿刺点开放。开始计时后,将盲肠放回腹腔,用3号丝线连续缝合关腹。采用生理盐水(50m l/kg)皮下注射复苏代替术中的液体丢失,手术时间20m in。
1.4检测指标 ①实验前30m in记录体重、空腹血糖。②采用酶联免疫吸附试验(ELISA)检测血清TNF-α、IL-6、IL-10水平。③采用酶联紫外分光光度法测定血清D-乳酸水平,以评价肠道炎症和损伤程度。④通过触摸观察胸廓动度检测大鼠呼吸频率,并按标准临床检验学方法检测中性粒细胞。⑤采用Western blotting检测PepT1蛋白表达:空肠黏膜研磨后立即放入RIPA裂解液,离心30m in;吸取上清,考马斯亮蓝法(Brad ford法)测定样本中的蛋白浓度;行丙烯酰胺凝胶电泳,转膜;加入抗大鼠PepT1抗体(含5%胎牛血清的PBS液按1:1000浓度稀释),4℃水平摇床缓慢摇晃孵育过夜;加入辣根过氧化物酶标记的羊抗兔IgG二抗(含胎牛血清的PBS液按1:10 000浓度稀释),室温下水平摇床上缓慢摇晃杂交2h。显影,曝光,采集图像并分析。
1.5统计学处理 应用SPSS 16.0软件进行统计分析,计量资料以±s表示,多组间比较采用重复测量设计的方差分析和单因素方差分析,进一步两两比较采用LSD-t法,检验水准α=0.05。
2 结 果
2.1体重及血糖浓度 术前各组大鼠体重及体温与术后150m in比较无明显差别(P=0.970,P=0.920)。不同处理方式及不同时间点大鼠血糖值均有明显差异(分别为F=9.262,P=0.001;F=25.067,P=0.000)。C组CLP术后各时间点血糖均较术前明显升高(P<0.05),且术后30m in血糖高于120、150m in时(P<0.05)。S组、R组、N组CLP术后各时间点血糖无明显差异。C组CLP术后30、60m in时血糖较S、R、N组明显升高(P<0.05,表1)。
表1 CLP后各时间点血糖浓度(mmol/L,±s,n=8)Tab.1 Level of blood sugar at each time point after CLP (mmol/L±s,n=8)

表1 CLP后各时间点血糖浓度(mmol/L,±s,n=8)Tab.1 Level of blood sugar at each time point after CLP (mmol/L±s,n=8)
(1)P<0.05 compared with group C; (2)P<0.05 compared with 0m in; (3)P<0.05 compared with 30m in
Group
2.2呼吸频率及中性粒细胞计数 与S组比较,C组大鼠呼吸频率在CLP后150m in明显增快(P<0.05);与C组比较,R组大鼠呼吸频率和中性粒细胞计数均明显降低(P<0.05或P<0.01),即术前罗格列酮治疗可降低脓毒症大鼠呼吸频率和中性粒细胞计数。各组大鼠CLP后150m in腹腔发臭,肠内容物从穿刺孔流出,并有血性腹水。
2.3炎症因子水平 与N组比较,C、S、R、RI、CI组TNF-α、IL-6、IL-10水平均升高,差异有统计学意义(P<0.05);与R组比较,C组、CI组TNF-α、IL-6、IL-10水平明显增高,差异有统计学意义(P<0.05,表2)。
2.4肠道炎症和损伤程度评估 反映肠道炎症和损伤程度的指标D-乳酸在C组(15.09±2.21mg/L)、S组(6.1±1.13mg/L)、R组(7.9±1.32mg/L)、RI组(7.1±1.21mg/L)、CI组(14.8±1.98mg/L)均较N组(3.8±0.89m g/L)升高,差异有统计学意义(P<0.05);与R组比较,C组、CI组D-乳酸水平明显增高,差异有统计学意义(P<0.05)。
2.5空肠PepT1表达变化 与其他各组比较,C组PepT1表达明显降低(P<0.05),即CLP降低PepT1表达。S、R、CI三组之间PepT1表达无明显差异,与C组比较,R组PepT1表达增加(P<0.05),与CI组比较,RI组PepT1表达增加(P<0.05),即罗格列酮可增加基础状态下和胰岛素刺激下的PepT1表达。PepT1表达在N组和RI组之间无明显差异(P=0.214,图1)。
表2 各组炎症因子水平比较(pg/L,±s,n=8)Tab.2 Comparison of inflammation factors in each group (pg/L,±s,n=8)

表2 各组炎症因子水平比较(pg/L,±s,n=8)Tab.2 Comparison of inflammation factors in each group (pg/L,±s,n=8)
(1)P<0.05 compared with N group; (2)P<0.05 compared with R group
?
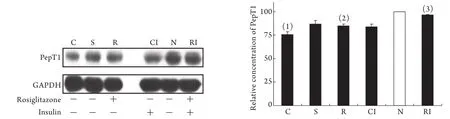
图1 PepT1蛋白表达情况(Western blotting)Fig.1 Detection of PepT1 protein expression(Western blotting)
3 讨 论
罗格列酮属噻唑烷二酮类化合物,可激活胰岛素主要靶组织中的PPARγ受体[8],抑制促炎症基因的表达,减少炎症因子TNF-α、IL-6和PAI-1的释放量。本研究表明,提前给予罗格列酮治疗可明显降低循环中的TNF-α浓度,此结果与其他研究一致[9]。
本研究结果显示,CLP模型大鼠出现了高血糖症,且血清炎性因子TNF-α、IL-6、IL-10水平明显升高,肠黏膜通透性增加,给予罗格列酮后血糖、炎性因子及肠黏膜通透性均降低。CLP后大鼠空肠PepT1表达降低,无论单独应用还是与胰岛素联合应用,罗格列酮均能提高脓毒症大鼠小肠黏膜PepT1的表达,即罗格列酮可上调脓毒症大鼠小肠蛋白质主要吸收途径——PepT1的表达。
本研究结果还表明,CLP后大鼠空肠PepT1表达降低,而补充外源性胰岛素可增加PepT1表达,说明脓毒症大鼠肠道可能存在胰岛素信号通路异常;罗格列酮可增加CLP后大鼠PepT1的表达,与罗格列酮降低炎性因子TNF-α、IL-6水平有关;CLP大鼠给予罗格列酮和胰岛素后,PepT1表达较只给予胰岛素时明显增加,说明提前给予罗格列酮可通过降低炎性因子TNF-α、IL-6水平改善空肠局部的胰岛素信号通路。
胰岛素对肠道生长、细胞成熟、酶的表达等具有重要作用,可改善大鼠空肠短肽载体PepT1的表达及功能[10-11],而PepT1参与小肠中二肽或三肽的转运,是机体吸收蛋白质分解产物的主要途径[12-13]。PepT1活性在临床营养和药物治疗方面有重要作用[14-15],调控脓毒症短肽载体的表达,对改善肠功能障碍有重要意义。PepT1活性与胰岛素水平有关,慢性胰岛素缺乏可影响PepT1的表达及其转运活性。脓毒症大鼠出现高血糖症,可能同时存在空肠胰岛素信号通路异常;罗格列酮可能通过降低空肠局部的炎症反应,改善异常的胰岛素信号通路,对外源性胰岛素调控PepT1起辅助作用。有文献报道,磷脂酰肌醇-3激酶和磷酸肌醇依赖的激酶(PDK1)参与了正常情况下PepT1的调控[16],罗格列酮增加PepT1表达可能与IRS/PI3K/Akt通路和磷酸化PKC有关,但仍需进一步研究证实。
综上,本研究显示,CLP后大鼠空肠PepT1表达下降,提前给予罗格列酮可通过降低炎症反应改善严重感染并发的高血糖症,维持肠道短肽载体PepT1的水平,此结果可能为临床感染患者的营养支持模式提供理论依据,为临床保护和支持肠道功能提供有效途径。
[1] Jiao LN, Yao YM, Shou ST. Effects of XUEBIJING injection on hepatic gelsolin and inflammatory cytokine in septic rats[J]. Med J Chin PLA, 2011, 36(1): 14-16. [焦丽娜, 姚咏明, 寿松涛. 血必净注射液对脓毒症大鼠肝组织凝溶胶蛋白及炎症因子的影响[J]. 解放军医学杂志, 2011, 36(1): 14-16.]
[2] Wang ZG. Viewpoint on the current status of researches on sepsis[J]. Med J Chin PLA, 2012, 37(11): 1011-1014. [王正国.当前脓毒症研究的思考[J]. 解放军医学杂志, 2012, 37(11): 1011-1014.]
[3] Van den Berghe G. How does blood glucose control with insulin save lives in intensive care[J]? J Clin Invest, 2004, 114(9): 1187-1195.
[4] Cuzzocrea S, Pisano B, Dugo L,etal. Rosiglitazone and 15-deoxy-Delta12,14-prostaglandin J2, ligands of the peroxisome proliferator-activated receptor-gamma (PPAR-gamma), reduce ischaem ia/reperfusion injury of the gut[J]. Br J Pharmacol, 2003, 140(2): 366-376.
[5] Wang WP, Zheng XY, Zhu ZQ,etal. Effects of early using of low dose short peptide enteral nutrition on serum IL-6 level in patients with sepsis[J]. J Zhengzhou Univ (Med Sci), 2010, 45(2): 299-301. [王万朋, 郑湘予, 朱志强, 等. 早期低剂量应用短肽类肠内营养液对脓毒症患者血清白细胞介素-6水平的影响[J]. 郑州大学学报(医学版), 2010, 45(2): 299-301.]
[6] Bao Y, Jia RH, Yuan J,etal. Renal protection of rosiglitazone and its mechanism in diabetic rats[J]. Chin J Nephrol, 2007, 4(23): 224-229. [包艳, 贾汝汉, 袁军, 等. 罗格列酮对糖尿病大鼠肾脏保护作用机制的探讨[J]. 中华肾脏病杂志, 2007, 4(23): 224-229.
[7] Singleton KD, W ischmeyer PE. Distance of cecum ligated in fluences mortality, tum o r necrosis facto r-alpha and interleukin-6 expression following cecal ligation and puncture in the rat[J]. Eur Surg Res, 2003, 35(6): 486-491.
[8] Deng WJ, Ma XJ, Qiu HL,etal. The effect of rosiglitazone and repaglinide on pathophysiology in patients with new ly diagnosed type 2 diabetes[J]. Chin J Pract Intern Med, 2010, 30(9): 823-826. [邓文娟, 马晓静, 邱慧玲, 等. 罗格列酮及瑞格列奈对新诊断2型糖尿病急性相胰岛素分泌功能影响的研究[J]. 中国实用内科杂志, 2010, 30(9): 823-826.]
[9] Schm idt MV, Brüne B, von Knethen A. The nuclear hormone receptor PPARγ as a therapeutic target in major diseases[J]. Sci World J, 2010, 10: 2181-2197.
[10] Bikhazi AB, Skoury MM, Zwainy DS. Effect of diabetes mellitus and insulin on the regulation of the PepT 1 symporter in rat jejunum[J]. Mol Pharm, 2004, 1(4): 300-308.
[11] Der-Boghossian AH, Saad SR, Perreault C,etal. Role of insulin on jejunal PepT1 expression and function regulation in diabetic male and female rats[J]. Can J Physiol Pharmacol, 2010, 88(7): 753-759.
[12] Ogihara H, Saito H, Shin BC,etal. Immuno-localization of H+/ peptide cotransporter in rat digestive tract[J]. Biochem Biophys Res Commun, 1996, 220(3): 848-852.
[13] Shi B, Song D, Xue H,etal. Abnormal expression of the peptide transporter PepT1 in the colon of massive bowel resection rat: a potential route for colonic mucosa damage by transport of fMLP[J]. Dig Dis Sci, 2006, 51(11): 2087-2093.
[14] Mathews D, Adibi SA. Peptide absorption[J]. Gastroenterology, 1976, 71(1): 151-161.
[15] Adibi SA. The oligopeptide transporter (PepT-1) in human intestine: bio logy and function[J]. Gastroenterology, 1997, 113(1): 332-340.
[16] Rexhepaj R, Rotte A, Pasham V,etal. PI3 kinase and PDK1 in the regu lation of the electrogenic intestinal dipep tide transport[J]. Cell Physiol Biochem, 2010, 25(6): 715-722.
Regulation mechanism of rosiglitazone on the oligopeptide transporter (Pep T1) in sep tic rats after cecal ligation and puncture
LIU Li-ping, GUO Hong, YIN Chao, ZHANG Lei, HOU Qi-liang, ZHANG Bin, LIU Jian, LI Bin*
Department of Critical Care Medicine, First Hospital of Lanzhou University, Lanzhou 730000, China
*
, E-mail: lynd0001@163.com
This work was supported by the Research Project Funds for the Central Universities (lzujbky-2010-202)
ObjectiveTo exp lore the regulation effect and its mechanism of rosiglitazone on the oligopeptide transporter (PepT1) expression in rats after cecal ligation and puncture (CLP).MethodsForty-eight SD rats were random ly divided into 6 groups (8 each): CLP group (C group), sham operation group (S group), CLP+rosiglitazone group (R group), CLP+rosiglitazone+insulin group (RI group), CLP+insulin group (CI group), and normal control group (N group). Rats in C, S and CI groups
0.9% NaCl solution by intragastric administration 30min before CLP or sham operation, while in R and RI group, rats received rosiglitazone instead. Rats in RI and CI group received insulin through femoral vein 150m in after CLP. Glucose was measured at 30min preoperatively and every 30min postoperatively (30, 60, 90, 120, 150min). Arterial blood and proximal jejunum were harvested at 150min. Plasma D-lactate was determined by ultraviolet spectrophotometry. Serum IL-6, TNF-α and IL-10 were determ ined by ELISA. Pept1 expression was detected by Western blotting.ResultsWhen rosiglitazone was given preoperatively, the respiratory rate, neutrophil count, glucose concentration, and the levels of TNF-α, IL-6, IL-10 and plasma D-lactate all decreased significantly after CLP (P<0.05 orP<0.01). Rosiglitazone-pretreatment increased PepT1 expression in both baseline and insulininduced conditions (P<0.05).ConclusionRosiglitazone may increase the PepT1 expression in jejunal mucosa by reducing inflammatory cytokines in sepsis.
sepsis; insulin; rosiglitazone; oligopeptide transporter
R631
A
0577-7402(2013)07-0557-04
2012-12-27;
2013-05-27)
(责任编辑:熊晓然)
中央高校基本科研业务费自由探索项目(lzujbky-2010-202)
刘丽平,医学硕士。主要从事重症医学方面的研究
730000 兰州 兰州大学第一医院重症医学科(刘丽平、郭鸿、尹超、张磊、侯启亮、张斌、刘健、李斌)
李斌,E-mail: lynd0001@163.com
